
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdf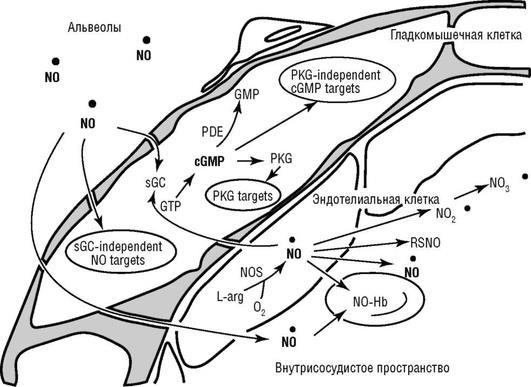
мускулатуры легочных сосудов и активирует растворимую гуанилатциклазу (cGMP). Повышение внутриклеточной концентрации cGMP расслабляет гладкую мускулатуру несколькими путями (рис. 25.17). Из-за быстрого окисления нитратов и нитритов биологический период полураспада в тканях оксида азота составляет несколько секунд.
Рис. 25.17. Сигнальные пути оксида азота в гладкомышечных клетках легочных сосудов
(Ichinose F. et al., 2004): PKG - cGMP-зависимая протеинкиназа; cGMP - циклический гуанозинмонофосфат; NOS - нитроксид синтетаза; L-arg - L-аргинин; sGC - растворимая гуанилатциклаза; RSNO - S-нитрозотиол
Ингаляция оксида азота (iNO) - лучше всего изученная терапия ПЛГ у новорожденных. Многочисленные мультицентровые РКИ и систематические обзоры показали, что ингаляция оксида азота снижает необходимость ЭКМО у доношенных детей с гипоксической дыхательной недостаточностью.
Физиологическое обоснование терапии NO в лечении гипоксической ДН заключается в способности молекулы оксида азота в легких снижать легочное сосудистое сопротивление (ЛСС) без снижения системного сосудистого сопротивления. Это выгодно отличает NO от внутривенно вводимых вазодилатато-ров, которые могут быть причиной системной вазодилатации и тяжелой артериальной гипотензии.
Персистирующая легочная гипертензия новорожденных - синдром, характеризующийся высоким ЛСС, приводящим к право-левому шунтированию крови через артериальный проток/овальное окно. В крайне тяжелых случаях развивается гипоксемия, рефрактерная к любой терапии, в конце концов приводящая к смерти. Способность iNO селективно снижать ЛСС в большинстве случаев приводит к значительному повышению РаО2 у 50-
60% пациентов (Finer N.N. et al., Cochrane Database Syst. Rev., 2006). Кроме того, низкие дозы iNO улучшают оксигенацию, перераспределяя легочный короток из плохо вентилируемых альвеол в хорошо вентилируемые. Возможна и иная польза от оксида азота.
Потенциальные эффекты низких доз NO при гипоксемической ДН (Kinsella J.,
Abman S., 2011):
•тяжелая гипоксемическая ДН;
•гипоплазия легких (на фоне маловодия) у доношенных и недоношенных новорожденных;
•лечение/профилактика ХЛЗ/БЛД; БЛД с сопутствующей легочной гипер-тензией;
•при тяжелой гипоксемии при ВДГ можно провести пробу с iNO;
•периоперационная легочная гипертензия при некоторых ВПС.
Рекомендуется назначать оксид азота в начале течения заболевания, это поможет снизить продолжительность ИВЛ, потребность в кислороде и продолжительность госпитализации. Отсутствие эффекта от ингаляции NO имеет важную диагностическую ценность для определения механизма гипоксемии - вероятны пороки развития сердечно-сосудистой системы или легочное паренхиматозное заболевание.
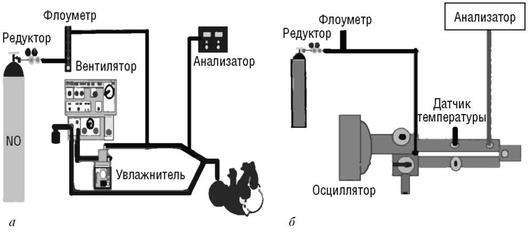
Оборудование (рис. 25.18).
1.Баллон с NO, c помощью редукторов подключенный к флоуметру.
2.Флоуметр очень низкого потока, с его помощью регулируется концентрация вдыхаемого NO. Ингаляционная линия потока газа от флоуметра должна быть подключена между увлажнителем (по некоторым данным перед увлажнителем) и ЭТТ, но не ближе 20 см от ЭТТ.
3.Электрохимический анализатор NO. Контролирует концентрацию NO во вдыхаемой смеси. Адаптер для линии отбора проб должен быть расположен как можно ближе к ЭТТ больного. Постоянный отбор проб газа в некоторых случаях может
создавать помехи работе датчика потока. При отсутствии анализатора достаточно точно дозировать поток NO флоуметром можно по следующей формуле:
Необходимая доза iNO (ррm) × газоток в дыхательном контуре (л/мин)/концентрация NO в баллоне (500 или 1000 ррm) = Поток NO от флоуметра (л/мин).
Например: (необходима доза 10 ррm × поток 10 л/мин) /1000 ррm = = 100/1000 = 0,1 л/мин.
Рис. 25.18. Схема подключения оборудования при традиционной ИВЛ (а) и ВЧ ИВЛ (б) (A
Teaching pack for nursing staff produced by INNVIVO Trial)
4. Аппарат ИВЛ с дыхательным контуром. Чем больше газоток в контуре, тем больше расход оксида азота. При больших потоках NO в контур может снижаться концентрация вдыхаемого О2. Ингаляция NO с учетом различий в респираторах может применяться с традиционными аппаратами ИВЛ, анестезиологическими, транспортными,
1.Проводить ингаляцию дозой 20 ррm, пока FiO2 не снизится менее 0,6 или в течение 4 ч (смотря что наступит раньше).
2.Если пациент «ответил» на iNO и оксигенация улучшилась, снижение FiO2 должно начаться немедленно по 2-5%.
3.Снижение дозы FiO2 или iNO должно делаться каждый раз, когда:
•предуктальная SрO2 >92%;
•PaO2 >60 мм рт.ст.;
•пре-постдуктальная разница SрO2<5%.
4.Попытка снижения iNO должна происходить как минимум каждые 24 ч.
5.Доза iNO может снижаться по 5 ррm каждые 15 мин до 5 ррm.
6.Доза iNO должна снижаться от 5 ррm до 1 ррm шагом по 1 ррm.
7.FiO2 при отмене iNO может повыситься на 15% до максимальных 75%.
8.Через 1 ч после отмены iNO необходимо назначить его снова в случае:
• FiO2 >0,75 для поддержания PaO2 >60 мм рт.ст. или SрO2 >92%;
• очевидного гемодинамического ухудшения.
После отмены iNO часто отмечается эффект «отдачи» - резкое снижение оксигенации вследствие быстрого повышения ЛСС, системной гипотензии из-за снижения сердечного выброса. Возможно, это связано с угнетением продукции эндогенного NO экзогенным, понижением активности NO-синтетазы или нарушением других биохимических реакций синтеза NO.
Мониторинг:
•мониторинг концентрации NO и NO2 во вдыхаемой смеси с помощью электрохимического анализатора; пробы газа должны отбираться в ин-спираторной части контура дистальнее участка введения, но не дальше чем 15 см от коннектора ЭТТ;
•при высоких дозах оксида азота (40-80 ррm) может развиться метгемогло-бинемия; это осложнение обычно не встречается при низких дозах (менее 20 ррm); определить концентрацию метгемоглобина крови следует через 1-4 ч после начала ингаляции, затем 1 раз в сутки;
•КОС, желательно в артериальной крови; через 1 ч после начала ингаляции, далее по показаниям;
•рентгенограмма органов грудной клетки каждые 24 ч;
•эхокардиография, желательно до процедуры, но не позднее 6 ч после начала.
Противопоказания:
•дуктусзависимые ВПС;
•тотальный аномальный дренаж легочных вен;
•ОАП с лево-правым шунтом; • ВЖК III-IV;
•концентрация тромбоцитов менее 100 000;
•относительное противопоказание: острая тяжелая левожелудочковая недостаточность (например, тяжелая асфиксия, осложнившаяся отеком легких).
недоношенных, интерес к терапии оксидом азота связан с его возможным влиянием на развитие легочной паренхимы и роста сосудов и снижением частоты ХЗЛ. Есть некоторые данные о снижении частоты ВЖК IV степени.
Резюме:
•ингаляция оксида азота улучшает оксигенацию и снижает частоту ЭКМО у доношенных и почти доношенных (с 34-й недели гестации) с ПЛГН;
•рекомендуемая стартовая доза доношенным детям 20 ррm, при отсутствии эффекта в течение 4 ч лечение должно быть отменено; при наличии эффекта доза должна снижаться до минимально эффективной;
•токсические свойства (метгемоглобинемия) обычно наблюдаются при очень высоких дозах (около 80 ррm iNO); но контроль уровня Met Hb должен проводиться в течение всего курса терапии NO.
•у недоношенных новорожденных пока недостаточно данных для рекомендации рутинного клинического использования.
25.9. РЕСПИРАТОРНАЯ ПОДДЕРЖКА ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (РДС, САМ, ПЛГН, БЛД)
РДС. Главные особенности современной респираторной терапии РДС заключаются в следующем:
•использование антенатальной стероидной терапии, стимулирующей легочное созревание;
•отсроченное пережатие пуповины у недоношенных, облегчающее плацентарную трансфузию;
•скорейшее начало СРАР для альвеолярного расправления, рекруитмента;
•раннее назначение сурфактанта;
•применение бережных методик дыхательной поддержки, таких как пузырьковый назальный СРАР;
•поддерживающая терапия (диагностика и лечение ОАП, рестриктивная инфузионная терапия, трофическое кормление и парентеральное питание, профилактическое назначение флюконазола).
Постоянное положительное давление в дыхательных путях (сontinuouspositive airway pressure, CPAP) - основная лечебная методика РДС (рис. 25.19) с момента, когда Gregory c соавт. в 1971 г. показал значительное снижение смертности
при РДС.
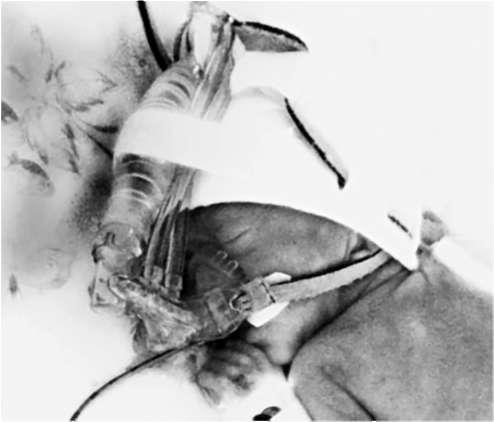
Рис. 25.19. CPAP через назальную маску аппаратом Infant Flow с генератором вариабельного потока Кислородотерапия являлась основной методикой терапии до введения
СРАР. Кислород назначался через палатку, носовые канюли или в кювез для лечения нетяжелого РДС. Также кислородотерапия применялась при уходе от СРАР или вентиляции легких.
CPAP поддерживает альвеолы в расправленном состоянии в конце выдоха, снижая праволевый легочный шунт. СРАР часто назначается через носовые канюли. Обзор Кокрановской базы данных (De Paoli A.G. et al., 2008) показывает, что короткие биназальные канюли более эффективны по сравнению с мононазальной канюлей (ниже частота реинтубаций). Метаанализ исследований профилактического использования назального СРАР для снижения заболеваемости и смертности у недоношенных с ЭНМТ и ОНМТ демонстрирует, что перемежающаяся вентиляция положительным давлением
(intermittent positive pressure ventilation, IPPV) не была выгодна (Subramaniam P. et al.,
2005). Ретроспективное исследование назального СРАР у недоношенных менее 27 нед гестации показывает, что вероятность применения назального СРАР составила 66% в первый день жизни и 80% на 2-й день жизни (Booth C. et al., 2006). Ретроспективный анализ первых 48 ч жизни 225 детей, родившихся на 23-28-й неделе гестации, обнаружил, что история течения заболевания и начальные газы крови не были адекватно оценены и привели к неудаче назального СРАР (Fuchs H. et al., 2011). Еще в одном исследовании не было выявлено снижения частоты смертности и БЛД при раннем назальном СРАР. 610 детей, родившихся на 25-28-й неделе гестации, были случайным образом распределены либо в группу назального СРАР, либо в группу интубации. Исходы оценивались на 28-й день жизни, на 36-й неделе гестации и перед выпиской. В группе СРАР была более высокая частота пневмоторакса (9% по сравнению с 3%), но и меньшее количество дней на вентиляции и меньше пациентов нуждались в кислороде на 28-й день жизни (Morley C.J. et al., 2008). СРАР является дополнительной терапией, которая назначается вслед за введением сур-фактанта, если вспомогательная вентиляция не требуется. Ретроспективное
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
исследование установило, что применение назального СРАР было успешным у 76% пациентов с массой тела менее 1250 г и у 50% детей менее 750 г при рождении (Narendran V. et al., 2003). СРАР может использоваться после экстуба-ции новорожденных с РДС с целью предотвращения ателектазов и апноэ недоношенных. РКИ, сравнившее пузырьковый (bubble) назальный СРАР и СРАР при помощи Infant Flow, говорит об одинаковой эффективности обоих методов. Пузырьковый СРАР также показал достоверно большую частоту успешных экстубаций и меньшую продолжительность СРАР у детей менее 14 дней жизни (Gupta S. et al., 2009).
Цель респираторной терапии детей с РДС состоит в поддержании pH 7,25- 7,4, PaO2 50-70 мм рт.ст., рCO2 40-65 мм рт.ст., в зависимости от клинического статуса.
Kirby и de Lemos ввели понятие вспомогательной вентиляции несколько десятилетий назад (Kirby R. et al., 1972). Вспомогательная вентиляция привела к снижению заболеваемости и смертности от РДС. Однако аппараты ИВЛ, используемые в прошлом, были связаны и с осложнениями вентиляции легких, такими как синдромы утечки воздуха, бронхолегочная дисплазия (БЛД как исход баротравмы и волюмотравмы легких), повреждение дыхательных путей, внутрижелудочковые кровоизлияния.
Научно-технические достижения в области микропроцессоров, датчиков, трансдьюсеров сделали возможным создание новых аппаратов ИВЛ, управляемых и пациентом, синхронизировавших механический вдох и попытку вдоха ребенка. Среди задач, которые технологически продолжают совершенствоваться сегодня, такие как обнаружение сигнала и его проведение, оптимальная доставка дыхательного объема, уход от механической вентиляции легких.
Произошли перемены и с точки зрения подхода. Сегодня мы рассматриваем вентиляцию легких как необходимую физиологическую поддержку в процессе восстановления легких пациента с РДС. В этой связи в задачу минимизации осложнений конвенциональной (традиционной) перемежающейся принудительной вентиляции (intermittent mandatory ventilation, IMV) входит стратегия пермиссивной гиперкапнии с поддержанием PaCO2 4555 мм рт.ст. и адекватного легочного объема. С точки зрения многих исследователей, этот подход может способствовать уходу от вентиляции во время восстановления легких от РДС.
Синхронизированная перемежающаяся принудительная вентиляция (synchronous intermittent mandatory ventilation, SIMV) - режим вентиляции легких, при котором некоторые вдохи пациента синхронизированы с аппаратными вдохами. Существует исследование (РКИ), которое доказало более низкую частоту БЛД (потребность в дополнительном кислороде в возрасте 36 нед) при SIMV по сравнению со стандартной IMV (47 и 72% соответственно). В другом исследовании, включившем недоношенных новорожденных 28-34 нед гестации с РДС, получивших заместительную терапию сурфактантом, при SIMV по сравнению с IMV были сокращены продолжительность интубации и потребность в кислороде.
Вспомогательная контролируемая вентиляция (аssist-control ventilation, А/С)
синхронизирована и поддерживает все попытки вдохов ребенка, также улучшает исходы у детей с РДС. Некоторые клиницисты используют режим поддержки давлением (pressuresupport ventilation, PSV) у пациентов, развивающих хронические легочные изменения.
Высокочастотная вентиляция (high-frequency ventilation, HFV), использующая очень маленький дыхательный объем, меньше анатомического мертвого пространства, и высокую частоту вентиляции, позволяет избежать значительных колебаний давления в дыхательных путях, которые наблюдаются при традиционной вентиляции. Это позволяет рассчитывать на снижение риска баротравмы, волюмотравмы, сердечно-сосудистых нарушений. Высокочастотная вентиляция была разработана для пациентов с синдромом
