
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdf•При подозрении вспышки создается комитет по купированию вспышки.
•Микробиологический скрининг на конкретный микроорганизм в течение вспышки.
•Проведение междисциплинарного аудита соблюдения больничной гигиены, гигиены рук и оценка факторов риска передачи грамотрицательных микроорганизмов.
•Генеральные уборки помещений.
•Когортная изоляция колонизированных и инфицированных пациентов, но не обязательно в изоляторы.
•Рассмотрение вопроса о сокращении коек или закрытии отделения на поступление пациентов для увеличения площади на одного пациента и соблюдения оптимального соотношения персонал:пациент до полного купирования вспышки.
•Создание эффективного механизма взаимодействия через сети.
•Информирование родителей о вспышке как можно быстрее и предоставление заранее подготовленных информационных бюллетеней о вспышках инфекций (Anthony M. et al.,
2013).
В систематический обзор, посвященный методам купирования вспышек в отделениях для новорожденных, были включены 30 исследований, объединивших 17 102 новорожденных, у 664 (3,9%) развилась инфекция. Ни одно мероприятие, проведенное отдельно, не снижало длительность вспышек и летальность. Исследования, в ходе которых было проведено множество вмешательств, показали значительное снижение летальности и продолжительности вспышки по сравнению с теми, которые использовали только базовое эпидемиологическое наблюдение. Страны с низким и средним уровнем доходов сообщили о наименьшем количестве вмешательств при купировании вспышек, и в этих исследованиях отмечена более высокая летальность, чем в странах со средним и высоким доходом (Birt J. еt al., 2016).
Применение пробиотиков
Как описано в главе 14, нередко в процессе тяжелого инфекционного процесса у новорожденного (например, сепсиса), особенно на фоне дефицита эн-терального питания, происходит транслокация в кровь микрофлоры кишечника (в том числе и антибиотикорезистентной). Именно поэтому неоднократно предпринимались попытки назначением пробиотиков уменьшить вероятность этого. В систематический обзор, посвященный применению пробиотиков (лактобактерии в комбинации и без, с бифидумбактериями) для профилактики некротического энтероколита (НЭК), были включены 24 РКИ с новорожденными, рожденными с массой тела <2500 г и/или на сроке гестации менее 37 нед
(табл. 24.6).
Таким образом, энтеральное применение пробиотиков предотвращает НЭК тяжелой степени и смертность от всех причин у недоношенных детей. Обзор имеющихся данных решительно поддерживает применение пробиотиков (Al-Faleh K., Anabrees J. et al., 2014).
В другом систематическом обзоре (1 РКИ, 472 новорожденных с низкой и экстремально низкой массой тела при рождении) было показано, что оральный лактоферрин снижает частоту позднего сепсиса у детей с массой тела менее 1500 г и наиболее эффективен у новорожденных с массой менее 1000 г. В то же время есть работы, в которых нет доказательств эффективности орального применения лактоферрина (как монопрепарата) для профилактики НЭК у недоношенных новорожденных (Venkatesh M.P., Abrams S.A., 2010; табл. 24.7).
Таблица 24.6. Эффективность применения оральных пробиотиков
Исследования пагибсимаба (антистафилококковый иммуноглобулин) продемонстрировали его безопасность, но снижения частоты сепсиса не наблюдалось
(Patel M., Kaufman D.A., 2015).
У новорожденных повышенный риск заражения из-за иммунокомпетентно-сти. Передача иммуноглобулинов от матери к плоду в основном происходит через 32 нед беременности, а их эндогенный синтез начинается через несколько месяцев после рождения. Введение внутривенного иммуноглобулина (ВВИГ) обеспечивает новорожденного иммуноглобулином G (IgG), который может связываться с рецепторами клеточной поверхности, оказывать опсоническую активность, активировать комплемент, стимулировать антителозависимую цитотоксичность и улучшать нейтрофильную хемолюминесценцию. Теоретически инфекционная заболеваемость и смертность могут быть снижены назначением ВВИГ.
Данные метаанализа (9 РКИ, 3973 пациента) не показали снижения смертности во время пребывания в больнице или смерти и тяжелой инвалидизации в двухлетнем возрасте у новорожденных с подозрением на инфекцию. Хотя данное исследование основано на небольшом размере выборки (я=266), это дополнительное свидетельство того, что обогащенный IgM ВВИГ не приводит к значительному снижению смертности во время пребывания в стационаре у новорожденных с подозрением на инфекцию. Не рекомендуется рутинное введение ВВИГ или IgG-обогащенного ВВИГ для предотвращения смертности у младенцев с подозрением на неонатальную инфекцию. Дальнейшие исследования не рекомендуются (Ohlsson A., Lacy J.B., 2015).
В другой систематический обзор было включено 19 исследований с 5000 недоношенными новорожденными и новорожденными с низкой массой тела. Назначение ВВИГ приводило к 3% снижению сепсиса и 4% снижению одного или нескольких эпизодов любой тяжелой инфекции, но не было связано со снижением частоты других неблагоприятных клинически значимых результатов, включая смертность. Профилактическое использование ВВИГ не связано с какими-либо краткосрочными серьезными побочными эффектами. Нет оснований для проведения дополнительных РКИ для проверки эффективности ранее изученных препаратов ВВИГ для снижения внутрибольничных инфекций у недоношенных и/или новорожденных с низкой массой тела (Ohlsson A., Lacy
J.B., 2013).
Считаем целесообразным, в дополнение к изложенному, ознакомиться с расширенными рекомендациями «Система профилактики и контроля за госпитальной инфекцией в отделениях (палатах) реанимации и интенсивно терапии для новорожденных в акушерских стационарах и детских больницах», написанных под руководством директора Департамента медицинской помощи детям и службы родовспоможения Минздрава России профессора Елены Николаевны Бай-бариной в Клинических рекомендациях «Неонатология» (под ред. Н.Н. Володина, Д.Н. Дегтярева, Д.С. Крючко. М., 2019).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Почему классический критерий определения «внутрибольничная инфекция» трудно применим в периоде новорожденности и какие инфекционные процессы у новорожденных бесспорно относят к госпитальным?
2.Какие микробы наиболее часто вызывают госпитальные инфекции в родильных домах и какие - в ОРИТН при разных вариантах инфицирования?
3.Какие штаммы микробов надо считать госпитальными?
4.Перечислите основные клинические симптомы тяжелых форм госпитальных инфекций.
5.Назовите наиболее частые госпитальные инфекционные заболевания.
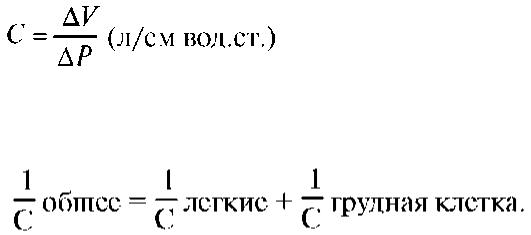
•наличие жидкости в интерстициальном пространстве легких и плевральной полости;
•объем крови в сосудах легких.
Аэродинамическое сопротивление (R - resistance) - сопротивление дыханию, возникающее при движении воздуха по дыхательным путям вследствие трения частиц воздуха о стенки дыхательных путей, определяется величиной давления, необходимого для проведения по дыхательным путям единицы газового объема в единицу времени:
R = P (P рот - Р альвеолярное) / Поток [см вод.ст./(лс)].
У новорожденных аэродинамическое сопротивление составляет 20-40 см вод.ст./(лс) [у взрослых - 1-2 см вод.ст./(лс)], при интубации трахеи увеличивается до 50-150 см вод.ст./(лс). К первому году жизни аэродинамическое сопротивление снижается приблизительно на 40%. Около 80% общего сопротивления приходится на первые 4-5 генераций бронхиального дерева. Ди-стальные дыхательные пути играют меньшую роль в аэродинамическом сопротивлении, чем проксимальные, так как они имеют большую площадь общего сечения.
На R главным образом влияют:
•длина и диаметр дыхательных путей (в том числе искусственных). Длинная и узкая ЭТТ способна значительно увеличить аэродинамическое сопротивление, особенно при высокой скорости газотока в контуре (появление турбулентности);
•скорость газового потока;
•плотность, вязкость, влажность газовой смеси.
Во время вдоха увеличивается диаметр интраторакальных дыхательных путей и уменьшается экстраторакальных, во время выдоха наоборот.
Вентиляция различных отделов легкого определяется константой времени (ТС - time constant), которая зависит от растяжимости и аэродинамического сопротивления этих отделов.
ТС = С × R.
Единицей константы времени является время, необходимое для того, чтобы альвеолярное давление достигло 63% давления в ротовой полости, и пациент получил пропорциональный этому дыхательный объем. За время, равное 2 ТС,
альвеолярное давление достигает 86% давления в ротовой полости, 3 ТС - 95%,
4 ТС - 98%, 5 ТС - 99%.
Пример: новорожденный с С = 0,005 л/см вод.ст., R = 30 см вод.ст./(лс), ТС = 0,005 × 30 = 0,15 с, 5 ТС = 5 × 0,15 = 0,75 с, т. е. новорожденному с данными С и R требуется 0,75 с для полного уравнивания давления во рту и аль веолах.
В практической работе можно считать, что времени, равного 3-5 ТС, достаточно для получения необходимого дыхательного объема (ДО).
Для полного завершения выдоха требуется время, равное 5 ТС.
Если время выдоха менее 5 ТС, то к началу следующего вдоха выдох будет не полностью завершен, и давление в альвеолах будет превышать давление во рту. Этот феномен получил название авто-ПДКВ, непреднамеренного положительного давления в конце выдоха (auto-PEEP; РЕЕР - positive and expiratory pressure).
Экспираторная ТС обычно больше инспираторной вследствие общего увеличения аэродинамического сопротивления дыхательных путей во время выдоха. Особенно это
•продолжительная вентиляция;
•нестабильные дыхательные пути;
•респираторная поддержка при неонатальном сепсисе или некротическом энтероколите.
Осложнения интубации трахеи:
•травма гортани, пищевода или трахеи;
•интубация правого главного бронха или пищевода (наиболее частая причина отсутствия клинического улучшения пациента после интубации);
•кардиореспираторная дестабилизация во время попыток интубации. Осложнения стояния эндотрахеальной трубки (ЭТТ):
•спонтанная экстубация;
•обструкция ЭТТ секретом, водой из контура аппарата ИВЛ, слизью, мокротой, кровью;
•вентилятор-ассоциированные нозокомиальные инфекции;
•эрозия слизистой оболочки носового хода, носовой перегородки (при на-зотрахеальной интубации);
•пролежни нёба, нарушение формирования молочных зубов (при оротра-хеальной интубации);
•постинтубационный подсвязочный стеноз. Оборудование для интубации трахеи
•Ларингоскоп с клинками соответствующего размера (00,0 для недоношенных, 1 для доношенных).
•ЭТТ соответствующего размера (Portex, размеры 2,5; 3,0 и 3,5 мм). При оротрахеальной интубации может быть использован проводник (стилет)
в стерильной упаковке, вводится в ЭТТ на 1 см меньше, чем длина ЭТТ. Для назотрахеальной интубации - щипцы Маджилла.
•Катетеры для санации, в том числе большого диаметра (10 Fr) для орофа-рингеальной санации.
•Лейкопластырь для крепления ЭТТ.
•Мешок саморасправляющийся (Laerdal, Ambu, Penlon) и лицевая маска соответствующего размера.
•Детектор выдыхаемого СО2.
•Монитор сатурации О2.
•Neopuff и источник сжатого воздуха/кислорода со смесителем.
•Вентилятор (оттестированный и с установленными параметрами). Размер и глубина постановки эндотрахеальной трубки
Большинству пациентов с массой тела <1250 г (<32 нед гестации) подойдет ЭТТ 2,5 мм ID (внутренний диаметр). Для новорожденных с массой тела 12503000 г (32-38 нед гестации) ЭТТ 3,0 мм ID; и для детей с массой тела >3000 г (>38 нед гестации) ЭТТ 3,5 мм
ID (табл. 25.1).
Для определения глубины постановки ЭТТ на практике часто используется правило шести: глубина постановки ЭТТ = 6 + масса тела ребенка (кг), при оротрахеальной интубации; и 6 + (1,5 × масса тела ребенка в кг) для назотрахе-альной интубации.
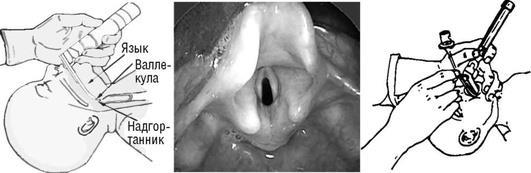
предпочтительно наклеивать лейкопластырь на гидроколлоидную полоску «искусственной кожи».
Подтверждение положения ЭТТ
Идеальным считается положение конца ЭТТ примерно посередине между голосовыми связками и бифуркацией трахеи. Подтверждают правильное положение ЭТТ:
•симметричные экскурсии грудной клетки;
•аускультативно одинаково хорошее, симметричное проведение дыхания над обеими сторонами грудной клетки, а не над желудком (менее надежный признак для недоношенных с ЭНМТ);
•положение конца ЭТТ не более чем 2,5-3,0 см за голосовыми связками;
•видимая влага, «запотевание» ЭТТ на выдохе;
•улучшение клинического состояния пациента;
•использование детектора выдыхаемого СО2;
•рентгенография грудной клетки, ЭТТ на уровне ThII-ThIII либо минимум 1-1,5 см над бифуркацией трахеи.
Вопросы в клинической практике
Оротрахеальная или назотрахеальная интубация трахеи предпочтительнее?
Оба варианта представляют одинаково безопасную и эффективную возможность
проведения ИВЛ. Выбор определяется только навыками медицинского персонала. В экстренной ситуации оротрахеальная интубация предпочтительнее из-за быстроты выполнения.
Премедикация и седатация. Интубация трахеи может вызвать дестабилизацию состояния пациента вследствие дистресса и болезненности. Несколько сообщений говорят о лучшей переносимости интубации с использованием пре-медикации разными препаратами. Не было установлено превосходства одного конкретного варианта премедикации.
•При рождении и в ситуации угрозы жизни интубация без седатации является оправданной.
•В контролируемой ситуации следует рассмотреть возможность премеди-кации, решение будет зависеть от опыта и подготовки врача. Особенно актуальна премедикация для активных, зрелых пациентов. Предпочтительный вариант - седатация с миорелаксацией: атропин 10-30 мкг/кг внутривенно, затем морфин 0,1-0,2 мг/кг
(или фентанил 2-4 мкг/кг) внутривенно за 30 с, через 3-5 мин суксаметония хлорид 1,5-3,0 мг/кг внутривенно. Для недоношенных с ЭНМТ возможно проведение премедикации без миорелаксантов.
Ларингеальная маска была разработана, чтобы вытеснить респираторную поддержку с использованием ЭТТ. Но до сих пор ларингеальная маска в нео-натологии не заслужила высокой оценки клиницистов и не вошла в стандартную практику.
25.3. КИСЛОРОДОТЕРАПИЯ
Кислородотерапия - коррекция артериальной гипоксемии с помощью увеличения концентрации кислорода во вдыхаемой газовой смеси (повышение FiO2).
Человек является аэробным организмом. Весь его клеточный метаболизм зависит от постоянной и адекватной доставки кислорода для поддержания основных функций клетки. У здорового человека в состоянии покоя, при нормальном распределении
