
6 курс / Неонатология / Детские болезни Баранов А.А. 2009
.pdf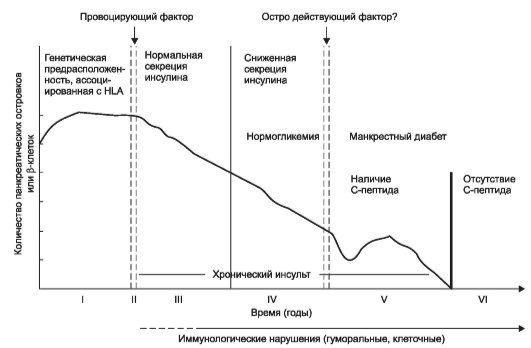
Рис. 18-7. Стадии развития инсулинзависимого сахарного диабета (Зингер Α., Стендл Ε.): I стадия - генетическая предрасположенность, реализуемая менее чем у половины генетически идентичных близнецов и у 2-5% сибсов; II стадия - гипотетический пусковой момент, который вызывает развитие III стадии; III стадия - активный аутоиммунный процесс (первоначально лица даже с иммунными нарушениями имеют нормальную секрецию инсулина); IV стадия - при выраженных иммунных нарушениях отмечают снижение секреции инсулина в ответ на введение глюкозы, при этом уровень гликемии остаѐтся нормальным; V стадия - клиническая манифестация, которая развивается после гибели 80-90% β-клеток, при этом ещѐ сохраняется остаточная инсулиновая секреция; VI стадия - полная деструкция β-клеток.
Уабсолютного большинства больных в детском возрасте развивается СД 1-го типа, который характеризуется выраженной инсулиновой недостаточностью и всегда является инсулинзависимым. Клинические признаки СД во многом зависят от возраста ребѐнка и степени декомпенсации обменных процессов в момент его обследования. Для СД 1-го типа в детском возрасте характерно острое начало с быстрым нарастанием симптоматики вплоть до возникновения кетоацидоза, а при отсутствии своевременной диагностики возможно развитие кетоацидотической комы. У большинства детей время с момента появления первых симптомов заболевания до возникновения коматозного состояния составляет от 3-4 нед до 2-3 мес.
Удетей среднего и старшего возраста заподозрить наличие СД несложно. К основным симптомам СД относят:
•полиурию (повышенное мочеиспускание);
•полидипсию (жажду);
•сухость во рту;
•полифагию (повышенный аппетит);
•снижение массы тела;
•запах ацетона изо рта.
Полиурия - первый симптом глюкозурии, возникает при гипергликемии, превышающей почечный порог для глюкозы (в среднем 9 ммоль/л). Полиурия развивается в результате осмотического диуреза, обусловленного высокой концентрацией глюкозы в моче. Моча обычно бесцветная, имеет высокий удельный вес за счѐт выделяющегося сахара. В дневное время этот симптом, особенно у детей школьного возраста, не привлекает внимания ни детей, ни взрослых. В то же время ночная полиурия и нередко сопутствующее ей недержание мочи, как правило, более заметны. Энурез характерен для тяжѐлой полиурии и часто становится первым замечаемым симптомом СД. Нередко внимание родителей привлекает появление липкой мочи. Полиурия - компенсаторный процесс, так как способствует снижению гипергликемии и гиперосмолярности крови.
Полидипсия возникает на фоне полиурии вследствие обезвоживания организма и раздражения центра жажды головного мозга из-за гиперосмолярности крови. Так же, как и полиурия, жажда бывает более заметной в ночные часы, а также утром, до завтрака. Сухость во рту заставляет ребѐнка в течение ночи несколько раз просыпаться и пить воду.
Полифагия (постоянное чувство голода) в сочетании со снижением массы тела является одним из характерных признаков СД. Они развиваются вследствие энергетического голодания клеток организма из-за нарушения утилизации глюкозы и потери еѐ с мочой, с одной стороны, и усиления процессов липолиза и протеолиза в условиях дефицита инсулина - с другой. Резкая потеря массы тела происходит также в связи с обезвоживанием организма. Родители не всегда характеризуют полифагию как патологический симптом и не фиксируют в числе жалоб, а нередко даже расценивают еѐ как положительное явление в состоянии ребѐнка. В большей степени родителей тревожит потеря массы тела ребѐнка. Сочетание полифагии с потерей массы тела обычно заставляет обратиться к врачу. Однако нередко обследование ребѐнка идѐт в неправильном направлении (чаще всего по пути исключения глистной инвазии, желудочно-кишечного заболевания, хронической инфекции и др.), и, таком образом, больной остаѐтся без медицинской помощи. В дальнейшем у ребѐнка развиваются общая и мышечная слабость, которые объясняют не только энергетическим голоданием клеток, но и нарастающими электролитными нарушениями.
Усиление липолиза в жировой ткани приводит к нарастанию в крови концентрации свободных жирных кислот, которые усиливают кетогенез из-за сниженной в условиях дефицита инсулина липосинтетической функции печени. Накопление кетоновых тел приводит к развитию диабетического кетоацидоза. У больных появляется запах ацетона изо рта, полифагия сменяется сниженным аппетитом, нарастает слабость, возникает одышка, вначале при физической нагрузке, а затем и в покое. Впоследствии к этим симптомам присоединяются анорексия, тошнота, рвота, сонливость. Это
грозные предвестники развития коматозного состояния. Нередко в дебюте СД у детей можно наблюдать псевдоабдоминальный синдром. Боли в животе, тошноту, рвоту, возникающие при быстро развивающемся кетоацидозе, расценивают как симптомы хирургической патологии. Часто таких детей в связи с подозрением на острый живот ошибочно подвергают лапаротомии.
Кожные изменения часто регистрируют в дебюте СД. Сухость кожных покровов и слизистых оболочек вследствие обезвоживания организма становятся почти постоянным симптомом заболевания. На волосистой части головы может возникнуть сухая себорея, а на ладонях и подошвах - шелушение. Слизистая оболочка ротовой полости обычно яркокрасного цвета, сухая, в углах рта - раздражение, заеды. На слизистой оболочке ротовой полости могут развиваться молочница, стоматит. Диабетический румянец, захватывающий нередко, кроме щѐк, лоб и подбородок, связан с парезом кожных капилляров при гипрегликемии и кетозе. Иногда обращает на себя внимание желтушное окрашивание кожи ладоней, подошв, носогубного треугольника (ксантоз). Оно вызвано отложением каротина в роговом слое кожи из-за нарушения его превращения в печени в витамин А. Тургор кожи, как правило,
снижен, особенно при резко выраженном обезвоживании. Чаще всего отмечают дефицит массы тела, иногда вплоть до кахексии.
Сердечно-сосудистые нарушения в дебюте заболевания наблюдают лишь при тяжѐлой декомпенсации. К ним относят тахикардию, приглушение тонов сердца, наличие функциональных шумов. При ЭКГ исследовании регистрируют изменения метаболического характера.
Гепатомегалию у детей отмечают довольно часто. Еѐ выраженность зависит от степени нарушения метаболизма. Увеличение печени при СД обычно связано с жировой инфильтрацией вследствие инсулиновой недостаточности. Назначение инсулина и компенсация углеводного обмена приводят к нормализации размеров печени.
Нарушения менструального цикла могут сопровождать дебют СД в пубертатном периоде у девочек. Возможны жалобы на зуд в области наружных половых органов и других частях тела.
Течение заболевания
Течение заболевания зависит от возраста ребѐнка. У многих детей первых 5 лет жизни течение заболевания характеризуется крайней нестабильностью, склонностью к частым гипогликемическим состояниям, лѐгкостью развития кетоза, повышенной чувствительностью к инсулину. Избежать гипогликемии у маленьких детей трудно изза неустойчивого аппетита и вариабельной физической нагрузки. Лабильное течение СД отмечают у детей как в препубертатный, так и пубертатный периоды. Оно обусловлено нестабильностью нейрогуморальной регуляции, напряжѐнностью обменных процессов в связи с интенсивным ростом и развитием. На всех стадиях пубертатного периода ярко выражена инсулинорезистентность. Следует
особо учитывать эмоциональный фактор, который влияет на течение заболевания у подростков.
Осложнения
Диабетическая ретинопатия
Диабетическая ретинопатия является классическим примером сосудистых осложнений СД. Она занимает одно из первых мест среди причин, приводящих к снижению зрения и слепоте у лиц молодого возраста. Инвалидность по причине нарушения зрения наблюдают более чем у 10% больных СД. Слепота наступает в 25 раз чаще, чем в общей популяции.
Диабетическая ретинопатия - специфическое поражение сетчатой оболочки и сосудов сетчатки, характеризующееся развитием экссудативных очагов, ретинальных и преретинальных кровоизлияний, ростом новообразованных сосудов, а также развитием тракционной отслойки сетчатки, рубеозной глаукомы.
Диабетическая нефропатия
Диабетическая нефропатия - основная причина неблагоприятного прогноза у больных СД. Известно, что треть всех больных СД 1-го типа погибают от терминальной почечной недостаточности уже через 15-20 лет после начала заболевания. Наиболее неблагоприятный исход наблюдают у лиц, заболевших в детском возрасте.
Диабетическая невропатия
Диабетическая полиневропатия характеризуется возникновением болей в конечностях, снижением порога температурной и болевой чувствительности. Характерно развитие вегетативной полиневропатии, проявляющейся дисфункцией пищевода, гастропатией, диабетической диареей, запорами.
Риск развития сосудистых осложнений зависит от степени компенсации заболевания. При хорошей компенсации возможна нормальная по продолжительности и качеству жизнь. Чем хуже компенсация, тем быстрее развиваются и тяжелее протекают диабетические осложнения, продолжительность жизни сокращается на 15-20 лет, возникает ранняя инвалидизация.
Диабетическую катаракту, гепатоз и диабетическую хайропатию (ог-
раничение подвижности суставов) также относят к типичным осложнениям СД.
При возникновении СД в раннем возрасте и плохой компенсации заболевания наблюдают задержку физического и полового развития. Крайняя степень выраженности этих симптомов (карликовость, отсутствие вторичных половых признаков у подростков и гепатомегалия) носит название синдрома Мориака (рис. 18-8 на вклейке).
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Диагноз подтверждают наличием гипергликемии, глюкозурии, у некоторых больных - кетоза или кетоацидоза. В норме содержание глюкозы в плазме крови натощак составляет 3,3-5,5 ммоль/л.
Глюкозурия служит важным диагностическим критерием СД. В норме у здорового человека глюкоза в моче отсутствует. Глюкозурия возникает тогда, когда концентрация глюкозы в плазме крови превышает 8,88 ммоль/л. Диагноз СД при обнаружении глюкозурии можно считать достоверным только после определения гипергликемии.
Кетонурия или ацетонурия. Наличие кетоновых тел (производных метаболизма липидов) в моче свидетельствует о тяжѐлой декомпенсации СД, связанной с недостатком инсулина. Однако у детей кетонурию можно отмечать при инфекционных заболеваниях, протекающих с высокой температурой тела, при голодании, особенно у детей раннего возраста.
Определение содержания гликозилированного Hb (HbA1c) считают одним из современных методов диагностики нарушения углеводного
обмена. Кроме того, этот метод также используют для оценки степени компенсации углеводного обмена у больных СД, находящихся на лечении.
Содержание HbA1c зависит от концентрации глюкозы в плазме крови и служит интегральным показателем состояния углеводного обмена в течение последних 3 месяцев, учитывая, что «жизнь» эритроцита составляет 120 дней. Содержание HbA1c составляет 4-6% общего Hb в крови у здоровых лиц. Высокий уровень гликемии при СД способствует повышению процессов неферментативного гликозилирования белков Hb, поэтому у больных СД его содержание в 2-3 раза превышает норму. Для диагностики СД у детей этот показатель имеет большое значение.
Аутоантитела к Аг β-клеток (ICA, GADA, IAA, IAA) служат иммунологическими маркѐрами инсулита, протекающего в поджелудочной железе. Их определение используют для ранней доклинической диагностики СД 1-го типа в группах высокого генетического риска либо для проведения дифференциальной диагностики между СД 1 и 2-го типов. При наличии у ребѐнка классических симптомов СД определять аутоантитела к Аг β-клеток нет необходимости.
Определение содержания С-пептида в сыворотке крови даѐт возможность оценить функциональное состояние β-клеток у лиц с высоким риском развития СД и, кроме того, помогает в дифференциальной диагностике СД 1 и 2-го типов. Базальная концентрация С-пептида у здоровых лиц составляет 0,28-1,32 пг/мл. При СД 1-го типа его содержание снижено или не определяется. После стимуляции глюкозой, глюкагоном или сустакалом (питательной смесью с высоким содержанием кукурузного крахмала и сахарозы) концентрация С-пептида у больных СД 1-го типа не повышается, а у здоровых лиц - значительно возрастает. При наличии классических симптомов СД 1-го типа в дебюте заболевания у детей определение содержания С-пептида в сыворотке крови не имеет практической значимости.
ДИАГНОСТИКА И ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Диагностику СД производят на основании классических симптомов заболевания. Дифференциальную диагностику проводят с почечным диабетом (глюкозурия без повышения концентрации глюкозы в плазме крови), несахарным диабетом (полиурия с низким удельным весом мочи и жажда при отсутствии глюкозурии и гипергликемии) и синдромом ацетонемической рвоты (кетонурия, ацидоз, запах ацетона изо рта при отсутствии гипергликемии).
До настоящего времени проблема дифференциальной диагностики СД в период его дебюта остаѐтся актуальной. У 88% детей СД диагностируют в состоянии кетоацидоза.
ЛЕЧЕНИЕ
СД 1-го типа - заболевание, в основе которого лежит абсолютная инсулиновая недостаточность, обусловленная аутоиммунным разрушением инсулинпродуцирующих клеток поджелудочной железы, поэтому введение инсулина считают единственным на сегодняшний день патогенетическим методом его лечения. Кроме этого, к важным моментам терапии СД 1-го типа относят соблюдение диеты, правильный образ жизни, достаточную физическую нагрузку и самоконтроль.
Цели лечения детей и подростков с СД 1-го типа:
•достижение максимально близкого к нормальному состоянию уровня углеводного обмена;
•нормальное физическое и соматическое развитие ребѐнка;
•нормальные психосоциальное состояние и адаптация ребѐнка;
•развитие самостоятельности и мотивации к самоконтролю;
•профилактика специфических осложнений СД. Критерии компенсации СД:
•отсутствие жажды, полиурии, потери массы тела;
•гликемия натощак 4-7,6 ммоль/л;
•отсутствие глюкозурии;
•постпрандиальная гликемия менее 11 ммоль/л;
•концентрация глюкозы ночью не менее 3,6 ммоль/л;
•отсутствие тяжѐлых гипогликемий (допускают наличие отдельных лѐгких гипогликемий);
•содержание HbA1c менее 7,6%.
Больным СД необходимо ограничить потребление углеводов и жиров, при этом необходимо учитывать индивидуальные физиологические потребности в пищевых веществах и энергии. Рекомендуют соотношение белков, жиров и углеводов 1:0,8:3-3,5.
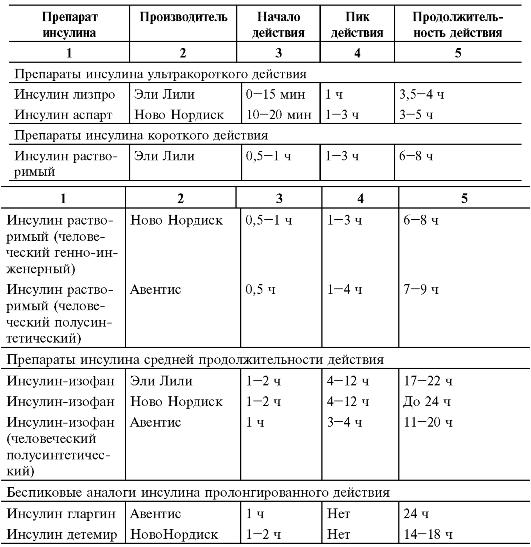
В настоящее время в России детям назначают только человеческие генноинженерные препараты инсулина и их аналоги. Фармакокинетические характеристики этих препаратов представлены в табл. 18-7.
Таблица 18-7. Фармакокинетическая характеристика различных препаратов инсулина
Кроме того, в настоящее время выпускают смешанные препараты инсулина, в состав которых входит инсулин средней продолжительности и короткого действия в различных соотношениях - от 90:10 до 50:50. Эти препараты более удобны, поскольку их применение позволяет уменьшить количество инъекций, проводимых с помощью шприц-ручек.
Сразу после установления диагноза СД у детей необходимо начинать инсулинотерапию. Начинают инсулинотерапию с дробного введения препарата инсулина короткого действия 4-6 раз в сутки. Дозу подбирают индивидуально в зависимости от возраста ребѐнка и степени гипергликемии.
В среднем доза составляет 0,5-0,8 ЕД/кг/сут, и в дальнейшем еѐ необходимо корректировать в зависимости от содержания глюкозы в плазме крови. Повторное исследование концентрации глюкозы в плазме крови проводят каждые 3-6 ч.
Наибольшее распространение в настоящее время получила интенсифицированная (или базис-болюсная) схема инсулинотерапии. Она заключается в том, что перед каждым основным приѐмом пищи вводят препарат инсулина короткого действия, а препарат инсулина пролонгированного действия - 1-2 раза в сутки, чаще всего в вечерние и утренние часы. При этом с помощью препарата инсулина пролонгированного действия пытаются имитировать базальную секрецию, а
при использовании препарата инсулина короткого действия - посталиментарную секрецию.
В настоящее время «золотым стандартом» инсулинотерапии считают использование инсулиновой помпы. Инсулиновая помпа - современная технология, позволяющая эффективно компенсировать углеводный обмен. Помпа способна в непрерывном режиме вводить инсулин, имитируя базальную секрецию гормона β-клетками, а после еды - вводить инсулин в болюсном режиме, имитируя посталиментарную секрецию.
Осложнения инсулинотерапии
Гипогликемия - состояние, обусловленное низким содержанием глюкозы в плазме крови и являющееся одним из наиболее частых осложнений инсулинотерапии. По данным различных авторов, среди больных СД ярко выраженные и бессимптомные гипогликемии наблюдают в 25-58% случаев, а в 3-4% случаев причиной смерти больных СД становится гипогликемическая кома.
К симптомам гипогликемии относят снижение интеллектуальной деятельности, неуверенность в себе, вялость, заторможенность, плохую координацию движений, головную боль, чувство голода, слабость, повышенную потливость, сонливость, парастезии, головокружение, диплопию, «мушки» в глазах, раздражительность, ночные кошмары, неадекватное поведение, загруженность, гемиплегии, парезы, нарушение сознания и как крайнее проявление кому.
Самоконтроль
Накопленный клинический опыт показывает, что ни применение лучших препаратов инсулина, ни максимально подобранные доза и схема введения инсулина не могут решить проблему компенсации СД в детском и подростковом возрасте без проведения самоконтроля заболевания в домашних условиях.
Самоконтроль при СД считают одним из важнейших компонентов лечения. Для грамотного контроля СД больные должны хорошо понимать все аспекты своего заболевания. Проведение самоконтроля означает не только умение
определять содержание глюкозы в плазме крови, но и правильно корректировать дозу инсулина в зависимости от уровня гликемии, изменений в питании, физических нагрузок и условий разнообразного спектра жизненных ситуаций. Для этого проводят обучение больных и их родителей в специально создаваемых школах самоконтроля.
НЕОТЛОЖНЫЕ СОСТОЯНИЯ
К острым неотложным состояниям при СД относят диабетический кетоацидоз и кетоацидотическую кому, а также гипогликемию и гипогликемическую кому. Гиперосмолярную некетоацидотическую кому и лактатацидоз в детском возрасте наблюдают крайне редко, хотя
состояние гиперосмолярности имеет большое значение в развитии кетоацидотической комы.
Диабетический кетоацидоз и кетоацидотическая кома
Диабетический кетоацидоз - тяжѐлая метаболическая декомпенсация СД. При манифестации СД диабетический кетоацидоз развивается в 80% случаев, когда по тем или иным причинам задерживают диагностику заболевания, либо при уже установленном диагнозе откладывают назначение инсулина. Особенно быстро диабетический кетоацидоз развивается у маленьких детей.
У больных, уже получающих инсулинотерапию, причиной диабетического кетоацидоза и комы могут быть:
•неправильное лечение (назначение недостаточных доз инсулина);
•нарушение режима инсулинотерапии (пропуск инъекций, использо-
вание просроченных препаратов инсулина);
•грубые нарушения в питании (у девочек пубертатного возраста иногда сознательно с целью снижения массы тела);
•резкое возрастание потребности в инсулине, которое может возник-
нуть вследствие инфекционных заболеваний, стресса, хирургических вмешательств и др.
Тяжесть состояния при диабетическом кетоацидозе обусловлена резкой дегидратацией организма, декомпенсированным метаболическим ацидозом, выраженным дефицитом электролитов, гипоксией, в большинстве случаев гиперосмолярностью и нередко сопутствующими интеркуррентными заболеваниями.
К развитию комы при диабетическом кетоацидозе приводят следующие биохимические нарушения и патофизиологические процессы:
• резкое обезвоживание клеток головного мозга;
•гиперосмолярность вследствие гипергликемии;
•ацидоз;
•повышенное содержание азотистых шлаков вследствие распада бел-
ков и нарушения выделительной функции почек;
• тяжѐлая гипоксия мозга из-за снижения мозгового кровотока, по-
вышения концентрации HbA1c, снижения содержания 2,3-дифосфо- глицерата в эритроцитах;
•недостаточность механизмов внутриклеточного энергетического обеспечения;
•гипокалиемия;
•ДВС;
•общая интоксикация.
Лечение диабетического кетоацидоза включает 6 важнейших направлений.
•Введение жидкости для регидратации.
•Введение инсулина для прекращения катаболических процессов (кетоацидоза) и снижения гипергликемии.
•Коррекция электролитных нарушений.
•Купирование ацидоза с помощью бикарбонатов.
•Общие мероприятия.
•Лечение состояний, вызвавших диабетический кетоацидоз.
Отѐк головного мозга - наиболее частая причина смертельных исходов. Причина развития отѐка головного мозга во время лечения до конца не ясна, однако слишком быстрое снижение внутрисосудистой осмолярности может усиливать этот процесс. В связи с этим регидратацию у детей с диабетическим кетоацидозом необходимо проводить более медленно и осторожно, чем в других случаях дегидратации.
Объѐм вводимых растворов зависит от возраста ребѐнка и составляет:
•в возрасте до 1 года - 1000 мл;
•1-5 лет - 1500 мл;
•5-10 лет - 2000 мл;
