
2 курс / Микробиология 1 кафедра / Доп. материалы / Культуральные_методы_диагностики_туберкулеза
.pdf
Постоянно контролируйте температуру в свертывателе. Не допускайте перегрева сред в свертывателе.
Строго соблюдайте асептику, например, обжигайте пробирки и колбы.
При приготовлении яичной массы тщательно обрабатывайте поверхность яиц перед их разбиванием.
Не подвергайте приготовленную среду воздействию УФ-лучей. Храните готовые среды в темноте, в холодильнике.
Проводите контроль качества каждой партии сред.
Не экономьте при разливе среды по пробиркам, рекомендуется разливать в пробирки по 5 мл среды.
Для приготовления плотных яичных питательных сред используют солевую основу, различающуюся по составу для различных сред, яичную массу и раствор антисептика малахитового зеленого, предотвращающего рост на среде немикобактериальной флоры.
Ниже приводятся прописи и рекомендации по приготовлению наиболее распространенных плотных яичных сред – Левенштейна–Йенсена и Финна-II, а также жидкой среды Школьниковой.
Рецепты приготовления некоторых других питательных сред представлены в При-
ложении 2.
Среда Левенштейна–Йенсена
Реактивы
Калий однозамещенный фосфорнокислый KH2PO4 – ТУ-6-09-5324-87.
Магний лимоннокислый Mg3(C6H5O7)2 × 14H2O – ТУ-6-09-1770-77.
Магний сернокислый MgSO4 × 7H2O – ГОСТ 4523-77.
L-аспарагин C4H8N2O3 × H2O – импортный реактив.
Глицерин C3H8O3 – ГОСТ 6259-75.
Малахитовый зеленый C52H54O12N4 – ТУ-6-09-1557-77.
Вода дистиллированная – ГОСТ 6709-77.
Состав среды
1) Раствор минеральных солей: |
|
|
|
Калий однозамещенный фосфорнокислый |
2,4 г |
|
Магний лимоннокислый |
0,6 г |
|
Магний сернокислый |
0,24 г |
|
L-аспарагин |
3,6 г |
|
Глицерин |
12,0 мл |
|
Вода дистиллированная |
600 мл |
Вышеперечисленные ингредиенты растворяют в теплой дистиллированной воде в указанной последовательности при слабом подогревании (не доводя до кипения) на водяной бане. L-аспарагин рекомендуется растворять отдельно и вносить последним. Затем солевой раствор стерилизуют в автоклаве при 1 атм. (121 °С) в течение 30 минут. Срок хранения раствора составляет 3–4 недели при комнатной температуре.
Примечание. Для культивирования M. bovis среду Левенштейна–Йенсена обогащают 0,5% пируватом натрия, исключив из солевого раствора глицерин. С этой целью в состав солевого раствора вместо глицерина добавляют 8,0 г пирувата натрия.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
91 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

2) Раствор малахитового зеленого: |
|
|
|
Малахитовый зеленый |
2 г |
|
Стерильная дистиллированная вода |
100 мл |
Приготовление раствора требует большой аккуратности, в связи с тем что поро-
шок малахитового зеленого очень летуч! Взвешенный порошок малахитового зеленого растворить в стерильной теплой дистиллированной воде и поместить раствор в термостат на 1–2,5 часа для большего растворения (рекомендуется частое помешивание, поскольку порошок растворяется очень плохо). Затем профильтровать раствор через бумажный фильтр, разлить по флаконам или небольшим колбам и стерилизовать при 1 атм. (121 °С) в течение 30 минут. Приготовленный раствор не подлежит длительному хранению и при появлении осадка или изменении окраски его следует заменить свежим раствором.
3) Яичная масса.
Свежие диетические куриные яйца без трещин и дефектов скорлупы тщательно отмывают в теплой проточной воде с помощью ручных щеток и щелочного мыла. Далее яйца тщательно промывают в проточной воде и погружают в 70% этиловый спирт на 30 минут.
Перед тем как начать работу с чистыми и сухими яйцами, рекомендуется тщательно вымыть руки с мылом и щеткой. Затем в стерильном боксе разбивают яйца стерильным ножом в стерильную посуду, доводя общий объем яичной массы до 1 л (для этого требуется в среднем 20–25 яиц в зависимости от их величины).
Внимание! Необходимое количество яичной массы определяется по объему, а не по количеству яиц!
Тщательно взбивают яичную массу стерильным венчиком или в стерильном мик-
сере (рис. 26) при минимальной скорости. Необходимо минимизировать образование пены!



 Рис. 26 Миксер для приготовления питательных сред
Рис. 26 Миксер для приготовления питательных сред
92 Культуральные методы диагностики туберкулеза

Приготовление среды
В большую стерильную емкость, соблюдая правила стерильности, помещают сле-
дующие растворы: |
|
|
|
раствор минеральных солей |
600 мл; |
|
гомогенизированная яичная масса |
1000 мл. |
Смесь тщательно перемешивают и фильтруют через стерильный марлевый фильтр, имеющий не менее 4 слоев марли. Добавляют 20 мл раствора малахитового зеленого, тщательно перемешивают, избегая образования пены, и в течение не более 15 минут разливают в пробирки приблизительно по 5 мл, следя за тем, чтобы в рас-
творе не сформировался осадок. Не допускайте попадания пены в пробирки!
Свертывание среды
Для свертывания среды используются специальные аппараты-свертыватели «АСПС». Пробирки с разлитой в них средой помещают в специальные штативы с подобранным углом наклона для формирования косяка среды высотой 8–10 см. Штативы устанавливают в свертыватель и проводят коагуляцию при 82–83 °С в течение 40 минут.
Внимание! Свертывание является не стерилизующей, а лишь коагулирующей процедурой. Стерильность среды обеспечивается стерильными условиями ее при готовления и разлива!
Так как приготовление и розлив питательной среды проводится в условиях соблюдения стерильности, качество приготовленной яичной среды зависит от соблюдения температурного и временного режимов коагуляции. Обесцвечивание среды, наличие пузырьков или углублений на ее поверхности свидетельствует о нарушении режима свертывания. Повторное свертывание ухудшает качество среды. Среды с нарушенным режимом свертывания подлежат удалению.
Хранение среды
Приготовленная партия среды должна иметь этикетку с датой изготовления и сохраняться в холодильнике при 4°С с тщательно закрытыми пробками для предотвращения высыхания. Срок хранения среды не должен превышать 4 недели.
Среда Финна-II
Реактивы
Магний сернокислый MgSO4 × 7H2O – ГОСТ 4523-77.
Натрий лимоннокислый C6H5O7Na3 × 5,5H2O – ГОСТ 22280-86.
Квасцы железоаммонийные Fe(NH4)•(SO4)2 × 12H2O – ГОСТ 4205-77.
Калий однозамещенный фосфорнокислый KH2PO4 – ТУ 6-09-5324-87.
Аммоний лимоннокислый однозамещенный C8H11O7N – ГОСТ 7234-79.
Натрий глутаминовокислый однозамещенный C5H8NNaO4 × H2O –
ТУ 6-09-337-70.
Глицерин C3H8O3 – ГОСТ 6259-75.
Малахитовый зеленый C52H54O12N4 – ТУ 6-09-1557-77.
Вода дистиллированная – ГОСТ 6709-77.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
93 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

Состав среды
1) Раствор минеральных солей: |
|
|
|
|
Магний сернокислый |
0,5 г |
|
|
Натрий лимоннокислый |
1,0 г |
|
|
Квасцы железоаммонийные |
0,05 г |
|
|
Калий однозамещенный фосфорнокислый |
20 |
г |
|
Аммоний лимоннокислый однозамещенный |
5 г |
|
|
Натрий глутаминовокислый однозамещенный |
10 |
г |
|
Глицерин |
20 |
мл |
|
Вода дистиллированная |
до 1000 мл |
|
Вышеперечисленные ингредиенты растворяют в дистиллированной воде в указанной последовательности при слабом подогревании (не доводя до кипения) на водяной бане. Кислотность не корригируют. Стерилизуют в автоклаве при 1 атм. (121°С) в течение 30 минут. Срок хранения раствора составляет 3–4 недели при комнатной температуре.
2)Раствор малахитового зеленого.
3)Яичная масса.
См. аналогичные разделы в описании среды Левенштейна–Йенсена.
Приготовление среды. Свертывание среды. Хранение среды.
См. аналогичные разделы в описании среды Левенштейна–Йенсена.
Среда Школьниковой
Реактивы
Калий однозамещенный фосфорнокислый KH2PO4 – ТУ 6-09-5324-87.
Натрий двузамещенный фосфорнокислый Na2HPO4 – ГОСТ 4172-76.
Магний сернокислый MgSO4 × 7H2O – ГОСТ 4523-77.
Натрий лимоннокислый C6H5O7Na3 × 5,5H2O – ГОСТ 22280-86.
Лимоннокислое аммиачное железо FeNH4C6H5О7 – ТУ 6-09-1114-76.
L-аспарагин C4H8N2O3 × H2O– импортный реактив.
Глицерин C3H8O3 – ГОСТ 6259-75.
Вода дистиллированная – ГОСТ 6709-77.
Состав среды
|
Калий однозамещенный фосфорнокислый |
1,5 г |
|
Натрий двузамещенный фосфорнокислый |
2,5 г |
|
Магний сернокислый |
0,5 г |
|
Натрий лимоннокислый |
1,5 г |
|
Лимоннокислое аммиачное железо |
0,05 г |
|
L-аспарагин |
1,0 г |
|
Глицерин |
30 мл |
|
Вода дистиллированная |
до 1000 мл |
Приготовление среды
Вышеперечисленные ингредиенты растворяют в небольшом количестве теплой дистиллированной воды в указанной последовательности при слабом подогревании
94 Культуральные методы диагностики туберкулеза

на водяной бане. Каждый ингредиент добавляется после полного растворения предыдущего. Оставшаяся часть дистиллированной воды добавляется после абсолютного растворения всех солей. Среду фильтруют через бумажный фильтр и разливают в колбы. Кислотность среды обычно не корригируют, так как она содержит буферную смесь солей с рН = 7,0–7,2. В случае необходимости подводят рН до значения 7,0 40% едким натром.
Стерилизуют среду в автоклаве при 1 атмосфере (121 °С) в течение 30 минут. Срок хранения среды составляет 2–3 месяца при комнатной температуре.
Перед посевом диагностического материала в среду стерильно вводят стерильную инактивированную при 70 °C сыворотку крупного рогатого скота или стерильную лошадиную сыворотку в количестве 10% от общего объема раствора.
2.5.3. Внутрилабораторный контроль качества приготовленных яичных сред
Свежеприготовленная яичная среда после ее коагуляции должна быть подвергнута визуальной оценке. Правильно приготовленная среда должна быть плотной и прочно прилипшей к стенкам пробирки. Содержание конденсата в пробирке со средой не должно превышать 0,2 мл. Обесцвечивание среды или появление углублений или пузырей внутри среды и на ее поверхности могут свидетельствовать об избыточной температуре коагуляции. Партия среды с выявленными недостатками не может использоваться для посева и должна быть уничтожена.
Одной из обязательных процедур внутрилабораторного контроля качества является проверка приготовленной среды на стерильность и на ростовые свойства.
Тест на стерильность
После свертывания каждая вновь приготовленная партия среды первоначально подвергается контролю на стерильность. С этой целью 6 пробирок из свежеприготовленной партии среды помещают в термостат при 37°С и выдерживают в течение 3 суток, что достаточно для роста загрязняющих микроорганизмов.
Если прорастает, по крайней мере, 1 пробирка, то аналогичным образом должны быть проверены 10 дополнительных пробирок. Если хотя бы в одной из этих 10 пробирок появляется рост, аналогичным образом должны быть проверены все пробирки данной партии. Все пробирки с ростом загрязняющей микрофлоры следует удалить. Остальные неконтаминированные пробирки могут быть использованы.
Тест на проверку ростовых качеств среды
Необходимо проводить тестирование ростовых качеств каждой партии среды с помощью стандартного тест-штамма. В качестве тест-штамма рекомендуется использовать лабораторный (музейный) штамм M. tuberculosis H37Ra. Для приготовления суспензии этой культуры необходимо сделать смыв с 4-недельного косяка плотной среды с обильным/сплошным ростом, гомогенизировать суспензию с помощью встряхивания со стеклянными бусами на встряхивателе в течение 1 минуты и приготовить несколько ее разведений следующим образом.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
95 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

Разведитебактериальнуюсуспензиюпостандартумутности№5(5×108 КОЕ мл) – суспензия № 1.
Приготовьте 5 серийных 10-кратных разведений каждой культуры из суспензии № 1, чтобы получить 5×103 и 5×104 бактерий в 1 мл.
Далее засейте по 0,2 мл каждой из суспензий (5×103 и 5×104) на две пробирки новоприготовленной партии среды.Распределите инокулят по поверхности пробирок. Дальнейшую инкубацию производите в обычном порядке. Регистрируйте еженедельно рост и относительный размер колоний в пробирках, сравнивая рост на новоприготовленной партии среды с результатами роста, полученными на предшествующей партии среды и зафиксированными в журнале приготовления сред (срок появления роста, количество и размер колоний).
Засев разведений 5×103 и 5×104 должен дать рост 1–10 и 10–100 колоний соответственно. При таком росте на контролируемых средах они считаются удовлетворительными.
Контроль ростовых свойств среды можно проводить одновременно с посевом диа-
гностического материала. В случае неудовлетворительного качества среды отрицательные результаты посева, полученные на ней, считаются недостоверными. Остатки незасеянной среды должны быть уничтожены.
Регистрация результатов контроля качества среды
Результаты контроля качества сред фиксируются в журнале приготовления сред. В журнале приготовления сред должны быть указаны: дата приготовления среды; объем приготовленной среды или количество разлитых пробирок; Ф. И. О. лаборанта, приготовившего среду; результаты теста на стерильность и на ростовые качества (время появления роста для обоих штаммов, количество колоний в различных разведениях, их размер и морфология); дата проведения контроля; Ф. И. О. лаборанта, проводившего контроль качества среды; заключение о годности среды. Новая среда пригодна к употреблению, если рост на ней эквивалентен или лучше, чем на предыдущей среде. Не используйте партию среды, если рост на ней хуже, чем на предыдущей партии.
Вопросы
1.Перечислите основные питательные среды, широко используемые в специализированных бактериологических лабораториях России для культивирования микобактерий.
2.Какие правила требуется соблюдать при приготовлении питательных сред?
3.Как контролируется качество свежеприготовленных сред в вашей лаборатории? Какие изменения в процедуру внутрилабораторного контроля посева вы введете?
2.5.4. Техника посева и инкубации
Микроскопическое и культуральное исследования должны производиться параллельно только из одной и той же пробы диагностического материала.
96 Культуральные методы диагностики туберкулеза

Процедура посева
Рабочее место микробиолога организуется таким образом, чтобы оно было удобно для оператора и позволяло максимально исключить операторские ошибки (рис. 27).
Перед процедурой посева необходимо подготовить пробирки с питательными средами, пронумеровать их, согласно регистрационным номерам анализов, и последовательно расположить в вертикальном штативе (рис. 28). Аналогичным образом подготовить и пронумеровать предметные стекла.
Рабочее место для проведения процедуры посева Рис. 27 



Маркировка пробирок Рис. 28 



Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
97 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

Осадок, полученный после предварительной обработки диагностического материала одним из вышеуказанных методов, следует подвергнуть параллельному культуральному и микроскопическому исследованиям в следующем порядке.
Перед началом забора посевного материала в пипетку следует убедиться в том, что номер пробирки с посевным материалом соответствует номерам пробирок с питательной средой и номеру предметного стекла для приготовления мазка.
набрать стерильной мерной (предпочтительно одноразовой пластиковой) или пастеровской пипеткой 1,0–1,2 мл подготовленного осадка, оставив приблизительно 0,1–0,2 мл для последующего приготовления мазка для микроскопии.
соблюдая условия стерильности, внести равные объемы набранного материала (примерно по 0,5–0,6 мл) в 2 пробирки с разными плотными питательными средами.
пробирки с питательной средой при посеве должны находиться в наклонном положении (под углом 40–45°).
посевной материал нанести на верхнюю треть косяка питательной среды.
засеянные пробирки закрыть ватно-марлевыми пробками и поместить в вертикальном положении в штатив таким образом, чтобы посевной материал равномерно распределился по всей поверхности косяка питательной среды; можно использовать дренированные (с продетым льняным или хлопчатобумажным шнуром) силиконовые пробки соответствующего диаметра.
остаток осадка забрать той же пипеткой и нанести на заранее подготовленное и пронумерованное предметное стекло 2–3 капли осадка для получения мазка для
микроскопического исследования, распределив материал равномерным слоем в центре стекла на площади примерно 1×2 см.
использованную для посева и приготовления мазка пипетку опустить в емкость с дезинфицирующим раствором.
позавершениипосевавсехпробзасеянныепробиркипереместитьвгоризонтальные штативы и поместить в термостат при температуре 37 °С; при этом поверхность косяка питательной среды должна находиться в горизонтальной плоскости, а наклон штатива должен исключить смачивание пробки материалом засева.
Инкубация
Инкубация микобактерий туберкулеза требует длительного срока для получения видимого роста колоний. Длительный срок инкубации диктует необходимость соблюдения ряда правил для сохранения жизнеспособности клеток и ростовых свойств питательной среды.
Температура инкубации – 37 °С.
При первичном посеве микроскопически отрицательного материала средняя продолжительность роста микобактерий на плотных питательных средах может составить 20–46 дней. Рост отдельных штаммов появляется через 60 и даже более дней. Это обуславливает необходимость при отсутствии роста микобактерий для выдачи отрицательного результата выдерживать посевы в термостате до 10 недель.
В процессе инкубации посевов необходимо соблюдать следующее:
по истечении первых 2–3 суток инкубации ватно-марлевые или дренированные силиконовые пробки заменяют герметичными пробками (силиконовыми или резиновыми);
98 Культуральные методы диагностики туберкулеза
пробирки переводят в вертикальное положение;
инкубацию проводят в течение 10 недель при обязательном еженедельном просмотре засеянных пробирок;
для облегчения процедуры еженедельного просмотра и учета посевы, выполненные в течение одного дня, желательно размещать в отдельных ящиках или штативах в порядке номеров регистрации; каждый штатив или ящик следует сопровождать этикеткой, на которой указывать дату посева, первый и последний регистрационный номер партии.
2.5.5. Оценка и учет результатов посева диагностического материала
Оценка результатов посева
При оценке результатов культурального исследования диагностического материала необходимо соблюдать следующие правила.
1.Наблюдение за посевами и просмотр засеянных пробирок следует проводить еженедельно.
2.При отсутствии роста посевы должны выдерживаться в термостате в течение 10 недель. Отрицательный результат культурального исследования может быть выдан только по истечении этого срока инкубации.
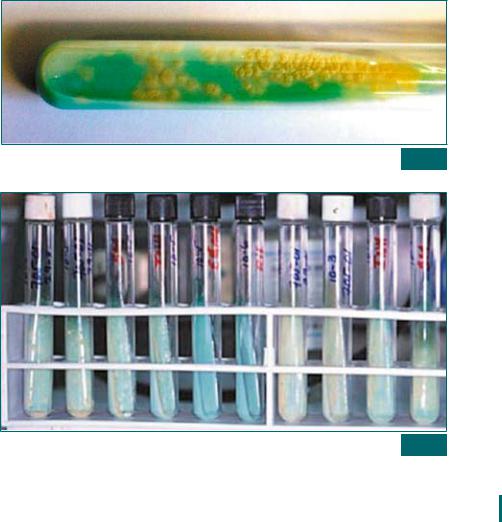
3.Во время очередного просмотра следует отбирать все пробирки, в которых имеется рост колоний (рис. 29), расставляя их по порядку номеров регистрации материала (рис. 30).
Рост культуры в пробирке (на яичной питательной среде) Рис. 29 



Пробирки с выросшими культурами Рис. 30 



Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
99 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

4.При оценке результатов регистрировать следующие параметры:
«появление роста» – дату появления роста в пробирках (в том случае, если рост появляется одновременно в обеих пробирках). Если культура выросла только в одной из пробирок (при этом имеется хороший рост культуры в соответствующие сроки), а во второй рост отсутствует, рекомендуется зарегистрировать дату появления роста и показатель роста в пробирке с выросшей культурой и использовать ее для дальнейшей работы, не дожидаясь появления роста колоний в другой пробирке. Вторую пробирку оставляют в термостате для дальнейшей инкубации и при наличии в ней роста в дальнейшем регистрируют полученные результаты;
«интенсивность роста» – число колоний, выросших в каждой из пробирок. При наличии одновременного роста во всех пробирках рекомендуется оценить суммарное число колониеобразующих единиц (КОЕ) во всех пробирках, засеянных данным материалом. Этот показатель имеет важное диагностическое и прогностическое значение, особенно если посевы производятся в динамике наблюдения за больным в процессе химиотерапии;
«загрязнение посева» посторонней микрофлорой или грибами («пророст»), при наличии такового;
«отсутствие роста» (указанный параметр регистрируется через 10 недель культивирования).
Соблюдение указанных правил позволяет, во-первых, своевременно выявлять макроскопически видимый рост микобактерий или загрязняющей микрофлоры, а во-вторых, на основании регистрации сроков появления роста и его особенностей осуществлять первичную идентификацию микобактерий.
При этом необходимо иметь в виду следующие показатели:
появление роста кислотоустойчивых микобактерий в течение 7–10 дней куль тивирования на плотных питательных средах может свидетельствовать о выде-
лении быстрорастущих нетуберкулезных микобактерий, которые не отно сятся к комплексу M. tuberculosis, поэтому перед выдачей ответа такие куль туры должны подвергнуться первичной идентификации;
появление роста кислотоустойчивых микобактерий после 3–4 недель культиви рования свидетельствует о выделении M. tuberculosis, а также других медлен норастущих микобактерий, которые могут относиться к потенциально патогенным нетуберкулезным микобактериям или к безвредным кислотоустойчивым сапрофитам;
прежде чем дать отрицательный ответ после 10 недель культивирования,
необходимо убедиться в отсутствии роста очень медленно растущих микобактерий, в числе которых могут быть и M. tuberculosis.
При оценке результатов необходимо помнить, что используемые для посева питательные среды представляют собой обогащенный субстрат, который легко утилизируется другими микроорганизмами. Это обуславливает высокий риск загрязнения посевов различными бактериями и грибами, колонии которых визуально трудно отличить от микобактерий.
Во время еженедельных просмотров посевов при подозрении на загрязнение посева гноеродной или гнилостной микрофлорой необходимо прежде всего удалить и дезинфицировать те пробирки, в которых отмечается загрязнение всей поверхности питательной среды или изменение самой питательной среды (разжижение или обесцвечивание).



 100 Культуральные методы диагностики туберкулеза
100 Культуральные методы диагностики туберкулеза
