
2 курс / Микробиология 1 кафедра / Доп. материалы / Коленчукова_О_А_Микробиоценоз_слизистой_оболочки_носа_и_риносинуситы
.pdfОчищенные токсины характеризуются высокой токсичностью для чувствительных лабораторных животных. Так, например, в 1 мг дифтерийного токсина содержится 40000000 Dim для морской свинки, в 1 мг ботулинического токсина – 1000000000 Dim для белой мыши. Кристаллические токсины обладают еще большей токсичностью.
Возбудители брюшного тифа, паратифов, дизентерии, гонореи, менингита и многие другие патогенные грамотрицательные бактерии не продуцируют экзотоксинов, они содержат эндотоксины. Эндотоксины более прочно связаны с телом бактерийной клетки, менее токсичны, поражают организм в больших дозах, скрытый период у них исчисляется обычно часами, избирательное действие выражено слабо. По химической структуре эндотоксины относятся к фосфолипидо - полисахаридо - полипептидным комплексам. Они термоустойчивы; некоторые эндотоксины выдерживают кипячение и автоклавирование при 1200 в течение 30 минут; под влиянием формалина и температуры обезвреживаются частично [162].
Токсины белковой природы вначале были получены из растений (рицин из семян клещевины, робин из коры акаций) и животных (змеиный яд).
Белковые токсины по характеру взаимоотношения с продуцирующими и клетками состоят из трех групп:
Первая – токсины, содержащиеся в питательной среде, с помощью фильтрования их отделяют от бактериальных клеток. Такие токсины называют экзотоксинами, поскольку они выделяются клетками в окружающую их питательную среду, связь их с цитоплазмой менее прочная.
Вторая – токсины, более тесно связанные с телами бактерий, их получают экстракцией слабыми кислотами ил слабыми щелочами.
Третья – токсины, которые очень прочно связаны с телами бактерий, для их экстрагирования клетки разрушают механическим воздействием, ультразвуком, повторным замораживанием и оттаиванием, перевариванием ферментами и химическими агентами.
Вторая и третья группы представляют собой эндотоксины, к которым относится большинство бактериальных токсинов [132, 159].
Большая часть белковых бактериальных токсинов катализирует определенные химические процессы, разрушает жизненно важные соединения, оказывает патогенное действие в ничтожно малых дозах, обладает скрытым периодом, подавляет защитные функции тканей. Некоторые бактериальные токсины имеют свойства лецитиназы. Так, например, Clostridium perfringens продуцирует α-токсин, обладающий свойствами экзотоксина (лецитиназу С), который способен расщеплять лецитин нa фосфорилхолин и диглицерид. В клетке образуются мембраны
51
типа лизосом, обладающих способностью синтезировать различные ферменты, в том числе и ферменты патогенности.
Некроз мышечной ткани вызывается в результате комбинированного действия лецитиназы, коллагеназы и муциназы (гиалуронидазы). Коллагеназа и муциназа разрушают соединительную ткань, входящую в состав мышц, а лецитиназа растворяет лецитин мембран мышечных волокон. Гемолиз при газовой анаэробной инфекции происходит результате лизиса лецитина стромы эритроцитов [27, 70].
Бактериальные токсины характеризуются органотропностью (монотропностью и политропностью), вследствие которой токсигенные микроорганизмы обусловливают некроз ткани в очаге локализации возбудителя. Некротизирующее проявление токсинов для возбудителя имеет большое приспособительное значение. Во-первых, токсины превращают живую и реактивную ткань в безвредный субстрат для патогенного микроба. Во-вторых, некротизированная ткань защищает паразита от воздействий на него защитных реакций микроорганизма.
Токсины рассматривают как ферментные яды, обладающие свойствами прекращать процессы обмена веществ. Эту точку зрения считают наиболее вероятной. Предполагают, что в процессе развития у сапрофитных бактерий, вступивших в длительный симбиоз с животными организмами, постепенно нарастала способность к выработке ферментов, облегчающих сожительство с тканями и повышающих их жизнедеятельность за счет хозяина. С течением времени в связи с закреплением паразитического образа жизни все более специализировались ферменты этих бактерий, в результате чего адаптивные ферменты превратились в ферментные яды – экзотоксины. Таким образом, можно считать, что токсические инфекции сформировались в более поздний период, им предшествовали простой паразитизм и заболевания септического порядка [132, 159].
Экзотоксины обладают способностью вызывать явление потенцирования, когда под влиянием смеси токсинов происходит более выраженная интоксикация организма. Особенно отчетливо проявляется потенцирующее действие токсинов клостридий газовой анаэробной инфекции, столбняка и стафилококков, коринебактерий дифтерии и стафилококков.
Некоторые белковые токсины (пневмококки, стафилококки, стрептококки и др.) вызывают гемолиз. Пневмококковый гемолизин освобождается из клеток при аутолизе. Внутривенное введение его морским свинкам вызывает их смерть. При подкожном введении в малых дозах он обусловливает выработку в организме антител; токсин инактивируется холестерином, пепсином, папаином, трипсином. Гемолитическую активность пневмококкового токсина определяют по степени гемолиза 1% взвеси эритроцитов. По физическим и химическим
52
свойствам очищенный высокоактивный гемолизин относят к белковым токсинам. Механизм его действия на эритроциты не ясен. Одни исследователи рассматривают его как фермент, а эритроциты как субстрат, другие – отрицают ферментную природу гемолизина. Сходными свойствами с пневмококковым обладает стрептококковый гемолизин [67, 85].
По характеру действия на эритроциты различают альфа- и бетагемолизины. Микробы, продуцирующие альфа-гемолизин на кровяном агаре, вызывают образование зеленых или темно-зеленых колоний в результате изменения соединений железа эритроцитов. Бета-гемолизины растворяют эритроциты и при выращивании бактерий, продуцирующих бета-гемолизины, вокруг колоний образуются прозрачные зоны гемолиза.
Кроме того, некоторые патогенные микробы продуцируют гаммагемолизин, вызывающий гемолиз эритроцитов кролика, человека, морской свинки и характеризуются малой устойчивостью к нагреванию. Обнаружен также дельта-гемолизин, который разрушает эритроциты человека и некоторых животных. Он выделяется, например, некоторыми патогенными штаммами стафилококков.
Стафилококки, стрептококки вырабатывают лейкоцидины, разрушающие полиморфноядерные лейкоциты [101, 133].
Патогенные штаммы стафилококка образуют коагулазу, вызывающую свертывание плазмы крови человека, лошади, кролика. Коагулаза не свертывает плазму крови морской свинки, крысы, курицы.
Бактерии пневмонии, озены, риносклеромы, протей, континентальные штаммы возбудителя чумы и др. продуцируют фермент уреазу, обладающую токсическим действием. Токсичными свойствами наделены многие аминокислотные декарбоксилазы, образуемые возбудителями газовой анаэробной инфекции и другими микробами.
Типичными ферментами-токсинами являются лецитиназы, подразделяющиеся на А, В, С. Лецитиназа А встречается в змеином, пчелином и скорпионовом ядах, лецитиназа В – в растениях, лецитиназа С
– у многих патогенных микробов, особенно у некоторых возбудителей газовой анаэробной инфекции [132].
Некоторые микробы образуют токсические вещества: метиламин, диметил-амин, гистамин, холин, нейрин и др. Ядовитые амины являются продуктами разложения бактериального белка, они могут накапливаться в испорченных продуктах и служить источником пищевых отравлений.
Ряд микроорганизмов продуцирует аммиак и вызывает аммиачную интоксикацию (Clostridium histolyticum и др.). Аммиак образуется в результате дезаминирования аминокислот.
Токсины обусловливают извращение обмена веществ, изменяют содержание адреналина и аскорбиновой кислоты. Под влиянием токсинов
53
происходит глубокое угнетение такого важного звена обмена веществ, каким является окислительный цикл трикарбоновых кислот.
Проявления интоксикации (местные и общие) сопровождаются морфологическими изменениями форменных элементов крови, состава белков, ферментов, серологическими (образование антител), общеклиническими (температура, нервно-психические) нарушениями. Анатомические изменения характеризуются воспалительными процессами в лимфатических узлах или поражениями определенных органов и тканей (органов дыхания, сердечно-сосудистой системы и др.) [73, 101].
Роль капсульного вещества в вирулентности микроорганизмов.
Многие бактерии выработали механизмы защиты от опсонизации и последующего фагоцитоза нейтрофилами, эти механизмы защиты сопряжены с бактериальной капсулой. Капсула защищает бактерии от нейтрофилов, препятствуя опсонизации. Например, бактерии вызывающие пневмонию и менингит (Haemophilus influenzae, Neisseria meningitides, Escherichia coli, Streptococcus pneumoniae, Klebsiella pneumoniae) имеют на своей поверхности полисахаридную капсулу. Штаммы этих же бактерий, лишенные капсулы, обладают меньшей вирулентностью. Капсула слабоиммуногенна и маскирует структуры бактериальной стенки, которые обладают большей иммуногенностью и могут непосредственно активировать систему комплемента. Компонентами клеточной стенки бактерий, снижающими эффективность фагоцитоза или препятствующих ему, являются: пептидогликаны, белок А (Staphylococcus aureus), и М- белок (стрептококк группы А). Многие микроорганизмы препятствуют опсонизации, меняя антигенную структуру своих поверхностных образований. Например, белки, экспрессированные на поверхности Neisseria gonorhoeae очень разнообразны. Один и тот же штамм единовременно способен экспрессировать более 7 различных вариантов белков [157, 162].
Некоторые патогенные микроорганизмы (бацилла сибирской язвы, Clostridium perfringens, пневмококки, возбудители чумы и туляремии) обладают способностью образовывать капсулу в организме животных и человека. Есть микроорганизмы, которые продуцируют капсулу как в организме, так и на питательных средах (возбудители риносклеромы, озены, пневмонии Фридлендера).
Капсулообразование обеспечивает микробам устойчивость против фагоцитоза и антител, увеличивает их инвазионные свойства. Так, например, капсульные сибиреязвенные бациллы не подвергаются фагоцитозу, в то время как бескапсульные варианты легко фагоцитируются. Более высокая вирулентность капсульных микробов связана с токсическими веществами, заключенными в капсуле [155].
По химическому составу капсульное вещество состоит у одних видов микробов из сложных полисахаридов, а у других – из протеинов.
54
Оно может быть неодинаковым у отдельных штаммов одного и того же вида и может быть сходным у разных бактерий. В капсульных полисахаридах имеются азотсодержащие или безазотистые соединения. Они наделяют микроорганизмы типовой специфичностью. У пневмококков II и III типа капсула представляет собой глюкозид целлобиуриновой кислоты в высокополимеризованном состоянии, у I и IV типа капсула содержит высокополимеризованные соединения аминосахаров и органических кислот, у некоторых бацилл – полипептид d- глютаминовой кислоты, у сибиреязвенной бациллы – глюкопротеин [148, 157].
Агрессины микроорганизмов. Кроме токсигенности, инвазивности
икапсулообразования, патогенные микробы обладают способностью выделять вещества, подавляющие защитные силы организма и усиливающие патогенное проявление многих возбудителей инфекционных болезней. О. Байль назвал их агрессинами. Природа и химический состав их еще не выяснены. Агрессины были обнаружены в перитонеальном и плевральном экссудатах лабораторных животных, зараженных сибиреязвенными бациллами, пневмококками и другими микробами. Сами по себе агрессины, освобожденные фильтрованием от бактерии и клеток экссудата, при введении животному являются безвредными, но при добавлении их к несмертельной дозе микроба развивается тяжелый инфекционный процесс, нередко заканчивающийся смертью животного
[149].
Агрессины были обнаружены у возбудителей брюшного тифа, паратифов, холеры, сибирской язвы, дифтерии, чумы, туберкулеза, гноеродных заболеваний.Вероятно, агрессины представляют собой не одно, а несколько различных веществ, возникающих в процессах жизнедеятельности патогенных микроорганизмов (некоторые соединения поверхностных структур микробных клеток, продукты расщепления ДНК
иРНК).
В. Браун с сотрудниками установили, что вирулентные бактерии вырабатывают в организме особое вещество, стимулирующее их рост и уничтожающее невирулентные типы этих бактерий. Оно образуется бактериями из продуктов распада ДНК [112, 156].
Патогенность и вирулентность являются множественными биологическими признаками, обусловленными хромосомными и внехромосомными генами (эписомами), детерминирующими выработку активных токсических веществ (экзотоксины, ферменты патогенности и др.), изменением клеточных оболочечных структур (капсулы, активные соединения, называемые антигенами) и некоторых особенностей метаболизма патогенных микроорганизмов, позволяющих им выживать в условиях беспрерывно меняющейся среды макроорганизма [124].
55
Вирулентность – это динамическое свойство, которое находится под контролем мутационного процесса, постоянно происходящего как у возбудителя, так и у хозяина, и обеспечивает непрерывность отбора полезных для каждого из них изменений. Диапазоны вирулентности колеблются от абсолютного паразитизма до уровня сапрофитизма. Патогенные виды могут длительное время сосуществовать с макроорганизмом в виде латентных (скрытых) форм.
Для описания взаимодействий хозяина и паразита предложено множество терминов, смысл которых часто трактуется по-разному.
На основании анализа накопленных данных A. Casadevall и L.A. Pirofski предложили унифицировать терминологию, описывающую взаимодействия «хозяин – паразит» [146].
Термин “инфекция” (инфекционный процесс) используется для описания процессов "приобретения" нового микроорганизма, размножающегося в организме хозяина.
Для характеристики возможных вариантов исходов и характера течения инфекционного процесса предлагается использовать следующие термины:
–комменсализм – состояние, при котором сохранение микроба в организме хозяина не сопровождается повреждением последнего, однако отмечается активация систем специфической и неспецифической резистентности;
–симбиоз (мутуализм) – состояние, при котором и микроб, и хозяин получают адаптивные преимущества;
–инфекционная болезнь – клинические проявления повреждений макроорганизма, возникающих в результате взаимодействий хозяин – паразит;
–персистенция – состояние, при котором факторы резистентности хозяина не обеспечивают элиминацию микроорганизма, сопровождающееся длительным, но незначительным повреждением, в зависимости от баланса взаимодействия хозяин – паразит может эволюционировать в инфекционную болезнь;
–колонизация – состояние, развивающееся вслед за приобретением хозяином нового микроорганизма, характеризуется динамичностью и неустойчивостью взаимоотношений хозяин – паразит, эволюционирует в другие формы взаимоотношений [100].
Предложенный вариант унификации терминологии может вызвать некоторые возражения, однако он отражает важную тенденцию в эволюции представлений о характере взаимоотношений «хозяин – паразит».
Основные этапы инфекционного процесса. За традиционным и вполне обоснованным представлением о микроорганизмах как о существах, стоящих на низших ступенях эволюции, следует оценка их
56
роли во взаимоотношениях с многоклеточными организмами как подчиненной, что отражается и в терминологии [75, 77, 159].
По отношению к микроорганизмам употребляют термины “паразиты”, “комменсалы”. Однако существует несколько парадоксальная точка зрения, согласно которой ответ на вопрос о том, кто же является паразитом, микроб или человек – далеко не однозначен [2].
Всистеме «человек – микроб» общее количество человеческих клеток составляет 1013, а микробных – 1014-1015. Ряд необходимых для организма человека питательных веществ синтезируется эндогенной микрофлорой. Главное преимущество, которое получают микроорганизмы, сосуществующие с многоклеточными организмами, – стабильность окружающей среды по параметрам температуры, ионному составу, наличию питательных веществ.
Таким образом, оценить, кто же получает от сосуществования большую выгоду, достаточно сложно. По крайней мере следует признать, что сосуществование бактерий и человека абсолютно равноправно [1].
Винфекционном процессе традиционно выделяют следующие звенья, которые предполагают непосредственный физический контакт между микроорганизмом и клеткой хозяина:
1)адгезия микроорганизмов к эпителию хозяина;
2)инвазия микроорганизмов во внутренние среды организма хозяина;
3)пролиферация микроорганизмов во внутренней среде организма хозяина.
При одних инфекциях перечисленные процессы развиваются последовательно, при других происходит только адгезия.
Впатогенезе инфекций важное значение имеют также процессы, непосредственно не связанные с физическим контактом клеток. Речь идет о продукции микроорганизмами токсинов, а макроорганизмом – антител. В этих случаях клетка-эффектор и мишень оказываются пространственно разделенными.
Адгезия. Все микроорганизмы обладают выраженной способностью прикрепляться к органическим и неорганическим поверхностям. Естественный образ жизни большинства микроорганизмов связан с их закреплением на каких-либо субстратах. Размножение в бульонной культуре, используемое в лабораторных условиях, является скорее исключением, чем “правилом” в жизни микроорганизмов.
Для практических целей выделяют две группы механизмов адгезии – неспецифические и специфические [45, 86].
Неспецифическая адгезия опосредована физико-химическими взаимодействиями бактерий с поверхностями. К ним относятся:
электростатические взаимодействия;гидрофобные взаимодействия;ван-дер Ваальсовы взаимодействия;
57
броуновское движение.
Неспецифическая адгезия, как правило, обратима. Для описания
этого типа адгезии в англоязычной литературе иногда используют термин “docking” (постановка в док). Для описания специфической адгезии, которую считают необратимой, используют термин “anchoring” (заякоревание) [92, 107].
Специфическая адгезия происходит в результате молекулярных взаимодействий между адгезином микробной клетки и рецептором клетки хозяина.
Под адгезинами понимают поверхностные структуры микробных клеток и входящие в их состав макромолекулы, обычно белки, посредством которых осуществляется прикрепление к специфическим поверхностям.
Под рецептором подразумевают структуру, комплементарную адгезину и находящуюся на поверхности эукариотической клетки. Функцию рецепторов в процессе адгезии выполняют карбогидраты или пептидные (белковые) фрагменты, локализованные на мембране эукариотических клеток [126, 139].
Специфическая адгезия – один из частных случаев универсального биологического механизма: лиганд-рецепторных взаимодействий, участвующих в реакции антиген – антитело, передаче гормональных и нейросигналов и в ряде других процессов. Основу таких взаимодействий составляет пространственная комплементарность взаимодействующих структур. Для ее описания обычно используют аналогию "ключ–замок".
Адгезины часто являются лектинами – протеинами, способными связываться с карбогидратами.
Представители двух основных таксономических групп микроорганизмов ( грамположительные и грамотрицательные бактерии) используют различные стратегии специфической адгезии. У грамотрицательных микроорганизмов молекулы адгезинов входят в состав специализированных органелл – ворсинок (фимбрий, пилей), вследствие чего они названы фимбриальными адгезинами [148, 139].
Ворсинки представляют собой тонкие и длинные белковые структуры диаметром около 10 нм и длиной несколько сотен нанометров. Дистальная часть ворсинки представлена еще более тонкой фибриллой, на конце которой располагается молекула собственно адгезина. У грамотрицательных бактерий различают несколько типов ворсинок. Основой классификации служат структура ворсинок, рецептор связывания и механизм сборки. Один штамм микроорганизмов может обладать несколькими типами ворсинок.
Пили – разновидность ворсинок, осуществляющих контакт между микробными клетками в процессе конъюгации [102].
58
У грамположительных бактерий фимбриальные адгезины не описаны. Эти микроорганизмы осуществляют адгезию посредством афимбриальных адгезинов. Структура многих афимбриальных адгезинов не установлена, большинство из известных являются белковыми молекулами, связанными с цитоплазматической мембраной микробной клетки. Рецепторами для адгезинов грам(+) бактерий чаще всего являются фибронектин и белки межклеточного матрикса. Афимбриальные адгезины описаны и у грам(–) бактерий [119, 125].
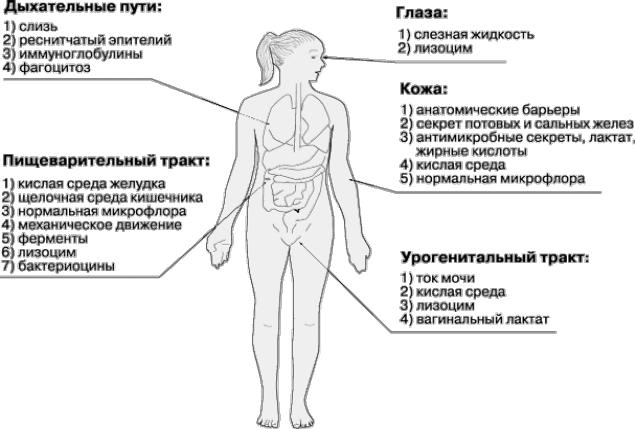
Адгезия является начальным и безусловно необходимым этапом любого инфекционного процесса. Поэтому вполне естественно, что многоклеточные организмы выработали систему защиты, ограничивающую адгезию. Механизмы защиты, характерные для различных локусов организма человека, контактирующих с внешней средой, представлены на рис.8.
Рис. 8. Факторы защиты барьерных органов человека, связанные с внешней средой
Как следует из рисунка 8, во многих случаях одним из важных защитных факторов макроорганизма является "нормальная" микрофлора, не допускающая контакта адгезинов патогенных микроорганизмов с рецепторами хозяина.
59
Фимбриальные адгезины обеспечивают более эффективную адгезию, чем афимбриальные. Они оказываются локализованными на длинной тонкой ножке, что облегчает их контакт с рецептором и, вероятно, позволяет преодолевать барьер "нормальной" микрофлоры и другие защитные механизмы.
Инвазия. Термин “инвазия” используется для описания двух различных процессов: распространения микроорганизмов в межклеточных пространствах тканей организма хозяина и проникновения их внутрь его клеток [127].
Распространение микроорганизмов по межклеточным пространствам обеспечивают внеклеточно секретируемые белки, обладающие ферментативной активностью и нарушающие целостность внеклеточного матрикса. К ним относятся гиалуронидазы, нейраминидазы, коллагеназы, стрептокиназы, стафилокиназы и т.д. Ферменты, относящиеся к двум последним группам, обеспечивают конвертацию неактивного плазминогена в плазмин, который разрушает фибрин и препятствует свертыванию крови [59, 156].
Определенное значение во внеклеточном распространении бактерий, вероятно, имеют также бактериальные протеазы, липазы, нуклеазы и гликогидролазы. Все перечисленные факторы действуют в ближайшем окружении микробной клетки и, как правило, не оказывают системного воздействия на организм хозяина [142].
Тканевому распространению микроорганизмов способствуют также ферменты фосфолипазы, вызывающие лизис эукариотических клеток в результате образования пор в цитоплазматической мембране. К фосфолипазам относятся широко распространенные среди микроорганизмов гемолизины [43, 79].
Для проникновения внутрь эукариотических клеток у микроорганизма есть два пути инвазии: пассивный и активный.
Под пассивным путем инвазии имеется в виду фагоцитоз. Фагоцитоз является одной из наиболее древних защитных реакций макроорганизма, направленных на защиту от микроорганизмов, попавших во внутреннюю среду организма хозяина. Фагоцитозу подвергаются все микроорганизмы. Исходом подавляющего большинства бактерий является их гибель. Лишь немногие виды микроорганизмов приобрели способность выживать внутри фагоцитов.
Активная инвазия предполагает способность микроорганизмов проникать внутрь клеток, не являющихся "профессиональными" фагоцитами. Внутриклеточная среда эукариотических организмов потенциально представляет собой значительную по объему экологическую нишу. Не удивительно, что часть микроорганизмов, адаптированных к существованию на эпителиальных поверхностях, выработали механизмы для активного проникновения внутрь этих объектов. Способность к
60
