
4 курс / Лучевая диагностика / 2__~1
.PDF5.2. Внутритканевая брахитерапия
При внутритканевом облучении источники вводятся в объем мишени для создания предписанной дозы с приемлемой гомогенностью пространственного распределения дозы. До появления компьютерных систем планирования было разработано несколько классических систем имплантации, позволяющих рассчитать полную активность, число и распределение источников для предписываемой дозы в заданном мишенном объеме. Соотношения между размерами мишени и полной активностью даются в табулированной форме для номинальной предписываемой дозы. Правила распределения источников определяют отдельно для каждой системы. Со временем вследствие внедрения компьютерного планирования практическая ценность этих систем уменьшилась. Однако они остаются фундаментом в планировании внутритканевой брахитерапии как для помощи в выборе распределения источников внутри мишени, обеспечивающих однородность дозового распределения, так и для гарантии согласованности методик облучения для всех пациентов. Дополнительно классические системы имплантации часто служат инструментом для независимой проверки гарантии качества компьютерных планов облучения.
5.2.1. Система Патерсона–Паркера (Манчестерская система)
Эта система была развита Патерсоном и Паркером в 1934 году с целью обеспечения однородной дозы на плоскости или поверхности облучаемого объема ( 10 % от предписанной или установленной дозы). Источники распределяются неравномерно, следуя специальным правилам, основанным на размере объема мишени, с концентрацией источников большей силы на периферии объема мишени. Такое неоднородное распределение активности источников достигается либо используя источники разной силы, либо изменяя пространственное положение источников одинаковой силы. Дозовые таблицы Патерсона –Паркера дают величину кумулятивной активности источников, необходимой для создания дозы в 860 сГр (используя современные значения переводных коэффициентов и дозовые единицы) в зависимости от облучаемой площади (планарная имплантация) или облучаемого объема [23].
311

Одинарная плоскость. Катетеры источников располагаются в плоскости на расстоянии 1 см друг от друга для облучения слоя ткани толщиной 1 см. Предписываемое значение дозы создается в мишенной плоскости параллельной плоскости источников и находящейся от нее на расстоянии 0.5 см (рис. 11.17). Доля силы источников на периферии имплантации зависит от полной облучаемой площади: для площади менее 25 см2 две трети от полной активности имплантируется на периферии, для площади между 25 и 100 см2 – половина активности и для площади, большей, чем 100 см2 – одна треть активности имплантируется на периферии. Если используются пересекающиеся на концах иглы (см. рис. 11.17), то длина основных игл может быть уменьшена на 10 % для каждого пересечения.
Рис. 11.17. Плоская имплантация по системе Патерсона–Паркера [13]
Двойная плоскость. Более толстые слои ткани (обычно до 2,5 см) облучаются источниками, расположенными по разные стороны слоя в двух параллельных плоскостях. Требуемая полная сила источников делится поровну между плоскостями, а в каждой плоскости располагается согласно правилам для одинарной плоскости. Если расстояние между плоскостями превышает 1 см, вводятся поправочные факторы, чтобы минимальная доза была меньше предписанной не больше, чем на 10 %. Предписанная доза назначается
312
в каждой из внутренних плоскостей, расположенных на расстоянии 0,5 см от плоскостей источников. Отметим, что для толстых мишеней доза в средней плоскости может оказаться на 20 – 30 % ниже предписанной.
Другие объемы. Для некоторых видов опухоли лучше использовать трехмерные имплантаты, имеющие форму цилиндра, сферы или прямоугольного параллелепипеда. Правила распределения силы источников для каждой формы следуют концепции отношения периферия/ядро. В типовом варианте 75 % силы источников размещается на периферии и 25 % в ядре (середине) объема.
5.2.2. Система Квимби
Эта система, развитая Квимби в 1932 году [24], базируется на однородном распределении силы источников, обеспечивая более высокую мощность дозы в центре облучаемого объема по сравнению с периферией. Для плоскостных имплантаций таблицы Квимби дают количество миллиграмм-часов, необходимое для получения 1000 Р в центре облучаемых плоскостей на расстоянии до 3 см от плоскости имплантации.
В типичном варианте для создания равной дозы с помощью похожих плоской или объемной имплантаций полная сила источника, требуемая при использовании системы Квимби, существенно
больше, чем полная сила, требуемая системой Патерсона–Паркера. В работе [17] указывается, что M. Stoval и R.J. Shalek сравнили
системы Квимби и Паттерсона–Паркера для отдельных идеализированных случаев и обнаружили, что между системами существуют значительные различия. Авторы призывают поэтому к осторожности при использовании этих систем как взаимозаменяемых.
5.2.3. Парижская система
Парижская система [25] первоначально предназначалась для одноплоскостной и двуплоскостной имплантаций с использованием параллельных и эквидестантных игл, образующих сборки треугольной или прямоугольной формы, если смотреть на них с концов игл (рис. 11.18). Все источники, применяемые в Парижской системе имплантации, должны быть одинаковой линейной силы, но при этом могут быть разной длины. Система рекомендует более
313

широкие промежутки для более длинных источников и для больших объемов облучения.
Рис. 11.18. Определение базовой дозы (BD) в имплантациях разной формы для Парижской системы. А – линейные источники имплантируются в сборки разной формы: a – одноплоскостная; b – квадратная; c – треугольная; B – изодозовые кривые в центральной плоскости объема имплантации. Величина изодоз нормирована на среднюю базовую дозу, определяемую как 0.25(BD1+BD2+BD3 +BD4) [17]
В Парижской системе доза задается на изодозовой поверхности, которая называется референсной (опорной) изодозой. На практике, однако, величина референсной дозы фиксируется на уровне 85 % от «базовой дозы». Последняя определяется как средняя мини-
314
мальная доза между источниками. Было показано, что референсная изодоза для Парижской системы окружает имплантат в пределах нескольких миллиметров и ее величина приближенно равна 85 % от базовой дозы. На рис. 11.18 демонстрируется расчет базовой дозы в Парижской системе для имплантаций различной формы.
Так как в Парижской системе используется максимум две плоскости имплантации, то типовой размер мишени в ней составляет не больше 2,2 см по толщине. Иначе локальные горячие пятна внутри объема имплантации станут неприемлемыми. Доза в горячих пятнах допускается до 200 %, а размер должен быть не больше 1 см.
5.2.4. Рекомендации МКРЕ, сформулированные в Публикации 58
Публикация МКРЕ 58 посвящена спецификации и протоколированию внутритканевой брахитерапии [27]. Продолжая концептуальное направление, начатое в Публикации 50 [28], Публикация 58 вводит понятия определяемого объема опухоли (GTV) как объема опухоли, видимого на изображении или прощупываемого пальпацией в клинике, и клинического объема мишени (CTV) как объема, куда потенциально могут распространиться опухолевые клетки или микроскопические диссеминаты. В брахитерапии планируемый объем мишени (PTV) считается идентичным CTV, так как неопределенность в позиционировании источников исключается. Публикация формулирует дозиметрические концепции, аналогичные принятым в Парижской системе, но вместо термина «точки базовой дозы» вводит термин «точки центральной дозы». В публикации, фактически, проводится расширение Парижской системы, так как позволяется использовать много центральных плоскостей в тех случаях, когда это диктуется особенностями имплантации. Кроме того, рекомендуется протоколировать объем низкой дозы (LD), определяемый как объем CTV, получающий меньше 90 % от предписанной дозы, и отмечать область высокой дозы (HD), определяемую как объем ткани, получающий дозы выше 150 % от средней центральной дозы (MCD). Публикация 58 рекомендует также протоколирование индекса дозовой негомогенности (DHI) имплантации, определяемого как отношение минимальной дозы в мишени (MTD) к средней центральной дозе, что отражает концепцию Парижской системы, заключающуюся в том, что 85 % от средней ба-
315
зовой дозы должно покрывать мишень, и поэтому использоваться как предписываемая доза.
5.3. Системы дистанционного последовательного введения катетеров и источников
До последнего времени при временной имплантации источники вводились вручную в аппликаторы или в катетеры, размещенные в объеме мишени. После окончания сеанса источники удалялись также вручную. Эти процедуры в результате приводят к нежелательному облучению медицинского и обслуживающего персонала.
Подобного недостатка лишены системы дистанционного последовательного введения источников (англ. ―afterloading‖), управляе-
мые компьютерами. Такие аппараты можно подразделить на три типа:
•системы с низкой мощностью дозы (LDR);
•системы с высокой мощностью дозы (HDR);
•системы с импульсной мощностью дозы (PDR).
Системы с дистанционным афтелодингом по сравнению с ручным способом кроме отмеченного достоинства позволяют также увеличить число облучаемых пациентов и улучшают согласованность и воспроизводимость сеансов облучения. Они используются как для внутритканевой, так и для внутриполостной имплантациии. В их комплектацию входят и компьютерные системы дозиметрического планирования. В качестве источников в аппаратах афтелодинга обычно применяются радионуклиды 60Со, 137Cs и 192Ir, но наибольшее распространение в силу своей относительно невысокой энергии (~ 400 кэВ) и высокой удельной активности получил 192Ir. На рис. 11.19, 11.20 и 11.21 показаны три аппарата (два зарубежных и отечественный) для дистанционного введения источников.
5.4. Постоянные имплантаты в простате
Брахитерапия с постоянными имплантатами получила твердое признание как метод лечения ранней стадии рака простаты, когда болезнь огра-
ничена объемом самой железы. Этот метод имеет преимущество перед хирургическим удалением простаты, так как требует относительно несложной хирургической процедуры, и перед дистанци-
316

онной лучевой терапиией, так как выполняется за одну процедуры вместо шести – восьми недель, как при облучении внешними пучками.
Рис. 11.19. Селектрон-LDR/MDR 137Cs – многоканальная (3 – 6 каналов) система для облучения низкой мощностью дозы с дистационным афтелодингом
Впервые метод постоянных имплантатов с он-лайн ультразвуковой визуализацией был предложен в работе [28]. Позднее для наблюдения и управления имплантацией стали применять также КТ. Постоянное размещение источников с короткоживущими ра-
дионуклидами, испускающими низкоэнергетические фотоны, часто используется еще как первичное облучение (англ. ―boost‖). B 1999
году ААPM опубликовала отчет [29] с подробным описанием физических и клинических аспектов метода постоянных имплантатов с ультразвуковой визуализацией.
317
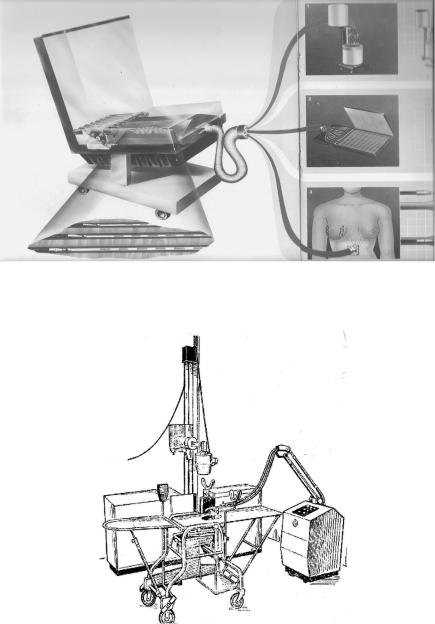
Рис. 11.20. Микроселектрон LDR/MDR 192Ir/ 137Cs – 15-канальная система для облучения низкой и средней мощностью дозы с дистанционным афтелодингом
Рис. 11.21. Схематическое изображение внутриполостного гамматерапевтического шлангового аппарата АГАТ-В
318
В настоящее время многие фирмы предлагают специальную портативную аппаратуру для лечения рака простаты с помощью
этого метода. В качестве источников используются гранулы (англ.
seeds) с 125I и 103Pd. Рекомендуемая доза на простату в случае применения 125I составляет 144 Гр и 115 – 120 Гр для 103Pd [29]. Это
значительно больше, чем рекомендуемая доза при дистанционной фотонной терапии (~ 72 – 74 Гр). Такое повышение дозы стало возможным в силу того, что при постоянной имплантации низкоэнергетических источников близко расположенные к простате критические органы и нормальные ткани получают существенно меньшую дозу по отношению к дозе в мишени, чем в дистанционной фотонной терапии.
При планировании облучения капсула простаты, визуализируемая на ультразвуковом аппарате, сегментируется как GTV. Вокруг простаты на расстоянии 3 – 5 мм, за исключением заднего направления, выделяется дополнительная область, присоединяемая к GTV. Так образуется планируемый объем мишени (PTV). Целью планирования является покрытие PTV предписываемой дозой (например, 95 % или выше изодозой), выдерживая в то же время адекватно низкие дозы на уретру и прямую кишку. Пример гистограммы доза – объем, полученной при предварительном планировании постоянной имплантации, показан на рис. 11.22.
Распределение источников при постоянной имплантации разделяется на однородное и модифицированное однородное (рис. 11.23). В первом случае источники располагаются в узлах 3-мерной сетки с расстоянием 1см вдоль координатных осей. В этом варианте не соблюдается конформность по отношению к внешнему контуру простаты. При модификации однородного распределения периферические источники располагаются так, чтобы добиться конформности с капсулой простаты.
319

Рис. 11.22. Кумулятивная гистограмма доза – объем для простаты, уретры и объема, окружаемого стенками прямой кишки, для постоянных имплантатов 103Pd. До-
зиметрические параметры следующие: а) простата – V100 = 98,3 %; V150 = 68,8 %; V200 = 34 % от облучаемого объема; б) уретра – V100 =100 %; V120 =1 %
Рис. 11.23. Модифицированное однородное распределение источников 125I и создаваемое ими изодозы (110 и 90 %) в разных срезах простаты при постоянной имплантации
320
