
6 курс / Клинические и лабораторные анализы / Группы крови человека
.pdf152.Spencer H.C., Miller L.H., Collins W.E. et al. The Duffy blood group and resistance to Plasmodium vivax in Honduras //Am. J. Trop. Med. Hyg. – 1978. – V. 27. – P. 664–670.
153.Szabo M.C., Soo K.S., Zlotnik A., Schall T.J. Chemokine class differences in binding to the Duffy antigen-erythrocyte chemokine receptor // J. Biol. Chem. – 1995. – V. 270. –
P.25348–25351.
154.Szymanski I.O., Huff S.R., Delsignore L. An autoanalyzer test to determine immunoglobulin class and IgG subclass of blood group antibodies // Transfusion. – 1982. – V. 22. – P. 90–95.
155.TamasauskasD.,PowellV.,SakselaK.,YazdanbakhshK.Ahomologousnaturallyoccurring mutation in Duffy and CCR5 leading to reducer receptor expression // Blood. – 2001. –
V.97. – P. 3651–3654.
156.Tanner M.J.A., Anstee D.J., Mallinson G. et al. Effect of endoglycosidase F-Peptidyl N-glycosidase F preparations on the surface components of the human erythrocyte // Carbohydr. Res. – 1988. – V. 173. – P. 203–212.
157.Tippett P., Gavin J. Duffy groups and malaria in monkeys [Abstract] // Transfusion. – 1979. – V. 19. – P. 662.
158.Toivanen P., Hirvonen T. Antigens Duffy, Kell, Kidd, Lutheran and Xg a on fetal red cells // Vox Sang. – 1973. – V. 24. – P. 372–376.
159.Toivanen P., Hirvonen T. Fetal development of red cell antigens K, k, Lu a, Lu b, Fy a, Fy b, Vel and Xg a // Scand. J. Haematol. – 1969. – V. 6. – P. 49–55.
160.Tournamille C., Colin Y., Cartron J.-P., Le Van Kim C. Disruption of a GATA motif in the
Duffy gene promoter abolishes erythroid gene expression in Duffy-negative individuals // Nature Genet. – 1995. – V. 10. – P. 224–228.
161.Tournamille C., Filipe A., Wasniowska K. et al. Structure-function analysis of the extracellular domains of Duffy antigen / receptor for chemokines: characterization of antibody and chemokine binding sites // Brit. J. Haemat. – 2003. – V. 122. – P. 1014–1023.
162.Tournamille C., Le Van Kim C., Gane P. et al. Arg89Cys substitution results in very low membrane expression of the Duffy antigen / receptor for chemokines in Fy x individuals // Blood. – 1998. – V. 92. – P. 2147–2152.
163.Tournamille C., Le Van Kim C., Gane P. et al. Close association of the first and fourth extracellulardomainsoftheDuffyantigen / receptorforchemokinesbyadisulphidebondis required for ligand binding // J. Biol. Chem. – 1997. – V. 272. – P. 16274–16280.
164.Tournamille C., Le Van Kim C., Gane P., Cartron J.-P. Molecular basis and PCR-DNA typingofFy a / Fy b bloodgrouppolymorphism//Hum.Genet.–1995.–V.95.–P.407–410.
165.Tsuneyama H., Uchikawa M., Shinozaki K. et al. A deletion in the Duffy gene of an apparently healthy individual with Fy(a −b −) phenotype [Abstract] // Transfusion. – 2000. – V. 40 (Suppl.). – 116S.
166.van Loghem J.J., van der Hart M. Een nieuwe bloed-groep // Ned. Tijdschr. Geneeskd. – 1950. – V. 94. – P. 748–749.
167.van’t Veer M.B., van Leeuwen I., Haas F.J.L.M. et al. Red-cell auto-antibodies mimicking anti-Fy b specificity // Vox sang. – 1984. – V. 46. – P. 88–91.
168.Vengelen-Tyler V. Anti-Fy a preceding anti-Fy3 or –Fy5: a study of five cases [Abstract] // Transfusion. – 1985. – V. 25. – P. 482.
169.Vetter O., Wegner H.Afurther case of anti-Fy b and the frequency of Duffy-antigens in the population of the city of Leipzig //Acta Genet. – 1967. – V. 17. – P. 338–340.
170.Wasniowska K., Blanchard D., Janvier D. et al. Identification of the Fy6 epitope recognized by two monoclonal antibodies in the N-terminal extracellular portion of the Duffy antigen receptor for chemockines // Mol. Immunol. – 1996. – V. 33. – P. 917–923.
171.Wasniowska K., Czerwinski M., Jachymek W., Lisowska E. Expression and binding properties of a soluble chimeric protein containing the N-terminal domain of the Duffy antigen // Biochem. Biophys. Res. Commun. – 2000. – V. 273. – P. 705–711.
631
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
172.Wasniowska K., Eichenberg P., Kugele F., Hadley T.J. Purification of a 28 kD nonaggregating tryptic peptide of the Duffy blood group protein // Biochem. Biophys. Res. Commun. – 1993. – V. 192. – P. 366–372.
173.Wasniowska K., Lisowska E., Halverson G.R. et al. The Fy a, Fy6 and Fy3 epitopes of the Duffy blood group system recognized by a new monoclonal antibodies: identification of a linear Fy3 epitope // Brit. J. Haemat. – 2004. – V. 124. – P. 118–122.
174.Wasniowska K., Petit-Leroux Y., Tournamille C. et al. Structural characterization of the epitope recognized by the new anti-Fy6 monoclonal antibody NaM 185-2C3 // Transfus. Med. – 2002. – V. 12. – P. 205–211.
175.Weistein L., Taylor E.S. Hemolytic disease of the neonate secondary to anti-Fy a //Amer. J. Obstet. Gynec. – 1975. – V. 121. – P. 643–645.
176.Welch S.G., McGregor I.A., Williams K. The Duffy blood group and malaria prevalence in Gambian WestAfricans // Trans. R. Soc. Trop. Med. Hyg. – 1977. – V. 71. – P. 295–296.
177.Wernheimer S.P., Barnwell J.W. Plasmodium vivax interaction with the human Duffy blood group glycoprotein: identification of a parasite receptor-like proteins // Exp. Parasitol. – 1989. – V. 69. – P. 340–350.
178.Westhoff C.M., Reid M.E. The Kell, Duffy, and Kidd blood group systems // Immunohematology. – 2004. – V. 20. – P. 37–49.
179.Williams D., Johnson C.L., Marsh W.L. Duffy antigen changes on red blood cells stored at low temperature // Transfusion. – 1981. – V. 21. – P. 357–359.
180.Williams T.N., Maitland K., Bennett S. et al. High incidence of malaria in aWoolley I.J., Hotmire K.A., Sramkoski R.M. et al. Differential expression of the Duffy antigen receptor for chemokines according to RBC age and FY genotype // Transfusion. – 2000. – V. 40. –
P.949–953.
181.Woolley I.J., Hotmire K.A., Sramkoski R.M. et al. Differential expression of the Duffy antigen receptor for chemokines according to RBC age and FY genotype // Transfusion. – 2000. – V. 40. – P. 949–953.
182.Woolley I.J., Wood E.M., Sramkovski P.A. et al. Expression of Duffy antigen receptor for chemokines during reticulocyte maturation: using a CD71 flow cytometric technique to identify reticulocytes // Immunohematology. – 2005. – V. 21. – P. 15–20.
183.Yazdanbakhsh K., Rios M., Storry J. et al. Molecular mechanisms that lead to reduced expression of Duffy antigens // Transfusion. – 2000. – V. 40. – P. 310–320.
184.Zimmerman P.A., Wooley I., Masinde G.L. et al. Emergence of FY*A null in a Plasmodium vivax endemic region of Papua New Guinea // Proc. Nat.Acad. Sci. USA. – 1996. –V. 96. –
P.13973–13977.
632
Глава 11.
Система Kidd
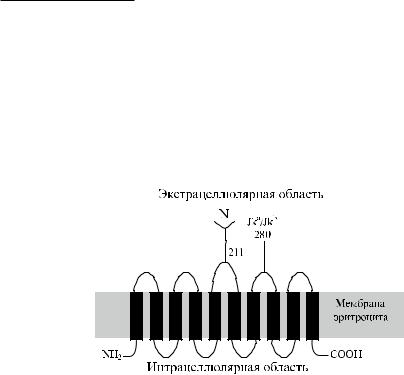
Антигены системы Kidd (Кидд) – Jk a и Jk b – являются продуктами аллельных генов. Антигенные различия Jk a / Jk b обусловлены заменой Asp 280 Asn. Распределение их у представителей разных рас неодинаково. Антитела против антигенов Kidd представляют опасность в клиническом плане, поскольку вызывают замедленные посттрансфузионные реакции.
Антигены Kidd расположены на гликопротеине, имеющем 10 трансмембранных доменов(рис.11.1).Определенаегоаминокислотнаяпоследовательность(рис.11.2).
Рис. 11.1. Строение гликопротеина Kidd: 10 трансмембранных доменов, N- и C-цитоплазматические домены, N-гликан на третьей экстрацеллюлярной петле, на
четвертой петле указана позиция 280, определяющая различие Jk a и Jk b.
MEDSPTMVRV |
DSPTMVRGEN |
QVSPCQGRRC |
FPKALGYVTG |
DMKKLANQLK |
50 |
DKPVVLQFID |
WILRGISQVV |
FVNNPVSGIL |
ILVGLLVQNP |
WWALTGWLGT |
100 |
VVSTLMALLL |
SQDRSLIASG |
LYGYNATLVG |
VLMAVFSDKG |
DYFWWLLLPV |
150 |
CAMSMTCPIF |
SSALNSMLSK |
WDLPVFTLPF |
NMALSMYLSA |
TGHYNPFFPA |
200 |
KLVIPITTAP |
NISWSDLSAL |
ELLKSIPVGV |
GQIYGCDNPW |
TGGIFLGALL |
250 |
LSSPLMCLHA |
AIGSLLGIAA |
GLSLSAPFED |
IYFGLWGFNS |
SLACIAMGGM |
300 |
FMALTWQTHL |
LALGCALFTA |
YLGVGMANFM |
AEGVLPACTW |
PFCLATLLFL |
350 |
IMTTKNSNIY |
KMPLSKVTYP |
EENRIFYLQA |
KKRMVESPL |
|
389 |
Рис. 11.2. Последовательность аминокислот гликопротеина Kidd.
В системе Kidd известен нулевой фенотип Jk(a −b −), который чаще встречается у жителей Полинезии. На эритроцитах Jk(a −b −) отсутствуют антигены Jk a и Jk b, атакжеантигенJk3(Jk ab).Идентифицировано5мутаций,инактивирующихгенJK.
633
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Гликопротеин Kidd выполняет в клетке функцию транспортера мочевины. ГенныйлокусJK(SLC14A1)картированнахромосоме18впозиции18q11–q12.
Гликопротеин JK и ген JK
Задолго до выделения гликопротеина Kidd, картирования и клонирования гена JK было известно, что эритроциты, лишенные антигенов Kidd [Jk(a −b −)], не лизируются в 2М растворе мочевины, а эритроциты, содержащие антигены Kidd, лизируются указанным раствором. Уже тогда возникло предположение, что антигены Kidd участвуют в транспорте мочевины.
Используя нейлоновые мембраны с фиксированными к ним аффинноочищенными IgG-антителами анти-Jk a, анти-Jk b и анти-Jk3, Sinor и соавт. [96] выделили из оболочки эритроцитов субстрат с мол. массой 45 кДа, несущий Jk-антигенную активность. Иммунопреципитат, выделенный с помощью антител анти-Jk3 из эритроцитов всех фенотипов Kidd, за исключением Jk(a −b −), представлял собой гликопротеин с мол. массой 46–60 кДа. После удаления N-гликана из гликопептида обработкой его N-гликаназой мол. масса уменьши-
лась до 36 кДа (Olives и соавт. [70]).
Электронная микроскопия эритроцитов, обработанных антителами IgG антиJk b, меченными ферритином, позволила установить, что эритроциты Jk(a −b + ) несут около 14 тыс. антигенных участков Jk b на 1 клетку (Masouredis и соавт. [53]).
Mannuzzuисоавт.[50]спомощьюгидрофобныхсоединенийртутиингибировали транспорт мочевины и нашли, что количество участков, транспортирующих мочевину,т.е.участков,несущихантигеныJk,составляетоколо32тыс.на1эритроцит.
Olives и соавт. [72] исследовали кДНК эритробластов человека с помощью ПЦР с праймерами, сконструированными по аминокислотной последовательности кроличьего транспортера мочевины. Иммунопреципитацией антителами анти-Jk3 авторы выделили полипептид с мол. массой 36 кДа.
Методом иммуноблоттинга с кроличьими антителами был получен полипептид с мол. массой 46–60 кДа, который присутствовал в эритроцитах всех фенотипов Kidd, кроме Jk(a −b −) (Olives и соавт. [70]). Позднее было установлено, что ген HUT11 представляет собой аберрантный транскрипт или является артефактом клонирования (Sidoux-Walter и соавт. [93]). Другой ген – HUT11А, кодирующий глютаминовую кислоту вместо лизина в положении 44 и 2 дипептида – валин и глицин – вместо 3 после позиции 227, производит гликопротеин Kidd и транспортер мочевины эритроцитов (Sidoux-Walter и соавт. [93], Irshaid и соавт. [37]). Продукт этого гена имеет мол. массу 43 кДа, содержит 389 аминокислот и на 63 % идентичен кроличьему транспортеру мочевины. Протеин содержит 10 трансмембранных доменов. Один из двух N-гликозилированных участков (Asn 211) расположен на третьем экстрацеллюлярном домене.
Ген JK (SLC14A1) имеет величину 30 кб и состоит из 11 экзонов (Lucien и соавт. [48], Irshaid и соавт. [36]). Экзоны 1–3 и часть четвертого (табл. 11.1) представляют нетранслируемый 3ʹ регион, экзоны 4–11 кодируют протеин.
634
Участок, инициирующий трансляцию, расположен на 335 пар выше стартового транслируемого кодона в экзоне 4. Область между нуклеотидами −837 и −336 содержит эритроидоспецифические участки транскрипции GATA-1 и SP1, а также TATA-бокс и инвертированный CAAT-бокс (Lucien и соавт. [48]). Идентифицированы2эритроидныхтранскриптавеличиной4,4и2кб.Последний (меньший из них) образуется за счет пропуска в считывании экзона 3 (Lucien и
соавт.[48]).
|
|
|
|
Таблица 11.1 |
|
|
|
Организация гена JK |
|
|
|
|
|
|
|
|
|
Экзон |
Количество пар |
Позиция |
Размер интрона, кб |
||
оснований |
кодируемых аминокислот |
* |
** |
|
|
|
|
||||
1 |
93 |
|
0,7 |
|
|
2 |
64 |
|
2,4 |
|
|
3 |
157 |
|
3,1 |
|
|
4 |
172 |
1–50 |
0,6 |
0,543 |
|
5 |
190 |
51–113 |
3,55 |
3,0 |
|
6 |
129 |
114–156 |
1,9 |
2,0 |
|
7 |
193 |
157–221 |
2,5 |
2,5 |
|
8 |
148 |
222–270 |
0,27 |
0,217 |
|
9 |
135 |
271–315 |
8,6 |
9,0 |
|
10 |
50 |
316–332 |
1,4 |
1,4 |
|
11 |
551 |
333–389 |
|
|
|
* По Lucien и соавт. [48], **по Irshaid и соавт. [36].
Антигены Jka и Jkb
Антиген Jk a, обнаруженый в 1951 г. Allen и соавт. [3], назван по инициалам 6-го ребенка американской белой женщины, миссис Kidd, родившегося с проявлениями гемолитической болезни. Антитела анти-Jk a реагировали с эритроцитами 77 % жителей г. Бостона (США).
Двумя годами позже (в Англии) Plaut и соавт. [78] нашли антитетичный антиген – Jk b.
Среди европеоидов 76,4 % содержали антиген Jk a, 23,6 % – не содержали (Race, Sanger [82]). Эти данные позволили рассчитать частоту генов Jk a и Jk b (0,5142 и 0,4858), а также частоту генотипов Jk a / Jk a, Jk a / Jk b и Jk b / Jk b (0,2644; 0,4996 и 0,2360 соответственно). Указанные расчетные данные практически не отличались от фактических, полученных при обследовании 1051 канадской семьи сыворотками анти-Jk a и анти-Jk b: ген Jk a имел частоту 0,5162; Jk b –
0,4838 (Chown и соавт. [7], Race и Sanger [82]).
По результатам ДНК-типирования 106 шведов, частота генов Jk a и Jk b составила 0,53 и 0,47 соответственно (Irshaid и соавт. [35]).
Mourant и соавт. [62], Tills и соавт. [102] суммировали результаты популяционных исследований, выполненных различными авторами(табл. 11.2).
635
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Ген Jk a имеет частоту около 50 % среди жителей Европы, его частота выше (около 75 %) среди населения некоторых областей Африки и существенно ниже (20–30 %) в Азии (китайцы, японцы).
Гены Jk a и Jk b передаются по наследству кодоминантно. При обследовании более чем 2000 семей европеоидов установлено, что ожидаемая и фактическая частота фенотипов совпадает (Race и Sanger [82]). Существование редкого молчащего аллеля Jk не оказывало влияния на результаты исследования.
Таблица 11.2
Распределение фенотипов по системе Kidd у представителей разных рас
Фенотип |
|
Частота фенотипа (%) среди |
||
европеоидов |
негроидов |
монголоидов |
||
|
||||
Jk(a +b −) |
26,3 |
51,1 |
23,2 |
|
Jk(a −b + ) |
23,4 |
8,1 |
26,8 |
|
Jk(a +b + ) |
50,3 |
40,8 |
49,1 |
|
Jk(a −b −) |
< 0,001 |
< 0,001 |
0,9 (жители Полинезии) |
|
Различие генов Jk a и Jk b обусловлено перемещением G 838 A, ведущим к аминокислотной замене Asp 280 Asn на четвертой экстрацеллюлярной петле Jk-
гликопротеина(Olivesисоавт.[71],Reid,Lomas-Francis[83],Westhoff,Reid[107]).
НуклеотиднаязаменаG838AваллелеJk a расположенапередсайтомрестрикции MnlI, ее идентифицируют при генотипировании (Sidoux-Walter и соавт. [93]).
Для определения генотипа системы Kidd используют ПЦР с аллельспецифическими праймерами (Irshaid и соавт. [37], Hessner и соавт. [30]). В одной из модификаций применена одноэтапная ПЦР с использованием прямого Jk a- и обратного Jk b-специфических праймеров. Продукты ПЦР (Jk a и Jk b) четко отличались друг от друга (Irshaid и соавт. [37]).
Обработка эритроцитов папаином, фицином, трипсином, химотрипсином и проназой усиливает реакции антител анти-Jk a, анти-Jk b и анти-Jk3. При фенотипировании лиц по системе Kidd нередко прибегают к предварительной обработке эритроцитов бромелином (Issitt, Anstee [38]). Антигены Jk a, Jk b и Jk3 не разрушаются сиалидазой и сульфгидрильными редуцентами (Daniels [10]).
Антитела анти-Jka и анти-Jkb
Вслед за первым описанием антител, найденных Allen и соавт. [3] в сыворотке крови мисс Kidd, появились другие сообщения о выявлении антител анти-Jk a
(М.А. Умнова и Т.М. Пискунова [1], Rosenfield и соавт. [85], Lindervall [46], Hunter и соавт. [34], Milne и соавт. [58], van der Hart, van Loghem [102], Greenwalt и со-
авт.[23]).Аналогично:послеоткрытияPlautисоавт.[78]антигенаJk b вскорепоследовали другие публикации с описанием антител анти-Jk b (Rosenfield и соавт. [84], Sanger и соавт. [90], van Loghem и соавт. [105], Geczy, Leslie [22]). Несмотря на то что в последующие десятилетия было найдено много других образцов сывороток с антителами системы Kidd, ни анти-Jk a, ни тем более анти-Jk b не относят к широко распространенным антителам. Они часто сочетаются с антителами к другим
636
групповым факторам эритроцитов, что свидетельствует о сравнительно невысокихиммуногенныхсвойствахантигеновсистемыKidd.Влитературеимеетсяединственное описание анти-Jk a-антител естественного происхождения, обнаруженных у 9-месячных близнецов (Rumsey и соавт. [86]). В остальных случаях антитела системы Kidd находили у лиц, имевших переливания крови и беременности. В одном из наблюдений антитела анти-Jk a появились во время первой беременности у женщины, не получавшей гемотрансфузий (Hunter и соавт. [34]). Описан случай обра- зованияанти-Jk a послевнутриматочнойгемотрансфузии(Harrison,Popper[25]).
Антитела системы Kidd относятся к трудно выявляемым. Некоторые из них непосредственно агглютинируют нативные эритроциты, однако реакции слабо выражены (Allen и соавт. [3], Lindervall [46], Hunter и соавт. [34], Geczy, Leslie [22], Simmons и соавт. [95], Morgan и соавт. [60], Kronenberg и соавт. [42]). Для выявления антител системы Kidd наиболее подходящим является непрямой антиглобулиновый метод Кумбса. Для обнаружения слабых антител эритроциты предварительно энзимируют.
Maynard и соавт. [55] описали антитела, выявляемые только в полибреновом тесте, которые вызвали гемолитическую посттрансфузионную реакцию.
Многие образцы анти-Jk a-антител реагируют сильнее с эритроцитами
Jk(a +b −), чем Jk(a +b + ) (Race, Sanger [82], Crawford и соавт. [8]). При использо-
вании эритроцитов Jk(a +b + ), несущих только 1 дозу антигена Jk a, слабые антитела указанной специфичности могут остаться не выявленными, что сопряжено с угрозой гемолитических посттрансфузионных реакций. В связи c этим панели для скрининга антиэритроцитарных антител комплектуют эритроцитами Jk(a +b −) и Jk(a −b + ), но не Jk(a +b + ), поскольку эффект дозы свойственен также и анти-Jk b-антителам.
Антитела системы Kidd представлены IgG или смесью IgG и IgM. Сыворотки, содержащие только IgM-антитела, встречаются редко (Polley и соавт. [80], Szymanski и соавт. [100]). В большинстве случаев антитела анти-Jk a относятся к IgG3-субклассу или являются смесью IgG3 и IgG1, иногда присутствуют толь-
ко IgG1 (Hardman, Beck [26]) или IgG2 (Szymanski и соавт. [100]). Из 6 образцов анти-Jk b-антител 4 относились к субклассу IgG1, 1 был представлен смесью IgG1
иIgG3, 1 – IgG1 и IgG4 (Hardman, Beck [26]). Примерно 40 % образцов антител
Kidd обладает способностью связывать комплемент. Некоторые антитела могут быть выявлены лишь при условии, что антиглобулиновые реагенты содержат, помимо антиглобулиновых антител, преципитирующие антикомплементарные антитела (Mollison и соавт. [59], Yates и соавт. [110]). Способностью связывать комплемент обладали сыворотки, содержащие IgМ компонент, IgG-антитела системы Kidd комплемент не связывают (Yates и соавт. [110]).
Некоторые антитела ингибировались ионами кальция (O’Brien и соавт. [65]). Антителаанти-Jk a вызывалитяжелыепосттрансфузионныегемолитическиереакциинемедленноготипа,втомчислеслетальнымисходом(Lindervall[46],Kronenberg
исоавт.[42],Maynardисоавт.[55],Degnan,Rosenfield[12],Polesky,Bove[79]).
637
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Описаны посттрансфузионные реакции замедленного типа. Они были тяжелыми, сопровождались олигурией, почечной недостаточностью со смертельным исходом (Mollison и соавт. [59], Pineda и соавт. [75], Ness и соавт. [64]).
Антитела анти-Jk b также вызывали тяжелые посттрансфузионные реакции
(Morgan и соавт. [60], Holland, Wallerstein [31]).
Одной из особенностей посттрансфузионных реакций, вызванных Kiddантителами, является быстрое снижение активности антител, в силу чего они могут быть не выявлены в последующих тестах на индивидуальную совместимость
(Rosenfield и соавт. [85], Lindervall [46], Morgan и соавт. [60], Matson и соавт. [54]). Pineda и соавт. [75, 76] подсчитали, что каждая третья замедленная посттрансфузионная реакция обусловлена анти-Jk a-антителами. По данным Чинь Суан Киэм и соавт. [2], проанализировавших в одном из вьетнамских госпиталей 63 случая гемолитических посттрансфузионных реакций замедленного
типа, в 9 случаях выявлены антитела системы Kidd (5 анти-Jk a, 4 анти-Jk b). Элиминация несовместимых эритроцитов в организме реципиента, содер-
жащего антитела системы Kidd, происходит быстро (Maynard и соавт. [55], Cutbush, Mollison [9], Howard и соавт. [33]).
Вреакции с монослоем моноцитов активность антител анти-Jk a и анти-Jk b усиливаласьвприсутствиикомплемента(Nanceисоавт.[63],Zupanskaисоавт.[112]).
В1 случае антитела анти-Jk a вызвали гемолиз и снижение уровня гемоглобина у реципиента Jk(a + ) после трансплантации костного мозга от сестры Jk(a −).
Вданном случае имела место реакция трансплантат против хозяина: антитела против эритроцитов реципиента вырабатывали пересаженные иммунокомпетентные клетки донора-сестры, которая, по-видимому, ранее была сенсибилизирована антигеном Jk a. Лечение циклоспорином и метотрексатом устранило выработку антител (Leo и соавт. [45]).
Антитела Kidd не вызывают клинически выраженной ГБН (Dorner и соавт. [13]). Описан всего один случай тяжелой ГБН, обусловленной антителами антиJk a и сопровождающейся ядерной желтухой (Matson и соавт. [54]). Причины отсутствия ГБН, даже при высоких титрах антител Kidd, не выяснены.
Помимо аллоиммунных, найдены аутоиммунные антитела Kidd (van Loghem, van der Hart [106], Patten и соавт. [73], Strikas и соавт. [99], Sosler и со-
авт. [98], Sander и соавт. [87], Gandy и соавт. [21]), которые в ряде случаев вызывали аутоиммунную гемолитическую анемию. Один из больных, у которого, помимо аутоиммунной гемолитической анемии, развилась идиопатическая тромбоцитопеническая пурпура, был фенотипирован сначала как Jk(a −b + ), однако позднее оказалось, что он относится к группе Jk(a +b + ), что было подтверждено исследованием членов его семьи (Gandy и соавт. [21]).
Patten и соавт. [73] описали больного аутоиммунной гемолитической анемией, развившейся вследствие лечения альдометом. Больной имел фенотип Jk(a + ), аутоантитела анти-Jk a присутствовали как в сыворотке его крови, так и в элюатах с эритроцитов. Прекращение приема лекарства привело к постепенному
638
исчезновению аутоантител, клинические проявления гемолитической анемии также постепенно исчезали.
Аналогичный случай, сопровождавшийся острым гемолизом, описан у женщины Jk(a +b + ), принимавшей хлорпропамид с целью лечения сахарного диабета (Sosler и соавт. [98]). В сыворотке ее крови имелись антитела анти-Jk a, которые реагировали с эритроцитами Jk(a +b + ) в присутствии хлорпропамида или его аналогов. Гемолиз прекратился после отмены хлорпропамида. Не исключено, что субстанция Kidd, являясь транспортером азотистых шлаков, может иметь сродство к хлопропамиду, структура которого напоминает мочевину.
Аутоантитела анти-Jk a находили у здоровых лиц (Holmes и соавт. [32], Issitt и соавт. [40]). Четыре образца таких антител реагировали с эритроцитами в присутствии парабенов (бутилового, этилового, метилового и пропилового эфиров р-гидроксилбензоата) и других ароматических соединений (Judd и соавт. [41], Halima и соавт. [25]).
Judd и соавт. [41] высказали предположение, что парабены способны вызвать обратимые структурные изменения антигена Jk a, инициирующие образование аутоантител. Бензойные кольца парабенов взаимодействуют с аминокислотами гликопротеина Jk, при этом вовлеченными оказываются участки, формирующие эпитопы Jk a.
Описан больной Jk(a −b + ), перенесший нефрэктомию, с наличием хронической инфекции, вызванной протеем. У него имелся гемолиз, сыворотка содержала аутоантитела анти-Jk b. Эритроциты Jk(b −), инкубированные с Proteus mirabilis, приоб- реталиспособностьреагироватьсантителамианти-Jk b (McGinnisисоавт.[57]).
В последние годы получены моноклональные антитела анти-Jk a и анти-Jk b классаIgMиммортализациейиммунныхлимфоцитовсвирусомЭпштейна–Барр или гибридизацией их с клетками мышиной миеломы (Lecointre-Coatmelec и соавт. [44], Thompson и соавт. [101]). Полученные таким образом гетерогибридомы продуцировали агглютинирующие антитела анти-Jk a и анти-Jk.
Фенотип Jk(a −b −) и антиген Jk3
Нулевой фенотип Jk(a −b −), описанный в 1959 г. Pinkerton и соавт. [77],
был обнаружен у жительницы Филиппин испано-китайского происхождения, имевшей 2 детей. После гемотрансфузии у нее развилась желтуха. Сыворотка ее крови реагировала со всеми образцами эритроцитов, кроме собственных Jk(a −b −). Адсорбция сыворотки эритроцитами Jk(a −b + ) полностью устраняла активность антител, а адсорбция эритроцитами Jk(a +b −) – анти- Jk b-активность не полностью. Элюаты реагировали с эритроцитами Jk(a +b −) и Jk(a −b + ). Анализ результатов исследования позволил сделать вывод, что сыворотка женщины содержала антитела анти-Jk b и ранее неизвестные несепарируемые антитела анти-Jk ab, или анти-Jk3.
Фенотип Jk(a −b −) найден у жителей Полинезии (Irshaid и соавт. [36], Yokoyama и соавт. [111], Woodfield и соавт. [108], Kuczmarski и соавт. [43],
639
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Heaton, McLoughlin [28], Henry, Woodfield [29], Sidoux-Walter и соавт. [92]), Филиппин и Индонезии (Tills и соавт. [102], Marshall и соавт. [52], Pierse и соавт. [74]), китайцев (Lucien и соавт. [48], Day и соавт. [11]), японцев (Okubo и со-
авт. [67]), индусов (Tills и соавт. [102], Smart и соавт. [97]), бразильских индейцев (Tills и соавт. [102], Silber и соавт. [94]), американских негров (Oliver и соавт. [68]), жителей Туниса (Lucien и соавт. [47]), лиц белой расы, включая фин-
нов (Irshaid и соавт. [36], Sidoux-Walter и соавт. [92]), Sareneva и соавт. [91]),
французов (Habibi и соавт. [24]), швейцарцев и англичан (Irshaid и соавт. [35]). Многие лица Jk(a −b −) были обнаружены в связи с наличием у них анти-
тел анти-Jk3 (Yokoyama и соавт. [111], Arcara и соавт. [4], Habibi и соавт. [24], Irshaid и соавт. [35], Kuczmarski и соавт. [43], Pierse и соавт. [73], Day и соавт. [11], Sareneva и соавт. [91]).
Чаще всего фенотип Jk(a −b −) выявляли у жителей Полинезии. Из 173 000 полинезийских доноров 47 (0,27 %) имели фенотип Jk: −1, −2, −3 (Henry, Woodfield [29]). Чаще всего указанный фенотип встречался среди племен Ниуэа и Тонга (1,4 и 1,2 % соответственно). Для поиска лиц Jk: −1, −2, −3 в других этнических группах использовали скрининговый тест на лизис эритроцитов в растворе мочевины и подтверждающее серологическое исследование. Среди 638 460 японских доноров г. Осака 14 имели фенотип Jk: −1, −2, −3, при этом 12 (0,002 %) относились к рецессивному типу (Okubo и соавт. [67]). Скрининговые исследования среди 13 817 жителей провинции Наталь в ЮАР выявили одного индивида Jk: −1, −2, −3 индийского происхождения (Smart и соавт. [97]). Среди 52 908 англичан и 120 тыс. жителей Новой Зеландии, преимущественно европейского происхождения, фенотип Jk: −1, −2, −3 не был найден (Heaton, McLoughlin [28], McDougall и соавт. [56]). Данная редкая группа была обнару-
жена у 24 (0,03 %) из 79 349 финнов (Sareneva и соавт. [91]).
Необычное наследование генов Jk a и Jk b, свидетельствующее о существовании молчащего аллеля Jk, наблюдали в семье американцев, в которой был найден фенотип Lunull (Crawford и соавт. [8]), а также в афроамериканской семье
(Behzad и соавт. [5]).
Установлено, что к возникновению фенотипа Jk: −1, −2, −3 может приводить гомозиготность по 5 различным мутациям (табл. 11.3):
––у жителей Полинезии идентифицирована мутация G → A в инвариантном 3ʹ-акцепторном участке сплайсинга в интроне 5 аллеля Jk a. Последняя приводила к утрате экзона 6 в иРНК-транскриптах (Lucien и соавт. [48], Irshaid и соавт. [36]). Из 46 жителей Полинезии 8 были гетерозиготными по данной мутации. Аналогичная мутация выявлена также у китайцев, австралийцев, американцев и европейцев, имевших фе-
нотип Jk(a −b −) (Sidoux-Walter и соавт. [92]);
––точковая мутация найдена у финнов: перемещение T 871 C в аллеле Jk b приводило к аминокислотной замене Ser 291 Pro (Irshaid и соавт. [36], Sidoux-Walter и соавт. [92]);
640
