
6 курс / Клинические и лабораторные анализы / Группы крови человека
.pdfхлорамфениколацетилтрансферазу (ХАТ). В клетках, подвергнутых трансфекции, отметили высокий уровень ХАТ-активности. Трансфекция клеток фрагментами ДНК, содержавшими Fy-специфическую T 33 C GATA-мутацию, не приводила к появлению ХАТ-активности в эритроидных клетках, однако в клетках эндотелиальной линии ее наблюдали.
Из 1062 обследованных жителей Папуа – Новой Гвинеи 23 оказались гетерозиготными по Fy a-специфической последовательности Gly 42 и GATA-мутации, типичной для аллеля Fy. Частота аллеля составила 0,022 (Zimmerman и соавт. [184]). По-видимому, указанный аллель ведет себя как молчащий в отношении эритроидных клеток, поскольку эритроциты таких лиц имеют слабую экспрессию антигена Fy6 по сравнению с эритроцитами гомозигот Fy a / Fy a.
Фенотип Fy(a −b −), типичный для негроидов, встречается крайне редко среди представителей других рас и этнических групп (Mourant и соавт. [118]). Он не был найден среди 6 тыс. белых жителей Австралии при их обследовании с помощью сыворотки анти-Fy3 (Albrey и соавт. [10]).
Chown и соавт. [35], Lewis и соавт. [92] рассчитали, что частота гена Fy среди лиц белой расы составляет около 0,001; ожидаемая частота фенотипа Fy(a −b −) – 1 на 1 млн. В нескольких семьях выявлено необычное наследование генов Fy a и Fy b, обусловленное, как полагают Chown и соавт. [35], присутствием аллеля Fy x.
Людей Fy(a −b −) среди европеоидов и монголоидов обычно идентифицировали в связи с обнаружением в сыворотках их крови активных антител антиFy3. У одной из австралийских женщин Fy(a −b −) имелась делеция 14 пар кодонов гена FY (Albrey и соавт. [10]), которая изменяла рамку считывания и приводила к прекращению трансляции (Mallinson и соавт. [99]). Молекулярногенетические методы исследования позволили выявить у 3 неродственных лиц гомозиготность по нонсенс-мутациям, приведшим к формированию фенотипа
Fy(a −b −):
––G 408A(Trp 136 Stop) в гене Fy a у англичанки (Rios и соавт. [139]);
––G407A(Trp96Stop)вгенеFy b уливанскойеврейки(Riosисоавт.[139]);
––G 287A(Trp 136 Stop) в гене Fy a у индианки из Канады (Buchanan [23], Rios и соавт. [139]).
Tsuneyama и соавт. [165] наблюдали японку Fy(a −b −), без антител, имевшую делецию С327, которая приводила к остановке считывания 12 кодонов ниже 120-го.
Каждая из мутаций, описанных выше, проявляла себя отсутствием экспрессии антигенов Duffy на эритроцитах в отличие от GATA-мутаций, способствующих формированию африканского варианта фенотипа Fy(a −b −), при котором Duffy-гликопротеины экспрессированы на неэритроидных клетках.
Фенотип Fy(a −b −) без антител анти-Fy3 описан у чешских цыганок (Libich и соавт. [94], Pisacka и соавт. [134]), белой женщины шотландско-швейцарского происхождения, имевшей GATA-мутацию, характерную для негроидов.
611
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Гликопротеин Fy и ген Fy
Moore и соавт. [115], используя методы иммунопреципитации, установили, что антиген Fy a присутствует на 3 протеинах, имеющих мол. массу 39, 64 и 85 кДа. Иммуноблоттинг с антителами анти-Fy a позволил выявить структу-
ры с мол. массой 35 – 43 (Hadley и соавт. [60]) и 40–50 кДа (Tanner и соавт. [156]). Субстрат, выделенный электроэлюцией из протеинов 35–43 кДа, ингибировал антитела анти-Fy a [60]. Аналогичные результаты получили Nichols и соавт. [124], Riwom и соавт. [140], использовавшие иммуноблоттинг с моноклональными антителами анти-Fy6.
Обработка эритроцитов эндо-F-гликаназой, N-гликаназой и сиалидазой снижала мол. массу выделяемых с помощью иммуноблоттинга Fy-гликопротеинов до 4 кДа (Hadley и соавт. [60], Tanner и соавт. [156]).
Riwom и соавт. [140] и Wasniowska и соавт. [172] выделили низкомолекулярные фракции из очищенных Fy-гликопротеинов и третичных структур, полученных из них. Указанные исследования свидетельствовали о том, что Fyгликопротеины N-гликозилированны и слабо О-гликозилированы. Разная степень N-гликозилирования, вероятно, и обусловливает колебания мол. массы Fyгликопротеинов в широком диапазоне (Chaudhuri и соавт. [30]).
Chaudhury и соавт. [30] посредством иммунопреципитации моноклональными антителами анти-Fy6 выделили Fy-гликопротеин с мол. массой 36–43 кДа вместе с олигомерами большей мол. массы, последние также реагировали с указанными антителами. Другие из сопутствующих протеинов не реагировали в реакции иммунного окрашивания с антителами анти-Fy6. Картирование пептидов, выделенных из эритроцитов Fy(a +b −) и Fy(a −b + ), существенных различий не выявило (рис. 10.2).
MGNCLHRAEL SPSTENSSQL DFEDVWNSSY GVNDSFPDGD YDANLEAAAP 50 CHSCNLLDDS ALPFFILTSV LGILASSTVL FMLFRPLFRW QLCPGWPVLA 100 QLAVGSALFS IVVPVLAPGL GSTRSSALCS LGYCVWYGSA FAQALLLGCH 150 ASLGHRLGAG QVPGLTLGLT VGIWCVAALL TLPVTLASGA SGGLTCLIYS 200 TELKALQATH TVACLAIFVL LPLGLFGAKG LKKALGMGPG PWMNILWAWF 250
IFWWPHGVVL |
GLDFLVRSKL |
LLLSTCLAQQ |
ALDLLLNLAE ALAILHCVAT |
300 |
PLLLALFCHQ |
ATRTLLPSLP |
LPEGWSSHLD |
TLGSKS |
336 |
Рис. 10.2. Аминокислотная последовательность Fy-гликопротеина.
Chaudhury и соавт. [28], изучив последовательность аминокислот в очищенных Duffy-гликопротеинах, сконструировали олигонуклеотидные праймеры и с помощью ПЦР изменили кодирующий участок ДНК, полученной от лиц Fy(a −b + ). Затем этот продукт был использован для выделения кодирующей ДНК из библиотеки ДНК костномозговых клеток человека. В результате исследования получен пептид из 338 аминокислот с мол. массой 35,7 кДа (рис. 10.3).
Neote и соавт. [123] установили, что Fy-гликопротеин структурирован в виде α-спиралей, 7 раз пересекающих мембрану эритроцитов, имеет
612
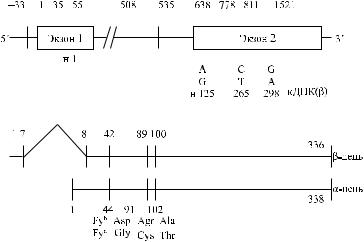
Рис. 10.3. Генетическая карта локуса Fy.
экстрацеллюлярный N- и цитоплазматический С-домены (см. рис. 10.1). Такое строение свойственно хемокиновым рецепторам (Ji и соавт. [81], Murdoch, Finn [120]). Экстрацеллюлярный домен, состоящий из 65 аминокислот, имеет 3 участка N-гликозилирования – позиции 16, 27 и 33. Антитела анти-Fy6 реагировали с синтетическим пептидом, представляющим собой фрагмент N-терминального домена Fy-гликопротеина.
Первая из полученных образцов Duffy кДНК была представлена одним эк-
зоном (Chaudhuri и соавт. [29], Iwamoto и соавт. [79], Tournamille и соавт. [160]).
Позднее Iwamoto и соавт. [77] показали, что в неэритроидных тканях преобладают транскрипты, состоящие из двух экзонов, разделенных 479 парами кодонов. Первый экзон кодирует семь N-терминальных аминокислот Fyгликопротеина, включая инициирующий трансляцию метиониновый кодон. Терминальный участок молекул Fy-гликопротеина представлен последователь-
ностью MGNCLHRAEL(Iwamoto и соавт. [77]).
В регионе 5' гена FY нет TATA- и CAAT-боксов, однако имеется несколько участков SP1 и GATA, препятствующих транскрипции (Iwamoto и соавт. [79], Tournamille и соавт. [160]).
Генотипирование
Установление нуклеотидных замен, обусловливающих специфичность Fy a, Fy b и Fy, позволило проводить генотипирование плодов беременных, сенсибилизированных к антигену Fy a, с целью оценки риска ГБН (Goodrick и соавт. [55]). Нуклеотидная замена G 159 A, определяющая различия Fy a / Fy b, создает сайт рестрикции BanI в аллеле Fy a, а замена T 67 C – сайт StyI, определяющий различия Fy / Fy ab аллеля Fy (Iwamoto и соавт. [78], Tournamille и соавт. [160]).
Генотип устанавливают с помощью ПЦР с использованием аллельспецифических праймеров С 67 (Fy), Т 67 (Fy a или Fy b), G 159 (Fy a), А 159 (Fy b или Fy)
613
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
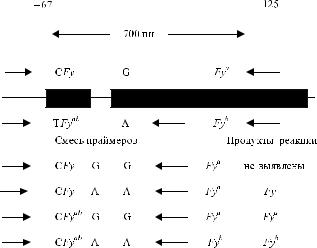
(рис. 10.4) (Hessner и соавт. [69], Mullighan и соавт. [119], Olsson и соавт. [127]).
Использование комбинаций пар праймеров позволяет усилить продукты реакции и проследить последовательности кодонов (см. табл. 10.4).
Рис. 10.4. Принцип Duffy-генотипирования с
использованием ПЦР и аллельспецифических праймеров C ← Fya,A→ Fyab и G ← Fya,A← Fyb.
Больные серповидно-клеточной анемией, систематически получающие гемотрансфузии, часто образуют антитела к различным аллоантигенам эритроцитов, в том числе антигенам Duffy. Генотипирование доноров и реципиентов облегчает процесс подбора совместимых пар по указанной системе. Люди Fy(a +b −) отличаются по способности вырабатывать клинически значимые анти- Fy b-антитела, которые могут вырабатываться только у лиц с генотипом Fy a / Fy a, но не Fy a / Fy, поскольку аллель Fy кодирует синтез Fy b-гликопротеина в неэритроидных клетках. Таким образом, иммунная система лиц Fy a / Fy не воспринимает антиген Fy b как чужеродный.
Другие антигены Fy и антитела к ним
Fy3
Антиген Fy3 присутствует на эритроцитах всех людей, за исключением Fy(a −b −). Он широко распространен среди европеоидов и монголоидов, но встречается редко среди жителей некоторых регионов Западной Африки. В отличие от факторов Fy a и Fy b, антиген Fy3 устойчив к действию протеоли-
тических ферментов (Albrey et al [10], Buchanan и соавт. [23], Daniels [42], Mannessier и соавт. [100], Oberdorfer и соавт. [126]). Эритроциты приматов содержат антиген Fy3, а антигены Fy a и Fy b на них отсутствуют (Tippett, Gavin [157])
614
Антитела анти-Fy3 впервые обнаруженыAlbrey и соавт. [10] у австралийки Fy(a −b −), имевшей 3 беременности и получавшей гемотрансфузии. Антитела реагировали одинаково интенсивно с эритроцитами Fy(a +b −), Fy(a +b + ) и Fy(a −b + ), не разделялись на анти-Fy a и анти-Fy b дифференциальной адсорбцией. Четыре других найденных образца антител анти-Fy3 реагировали несколько интенсивнее с эритроцитами, содержавшими антиген Fy a (Mannessier
и соавт. [100]).
Антитела анти-Fy3 редко вырабатываются у негроидов, хотя имеются сообщения о выявлении у них нескольких таких образцов (Jensen и соавт. [80], Kosinski и соавт. [85], Molthan, Crawford [114], Oakes и соавт. [125], Oberdorfer
исоавт. [126], Sosler и соавт. [150]). Гораздо чаще у негроидов Fy(a −b −), получавших многократные гемотрансфузии, выявляли антитела анти-Fy a. Тем не менее, антитела Duffy встречаются редко и среди этой категории реципиентов. Так, скрининг сывороток 566 реципиентов-негроидов Fy(a −b −) во Франции ни в одном случае не выявил антител системы Duffy (LePennec и соавт. [89]).
Негроиды Fy(a −b −) гомозиготны по аллелю Fy и мутации в GATA-1 для эритроидных клеток. И хотя их эритроциты имеют фенотип Fy:–3, другие клетки экспрессируют гликопротеины Duffy (Peiper и соавт. [132]). Независимо от мутации в GATA-1 структура генов Fy b и Fy гомологична, поэтому гомозиготы Fy / Fy экспрессируют антигены Fy b и Fy3 в неэритроидных тканях. Это позволяет объяснить редкость антител анти-Fy3, а также анти-Fy b среди негроидов Fy(a −b −). В то же время они способны вырабатывать антитела анти-Fy a. Молекулярная структура фенотипа Fy(a −b −) негроидов, выработавших антитела анти-Fy3, отличается от таковой у негроидов Fy / Fy, не содержащих указанных антител. Более того, антитела анти-Fy3, образовавшиеся у негроидов Fy(a −b −) респондеров, способны улавливать различия в Duffy-гликопротеинах, экспрессированных на разных образцах эритроцитов и неэритроидных клеток.
Антитела анти-Fy3, полученные от негроидов, реагируют слабо или вовсе не реагируют с эритроцитами новорожденных (Kosinski и соавт. [85], Molthan, Crawford [114], Oakes и соавт. [125]), а антитела той же специфичности от лиц других рас реагируют с эритроцитами взрослых и новорожденных одинаково интенсивно (Buchanan и соавт. [23], Mannessier и соавт. [100]). Антигены Duffy
присутствуют на эндотелиальных клетках.
Описаны немедленные и отсроченные гемолитические трансфузионные ре-
акции (Mannessier и соавт. [100], Olteanu и соавт. [129], Vengelen-Tyler [168]), а также случаи легкой ГБН (Kosinski и соавт. [85], Molthan, Crawford [114], Oakes
исоавт. [125]), обусловленные анти-Fy3-антителами. ГБН купировали фототе-
рапией (Albrey и соавт. [10], Buchanan и соавт. [23]).
Мышиные моноклональные антитела анти-Fy3 в серологических реакциях проявляли себя так же, как и поликлональные аллогенные.
Исследования клеток насекомых, подвергнутых трансфекции кДНК, кодирующей гибридные молекулы Fy-гликопротеина и интерлейкина 8, показали, что
615
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
моноклональные антитела анти-Fy3 распознают эпитопы, расположенные на 3-й экстрацеллюлярной петле Fy-гликопротеина (Lu и соавт. [96]). Аллогенные поликлональные антитела анти-Fy3 выявляют эпитопы более чем одного региона молекулы Fy-гликопротеина.
МКА Анти-Fy3 часто используют для быстрого поиска доноров Fy(a −b −) среди доноров негров. Потребность в многократных трансфузиях таких эритроцитов весьма велика при лечении негров, страдающих серповидно-клеточной анемией (Sandler и соавт. [143]).
Fy4
После того как Sanger и соавт. [144] обосновали возможность существования молчащего аллеля Fy, обусловливающего высокую частоту фенотипа Fy(a −b −) среди негроидов, были предприняты безуспешные попытки найти антитела анти-Fy или анти-Fy с у реципиентов белой расы, получавших трансфузии крови от доноров негров. В 1973 г. Bezhad и соавт. [19] описали антитела, найденные у негритянки Fy(a +b + ), страдавшей серповидно-клеточной анемией и получившей множество трансфузий. По характеру реагирования антитела приближались к предсказанным анти-Fy с-антителам, но это не были антитела анти- Fy с-специфичности. Они были обозначены анти-Fy4. Реакция антител усиливалась после обработки эритроцитов папаином [19].
Исследования, проведенные с анти-Fy4-антителами в 3 лабораториях, внесли сомнения относительно принадлежности анти-Fy4-антител к системе Duffy. В частности эритроциты, лишенные Fy-гликопротеина, давали с анти-Fy4- антителами слабоположительные реакции (Behzad и соавт. [19], Buchanan и соавт. [23]). Не удалось провести генетических посемейных исследований. Единственный образец антител анти-Fy4 оказался нестабильным при хранении, в связи с чем исследования в этом направлении стали невозможными (Reid, Lomas-Francis [138]).
Fy5
Антиген Fy5 близок по серологическим свойствам антигену Fy3, но отличается от последнего тем, что отсутствует у лиц Rhnull (Daniels [43], Issitt, Anstee [76], Reid, Lomas-Francis [138], Westhoff, Reid [178]). Он слабо экспрессирован на эритроцитах –D–/–D–, однако присутствует на эритроцитах лиц Fy(a −b −), не относящихся к негроидам (табл. 10.5). Подобно антигену Fy3 антиген Fy5 устойчив к действию протеолитических ферментов и присутствует в одинаковой степени на эритроцитах взрослых и новорожденных (Colledge и соавт. [36], DiNapoli и соавт. [49]).
Характер реагирования анти-Fy5-антител позволяет полагать, что они взаимодействуют со структурами, интегрированными с Rh-протеинами и Rhассоциированными гликопротеинами (RhAG).
616
Таблица 10.5
Характер реагирования антител анти-Fy3, анти-Fy5 и анти-Fy6
Эритроциты |
Реакция с антителами |
|||
|
|
|
||
анти-Fy3 |
анти-Fy5 |
анти-Fy6 |
||
|
||||
|
|
|
|
|
Fy(a +b −) |
+ |
+ |
+ |
|
|
|
|
|
|
Fy(a +b + ) |
+ |
+ |
+ |
|
|
|
|
|
|
Fy(a −b + ) |
+ |
+ |
+ |
|
|
|
|
|
|
Fy(a −b −) негров |
– |
– |
– |
|
|
|
|
|
|
Fy(a −b −) европейцев |
– |
+ |
нд |
|
|
|
|
|
|
Fy(a −b + w), (Fy x / Fy x) |
сл |
сл |
сл |
|
Rhnull |
+ |
– |
+ |
|
−D− |
+ |
сл |
+ |
|
|
|
|
|
|
Энзимированные |
+ |
+ |
– |
|
|
|
|
|
|
« + » – положительная, « – » – отрицательная, сл – слабовыраженная реакция, нд – нет данных.
Найдено по меньшей мере 6 образцов антител указанной специфичности – все у реципиентов черной расы с фенотипом Fy(a −b −), главным образом у больных серповидно-клеточной анемией, получавших гемотрансфузии (Bowen и со-
авт. [21], Chan-Shu [26], Colledge и соавт. [36], DiNapoli и соавт. [49], VengelenTyler [168]). Во всех случаях сыворотки сенсибилизированных содержали смесь антител анти-Fy5 и анти-Fy a (Vengelen-Tyler [168]). Антитела анти-Fy5 не удается разделить методами адсорбции. Эритроциты некоторых лиц с парциальными антигенами Rh слабо реагировали с анти-Fy5-антителами, еще раз подтверждая положение о том, что антигены Duffy имеют некоторую связь с антигенами резус (Meredith [104]). Эритроциты лиц, гомозиготных по гену Fy x, также несут слабый антиген Fy5 (Marsh [101]).
Антитела анти-Fy5 описаны как причина замедленных гемолитических посттрансфузионных реакций (Bowen [21], Chan-Shu [26], Vengelen-Tyler [168]).
У одного больного описаны 2 трансфузионные реакции, одна из которых была обусловлена антителами анти-Fy a, другая – анти-Fy5 (Bowen [21]).
Fy6
Nichols и соавт. [124], Riwom и соавт. [140] получили 2 образца мышиных моноклональных антител против часто встречающегося антигена, напоминавшего Fy3. Однако в отличие от антигена Fy3, открываемый полученными антителами антиген разрушался после обработки папаином, фицином и химотрипсином. Антиген получил обозначение Fy6, соответствующие антитела – анти-Fy6.
Антитела анти-Fy6 аллогенного происхождения не найдены (Daniels [43]).
617
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Оба образца упомянутых моноклональных антител распознавали линейные эпитопы, представленные аминокислотными остатками QLDFEDV в позициях 19–25 на N-терминальном экстрацеллюлярном домене Fy-гликопротеина (Wasniowska и соавт. [170, 173, 174]). Удалось выделить Fy-гликопротеин, напоминавший структуру, делающую возможной инвазию эритроцитов малярийны-
ми паразитами Plasmodium vivax (Chaudhuri и соавт. [30], Riwom и соавт. [140]).
Антиген Fy6 присутствует на эритроцитах низших обезьян.
Онтогенез, распределение в тканях
Антигены Fy a и Fy b появляются на 6–7-й неделе эмбрионального развития (Toivanen и соавт. [158, 159]), выраженность их такая же, как на эритроцитах взрослых, и остается неизменной на протяжении всего периода внутриутробного развития плода.
Противоречивые результаты получены при изучении сроков появления антигена Fy6. В одних исследованиях появление указанного лиганда констатировалось в одинаковые сроки с появлением гликопротеинов Lutheran, т. е. на 2–3-й мес. внутриутробного развития, в других – приблизительно в одно и то же время с формированием гликофоринов С (Bony и соавт. [20], Daniels, Green [44], Southcott и соавт. [151]).
Эритроциты Fy(a +b −) и Fy(a −b + ) несут по 13 000–14 000 антигенных участков Fy a и Fy b на одну клетку. Количество антигенных участков Fy a и Fy b на эритроцитах
Fy(a +b + ) вдвое меньше – по 6000–7000 (Masouredis и соавт. [103]). После обработки эритроцитовпапаиномчислоантигенныхучастковредуцируетсяболеечемна85 %.
Nichols и соавт. [124], Riwom и соавт. [140] с помощью радиоиммунного метода, используя моноклональные антитела анти-Fy6, обнаружили на одном эритроците от 6000 до 12 200 участков антигена Fy6.
Уровень экспрессии антигена Fy6 на 50 % выше на ретикулоцитах, чем на зрелых эритроцитах (Woolley и соавт. [181, 182]).
Помимо эритроцитов антиген Fy6 выявлен на клетках эндотелия посткапиллярных венул во всех органах, за исключением печени (Chaudhuri и соавт. [27], Hadley и соавт. [61]), а также на волокнах Пуркинье нейронов (Horuk и соавт. [72]). Анализ кодирующих последовательностей ДНК подтвердил, что почечные и эритроидные изоформы Duffy-гликопротеинов практически идентичны. Небольшие различия в их мол. массе, вероятно, обусловлены неодинаковым гликозилированием (Chaudhuri и соавт. [27], Hadley [62], Neote и соавт. [123]).
Duffy-гликопротеины выявлены с помощью кроличьих антител в эпителии почечных канальцев и альвеол (Chaudhuri и соавт. [27]), а также в неэритроид-
ных тканях негров Fy(a −b −) (Peiper [132]).
РНК-транскриптыгенаFY быливыявленыметодомгибридизациивкостноммозге лиц фенотипов Fy(a +b −), Fy(a +b) и Fy(a −b + ), но не Fy(a −b −) (Chaudhuri и соавт. [28, 29]).Этитранскриптыобнаруживаливтканяхлегких,мышц,селезенки,толстойкишки, сердца, поджелудочной железы, почек и головного мозга (Chaudhuri и соавт. [29],
618
Hadleyисоавт.[61],Neoteисоавт.[123]),атакжевтканяхоргановнегроидовсфенотипом Fy(a −b −) (Chaudhuri и соавт. [29]). Хотя величина большинства транскриптов составляла 1,35 кб, LeVan Kim и соавт. [86] установили, что в тканях головного мозга преобладали транскрипты величиной 7,5 кб. Два вида транскриптов различались междусобойвобластинетранслируемого5ʹ-региона,однакокодировалисинтезодно- го и того же пептида. Тем не менее, Neote и соавт. [123] сообщили, что в головном мозгеплодатранскриптыимеливеличину8,5кб,аувзрослых–размером1,35кб.
Антигены Fy a и Fy b не выявлены на лимфоцитах, моноцитах, нейтрофилах и тромбоцитах (Dunstan и соавт. [50, 51]).
Гликопротеины Duffy как хемокиновые рецепторы
Гликопротеины Duffy способны связываться с хемокинами, относящимися к факторам воспаления и хемотаксиса, поэтому их нередко обозначают как DARC (Duffy antigen receptor chemokine). Хемокины участвуют во многих межклеточных взаимодействиях, в том числе в активации лейкоцитов (Rollins [141]). Существует 3большихклассахемокинов:С-Х-С,С-СиС,обозначенныхтаквсвязиспозицией цистеинового остатка в N-терминальном участке пептида. Большинство хемокиновыхрецепторовэритроцитовпредставленосемействоминтегральныхгликопротеи- нов.ТрансмембранныегликопротеиныG-типапредставляютгруппупротеинсвязы- вающихрецепторов(Jiисоавт.[81],Murdoch,Finn[120]),воcпринимающихэкстрацеллюлярныесигналычерезферомоны,нейромедиаторыигормоны.Хемокиновые рецепторыспецифичныкодномуилинесколькимгликопептидам.
Duffy-гликопротеины связываются с хемокинами C-X-C и С-С (Darbonne и соавт. [45], Horuk и соавт. [71], Neote и соавт. [122]). Некоторые хемокины C-X-C идентифицированы как интерлейкины-8 и факторы стимуляции роста меланомы (MGSA). Хемокины С-С участвуют в формировании рецепторов Т-клеток и продукции факторов хемотаксиса для моноцитов (RANTES, MCP- 1). Гликопротеин Duffy не содержит рецепторов для хемокина С – фактора хемотаксиса лимфоцитов (Szabo и соавт. [153]). В отличие от других протеинов G-типа, в структуре Duffy-гликопротеина нет мотива Asp-Arg-Tyr (DRY) во втором цитоплазматическом домене, последний взаимодействует с протеином, связывающим гуанозинтрифосфат (Hadley, Peiper [63]).
Эритроциты лиц Fy(a −b −) не обладают способностью связывать хемокины
(Horuk и соавт. [70], Tournamille и соавт. [162]), а эритроциты Fy(a −b + w) связы-
вают некоторое количество указанных субстанций (Tournamille и соавт. [162], Zimmerman и соавт. [184]).
Хемокиновые рецепторы располагаются на второй и четвертой экстрацеллюлярной петле Duffy-гликопротеина вблизи одной из дисульфидных связей
(Tournamille и соавт. [161, 163]).
Антитела к антигенам Fy a, Fy b и Fy6, связывающиеся с соответствующими эпитопами Duffy-гликопротеина, и моноклональные антитела анти-Fy3 способны блокировать хемокины (Chaundhury и соавт. [31], Hausman и соавт. [67], Horuk и
619
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
соавт. [70], Lu и соавт. [96], Szabo и соавт. [153],Tournamille и соавт. [163]).
Интерлейкин-8 связывается с эритроцитами, обработанными трипсином, сиалидазой, N-гликаназой, но не связывается с эритроцитами, обработанными папаином и α-химотрипсином (Wasniowska и соавт. [171]). Два последних фермента расщепляют N-терминальный домен Duffy-гликопротеина.
Физиологические функции Duffy-гликопротеинов до конца не ясны. Высказывались предположения, что Duffy-гликопротеины эритроцитов адсорбируют избыточное количество воспалительных хемокинов (Darbonne и соавт. [45])
иинтерлейкина-8, содержание которого повышается в плазме крови при инфаркте миокарда (de Winter и соавт. [47]). Однако в действительности эта функция эритроцитов вряд ли имеет столь существенное значение, поскольку у многих людей, особенно у негроидов, Duffy-гликопротеины на эритроцитах отсутствуют.
Как уже отмечалось выше, Duffy-гликопротеины содержатся и в неэритроидных клетках, в том числе у лиц Fy(a −b −), включая негроидов. Почечная изоформа Duffy-гликопротеина связывала хемокины в той же степени, что и эритроцитарная (Hadley и соавт. [61]).
HadleyиPeiper[63]полагают,чтовысокаяконсервативностьгенаFY,проявляющаяся в разных тканях, свидетельствует о важной роли Duffy-гликопротеинов в физиологии человека.
Клетки эритроидной линии K562, подвергнутые трансфекции кодирующей ДНК гена FY, связывали хемокины (Peiper и соавт. [132]). Duffy-гликопротеин присутствовал как трансмембранный структурный элемент в эндотелиальных клетках (Chaudhuri и соавт. [27]). Он может принимать участие в эндоцитозе,
ивозможно при этом инициирует синтез факторов хемотаксиса, вызывающих миграцию лейкоцитов (Hadley, Peiper [63], Lee и соавт. [87]). Существенное повышение содержания Duffy-гликопротеина отмечено в тканях почек ВИЧинфицированных лиц, а также больных уремией с гемолитическим синдромом. Последнее дает основание полагать, что Duffy-гликопротеины могут играть определенную роль в патогенезе воспалительных процессов в почечной ткани (Lu и соавт. [95]).
Гены, гомологичные генам FY человека, обнаружены у обезьян, коров, сви-
ней, кроликов и мышей (Chaudhuri и соавт. [29], Hadley, Peiper [63], Luo и соавт. [97]). Эритроциты мышей связывали хемокины мыши и человека (Szymanski
исоавт. [154]) так же, как и клетки эритроидной линии K562, подвергнутые трансфекции кДНК Dfy – мышиным гомологом гена FY человека (Luo и соавт. [97]). Мыши, дефицитные по гену Dfy, были соматически здоровы и их реакция на инъекцию воспалительных хемокинов не отличалась от таковой у обычных животных (Dawson и соавт. [46], Luo и соавт. [98]).
Некоторые лица Fy(a −b −), гомозиготные по мутации, инактивирующей ген FY, соматически здоровы, несмотря на полное отсутствие в их тканях Duffyгликопротеинов. Вероятно, при отсутствии Duffy-гликопротеинов их биологическую функцию могут выполнять другие структуры (Daniels [43]).
620
