
6 курс / Клинические и лабораторные анализы / Группы крови человека
.pdfАутоантитела со специфичностью анти-Kp b обнаружили Manny и соавт. [257] у больной, в эритроцитах которой не содержалось антигена Kp b. Ее фенотип соответствовал k Kp(a +b −) Js b. Антигены k и Js b на эритроцитах больной были слабо выражены, антиген Kp a имел сильную экспрессию. Прямая проба Кумбса была положительная. Элюаты, снятые с эритроцитов, содержали Kp b-антитела. Клинические симптомы разрушения собственных эритроцитов in vivo отсутствовали. Перелитые донорские эритроциты Kp(b + ), меченные Cr51, выживали нормально. Через 9 мес. анти-Kp b-антитела у пациентки исчезли, прямая проба Кумбса с эритроцитами стала отрицательной, восстановилась нормальная экспрессия антигенов k и Js b, характерная для фенотипа Kp(a +b −). После выздоровления эритроциты больной утратили способность реагировать с собственной сывороткой, оставленной от первого исследования и сохраненной в замороженном состоянии. Авторы предположили, что причиной аутоиммунизации послужил Kp b-подобный антиген микробного происхождения, который адсорбировался на эритроцитах и стимулировал образование аутоантител.
Brendel и соавт. [112] нашли аутологичные анти-Kp b-антитела у больной, перенесшей операцию. У больной наблюдали слабоположительную прямую антиглобулиновую пробу и одновременно сниженную экспрессию антигенов k, Kp b и Js b. Данные о том, что аутоантитела оказывали какое-либо патологическое действие in vivo, отсутствовали. Донорские эритроциты, перелитые женщине, так же как и в наблюдении Vengelen-Tyler и соавт. [380], утрачивали выраженность Kell-антигенов. Через 2 недели лечения экспрессия антигенов k, Kp b и Js b на эритроцитах больной восстановилась, аутоантитела исчезли. Этот факт, а также то, что пациентка имела бактериальную инфекцию, позволили предположить, что ослабление экспрессии Kell-антигенов могло быть обусловлено септицемией. К такому же заключению пришли Beck и соавт. [101] и Marsh и соавт. [265], полагая, что антигены Kell деградируют под действием ферментов, выделяемых микобактериями, и становятся мишенями для аутоагрессии.
Issitt и соавт. [206] обратили внимание на то, что аутоантитела к антигенам Kell чаще выявляют у пациентов, перенесших черепно-мозговые травмы. Авторы высказывают предположение, что эта связь не случайна. Поврежденная ткань мозга несет на себе, вероятно, иммуногенную Kell-подобную субстанцию, которая при контакте с макрофагами и иммуноцитами вызывает появление аутоантител против антигенов Kell.
Ауто-Jsb-антитела
Eveland [162] описал ауто-Js b-антитела у больных хронической почечной недостаточностью, имевших фенотип Js(a −b + ). Аутоантитела слабо реагировали в прямой антиглобулиновой пробе, но хорошо – в пробе с полиэтиленгликолем.
381
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Мимикрирующие ауто-K-антитела
Некоторые аутоантитела со специфичностью анти-K содержат фракции, способные реагировать одновременно с эритроцитами K −. Такие аутоантитела относят к мимикрирующим анти-K.
Описанные в литературе мимикрирующие Kell-антитела в отличие от типичных аутоиммунных не ассоциированы со слабой экспрессией антигенов
Kell [171, 192, 381].
Hare и соавт. [192] описали пациента K −, имевшего почти нормальную экспрессию антигенов k, Kp b и Js b. На его эритроцитах и в сыворотке авторы выявляли антитела, которые по серологическим параметрам характеризовались как анти-K. В то же время элюат с эритроцитов адсорбировался до истощения эритроцитами K −, чтоуказывалонаприсутствиеантител,мимикрирующихподанти-K.
Garratty и соавт. [171] наблюдали K-отрицательного пациента, имевшего аутоантитела анти-K, которые так же, как и в упомянутом выше случае, могли быть адсорбированы эритроцитами K + и K −. Элюаты, снятые с эритроцитов, проявляли двойную реактивность.
Случай с наличием мимикрирующих анти-K-антител привели Viggiano и соавт. [381]. K-отрицательный пациент, у которого они образовались, имел положительную прямую пробу Кумбса, но никаких клинических признаков гемолитической анемии у него не отмечали. Элюат с эритроцитов содержал антитела анти-K, которые одинаково адсорбировались эритроцитами K + и K −.
Как указывают Issitt и Anstee [204], мимикрирующие антитела не являются редкостью и встречаются в других антигенных системах. Issitt и Pavone [208] нашли аутоантитела, мимикрирующие под анти-Rh.
Анти-K-антитела и микробные инфекции
Marsh и соавт. [264] наблюдали 20-дневного ребенка с энтероколитом, вызванным необычным вариантом Bac. Escherichia coli. Ребенок имел группу крови B(III), в сыворотке содержались антитела анти-А IgM и анти-K IgM. Контакта с эритроцитами K + у ребенка не было, его мать антител анти-K не имела. Когда ребенок выздоровел и указанные бактерии больше не высевались, антитела анти-А и анти-K исчезли. Авторы показали, что препараты из выделенных ими бактерий Escherichia coli, нейтрализовали антитела анти-K IgM, а на самих бактериальных клетках обнаруживали K-антиген.
Других патогенных форм кишечной палочки не было выделено из кала детей, содержащих антитела анти-K и имеющих клинические симптомы септицемии [217].
Pereira и соавт. [309] обнаружили антитела анти-k (Cellano) у пациента с инфекцией, вызванной Morganella morganii. Антитела относились исключительно к классу IgA. Авторы высказали суждение, что ранее описанные в литературе естественные анти-K-антитела, диагностированные как IgM только с помощью редуцентов дисульфидных связей, на самом деле могли относиться к IgA.
382
Анти-K-антитела нетрансфузионного происхождения наблюдали у пациентов, зараженных:
Mycobacterium tuberculosis (Tegoli и соавт. [368], Kanel и соавт. [221]);
Esсherichia coli (Marsh и соавт. [264]);
Enterococcus faecalis (Doelman и соавт. [156]);
Morganella morganii (Pereira и соавт. [309]);
неидентифицированными микроорганизмами, вызвавшими септицемию
(Judd и соавт. [217]);
вирусами, вызвавшими ОРВИ.
Savalonis и соавт. [340] не нашли Kell-антигенов у 23 типов исследованных ими бактерий из рода Сitrobacter, Edwardsiella, Escherichia, Klebsiella, Proteus, Salmonella, Serratia, Shigella. K-подобное вещество содержалось, по-видимому, только в Esсherichia coli штамма О125:В15, высеянного Marsh и соавт. [264] из кала упомянутого выше больного ребенка.
McGinniss и соавт. [278] показали, что эритроциты K −, инкубированные in vitro с разрушенными микроорганизмами Streptococcus faecium, приобретали K-подобный антиген. Трансформации K − в K + не происходило, когда использовали целые бактерии.
Следует упомянуть, что аутоантитела анти-Kp b, описанные Manny и соавт. [257] и Brendel и соавт. [112], также были обнаружены авторами у пациентов, перенесших инфекции.
Несмотря на очевидную связь анти-K-антител с бактериальным заражением, описаны люди с анти-K-антителами, у которых не было никаких проявле-
ний инфекций (Morgan, Bossom [287], Clark и соавт. [130].
Генетика
Гены KEL передаются по наследству кодоминантно по тем же законам насле- дования,какдругиегрупповыепризнакикровичеловека–АВО,MNSs,Rhит.д. Они не сцеплены с полом (хотя частично зависят от хромосомы X) и не меняются в течение жизни. При отсутствии какого-либо антигена у родителей у детей он также отсутствует.
Присутствие антигенов Kell на эритроцитах (Kell-фенотип) зависит от взаимодействия двух генов. Один из них (аутосомный ген KEL) кодирует синтез полипептида Kell, несущего антигены Kell. Он расположен на хромосоме 7 в позиции q33–35 рядом с локусом пузырного фиброза [244, 295, 315, 406]. Другой ген (XK) кодирует синтез протеина Kx, который в свою очередь регулирует степень выраженности антигенов Kell на эритроцитах. Этот ген расположен в другом месте – на коротком плече X-хромосомы, в локусе p21 [103, 200].
Имеются сведения, что ген XK находится между локусом мышечной дистрофии Дюшена и локусом хронического гранулематоза [103, 200], что позволяет понять причинно-следственную связь указанных заболеваний (гранулематоза и фенотипа McLeod) и предрасположенности к ним мужчин.
383
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Локус KEL, как указывалось выше, включает 5 групп аллельных генов, а также несколько генов пара-KEL, не имеющих аллелей. Пары образуют гены: K / k,
Jsa / Jsb, Wka / Wkb и K14 / K24. Группа Kрa / Kрb / Kрс содержит 3 аллеля.
Пара-Kell-антигены экспрессированы на эритроцитах независимо от других антигенов Kell: K, k, Kр, Js и т. д. На эритроцитах McLeod они также слабо выражены, как и Kell-антигены. При фенотипе Ko антигены пара-Kell, так же как и Kell, отсутствуют, что указывает на принадлежность обеих групп к одной системе. Как упоминалось выше, антигены пара-Kell и Kell расположены на одном и том же Kell-протеине мембраны эритроцитов.
Уместно еще раз отметить, что гены K и Kра не могут наследоваться от одного родителя, поскольку никогда не располагаются вместе на одной хромосоме. При исследовании семей не найдено одновременной передачи этих антигенов только от одного из родителей, т. е. гаплотипа KKра [318]. Ген k менее активен, когда передается с геном Kра [318], последний подавляет синтез антигена k (Kp a-эффект).
Локализация и организация локуса KEL
Квыводу о том, что локус KEL расположен на хромосоме 7, пришли Zelinski
исоавт. [406], Parsons и соавт. [303]. Авторы обнаружили связь между генами KEL и геном пролактининдуцирующего протеина (PIP), который локализован на хромосоме 7 в позиции q32-q36.
Purohit и соавт. [315] нашли, что локус KEL связан с геном цистофиброза, который, так же как PIP, локализован на длинном плече хромосомы 7.
Последующие исследования, проведенные Murphy и соавт. [295], Lee и соавт. [244] с помощью методов гибридизации in situ и метода клонирования KellспецифическойкДНК,подтвердилирасположениегеновKEL научастке7q33–7q35.
Генный комплекс Kell включает 19 экзонов и занимает примерно 21,5 кб (Lee
исоавт. [242]).
Экзон 1 содержит 5'-нетранслируемую область, кодон метионина 1, инициирующий трансляцию, SP1- и GATA-1-связывающие участки. Как полагают Camara-Clayette и соавт. [119], экзон 1 вовлечен в отрицательную регуляцию промотора в неэритроидных тканях.
Экзон 2 кодирует цитоплазматический домен и, возможно, второй инициирующий трансляцию метионин 20.
Экзон3кодируеттрансмембранную,наиболеекороткуючастьKell-полипептида, котораясостоитпримерноиз20аминокислотныхостатков(см.рис.5.2).
Экзоны 4–19 ответственны за экстрацеллюлярный, самый протяженный домен. Аминокислотная последовательность, придающая Kell-протеину свойства цинкзависимой металлопротеиназы, кодируется экзоном 16, который, по данным Lee и соавт. [242], на 54,5 % идентичен эквивалентному участку гена NEP, кодирующего вазоконстриктор неприлизин.
Lee и соавт. [242] нашли, что 5′-латеральная область от −176 до −1 нуклеотида содержит три участка, связывающих GATA-1. По мнению Shivdasani и Orkin
384
[см. 204], GATA-1 является транскрипционным фактором, необходимым для формирования эритроидных тканей.
Мутации в участке связывания GATA-1 приводят к нарушению синтеза на эритроцитах гликопротеина Duffy; эти мутации наблюдают у большинства людей с фенотипом Fy(a −b −). Неизвестно, определяют ли эти мутации отсутствие белка Kell на эритроцитах людей с фенотипом Kо.
Lee и соавт. [242] полагают, что локус KEL регулируется эритроидными факторами транскрипции.
|
|
|
|
Таблица 5.4 |
|
|
|
Организация гена KEL* |
|
|
|
|
|
|
|
|
|
Экзон |
Кодон |
Размер, кб |
Кодируемые домены и антигены |
|
|
1 |
5´нто Met1 |
0,34 |
|
|
|
2 |
2–27 |
0,29 |
Интрацеллюлярный домен |
|
|
|
|
|
|
|
|
3 |
28–74 |
0,26 |
Трансмембранный домен |
|
|
4 |
75–133 |
−2,6 |
K18 |
домен |
|
|
|
|
|
|
|
5 |
134–175 |
0,33 |
|
||
|
Экстрацеллюлярный |
|
|||
10 |
359–401 |
−6 |
K23 |
|
|
6 |
176–224 |
−3,2 |
K14 / K24 / K / k |
|
|
7 |
225–245 |
0,093 |
|
|
|
8 |
246–308 |
0,23 |
Kp a / Kp b / Kp c;K11 / K17 |
|
|
9 |
309–358 |
−1,3 |
K22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
402–438 |
−1,6 |
TOU |
|
|
|
|
|
|
|
|
12 |
439–471 |
0,24 |
|
Экстрацеллюлярный домен |
|
13 |
472–497 |
0,44 |
K19, Ul a |
|
|
|
|
||||
14 |
498–531 |
0,19 |
|
|
|
|
|
|
|
|
|
15 |
532–568 |
0,15 |
K12 |
|
|
16 |
569–590 |
0,23 |
HELLH |
|
|
|
|
|
|
|
|
17 |
591–647 |
0,35 |
Js a / Js b |
|
|
18 |
648–679 |
−1,3 |
|
|
|
19 |
680–732 3´нто |
|
|
|
|
* По сводке Dаniels [141], нто – нетранслируемая область.
Эффекты позиции в локусе KEL
Известны 2 позиционных эффекта в локусе KEL, отражающиеся на экспрессии Kell-антигенов и особенностях их наследственной передачи: Kp a-эффект и K13-эффект.
385
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Kpa-эффект
Allen и Lewis [87], открывшие антиген Kp a и изучившие характер его наследования, обратили внимание на тот факт, что антиген k слабо выражен у некоторых членов семьи, имевших фенотип Kp(a + ). На эритроцитах K −k + wKp(a +b −) антиген k был подавлен до такой степени, что его присутствие могло остаться незамеченным, если бы не были применены сильные анти-k-сыворотки. На эритроцитах K −k + Kp(а −b + ) экспрессия k была в нормае.
Объяснение этому феномену нашли Race и Sanger [318], показав, что угнетающее действие гена Kpa распространяется не только на k, но и на другие антигены системы Kell.
В более поздних исследованиях было подтверждено супрессирующее влияние гена Kpa на другие гены KEL, расположенные в позиции цис. Опубликованные данные свидетельствуют об уменьшенной экспрессии антигенов Ku (Ford [164]), Js b (Ford [164], Tippett [370]), K18 (Barrasso и соавт. [98]), K19 (Sabo и соавт. [337]),TOU(Marshисоавт.[272])идругихчастовстречающихсяантигеновKellи
пара-Kell (Walsh и соавт. [390]).
Manny и соавт. [256] сообщили, что экспрессия антигена K22 на эритроцитах Kp(a +b −) снижена по сравнению с эритроцитами Kp(a −b + ). Bar Shany и соавт. [96], напротив, констатировали, что экспрессия антигена K22 на эритроцитах Kp(a +b −) и Kp(a −b + ) одинакова. Подавляющее действие гена Kpa на другие гены KEL не всегда выявляют при обычном серологическом исследовании.
Впоследствии выяснилось, что супрессирующий Kp a-эффект можно отчетливо наблюдать только при одном из трех обязательных условий:
––гомозиготность по гену Kpa; ––присутствие гена K в позиции транс; ––присутствие молчащего гаплотипа Kо.
Kp a-эффект сильнее проявляется при 3-м варианте, когда лица Kp(a + ) имеют генотип Kpa / Kо [164, 390]. Присутствие гаплотипа Ko на противоположной хромосоме позволяет более четко увидеть подавляющее действие гена Kp a на другие гены KEL в Kpа-гаплотипе. Подобно этому подавляющее действие гена Kp a на экспрессию антигена k и других Kell-антигенов легче обнаружить у людей kKp a / KKpb, чем kKp a / kKpb, т. е. когда гены Kp a и K находятся в положении транс.
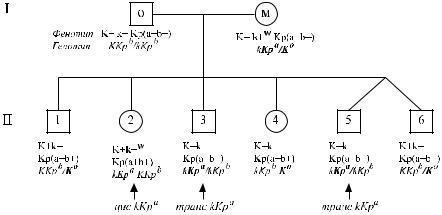
На рис. 5.3 представлены результаты семейного исследования, демонстрирующие супрессивный эффект гена Kpa на ген k. Ослабление антигена k (k + W) наблюдалось у представителя первого (I м) и второго (II 2) поколения: I м имела генотип Kpa / Ko, II 2 – генотип Kpa / K (Kpa транс по отношению к K). У I м все высокочастотные антигены были супрессированы. У других членов семьи антигены Kell имели нормальную выраженность.
Tippett [370] установила, что сыворотки анти-k и анти-Js b имели разный титр при титровании 5 образцами эритроцитов Kp(a +b −). Один образец
386
эритроцитов от человека k + Kp(a +b −) Js(a −b + ), второй гаплотип которого был, по-видимому, K o, показывал отчетливо низкий титр; другие 4 образца k + Kp(a +b −) Js(a −b + ), полученные от гомозигот kKp aJs b / kKpaJs b, показали небольшое снижение титра антител анти-k и анти-Js b, что свидетельствовало о сниженной экспрессии антигенов k и Js b на эритроцитах гетерозигот K o.
Daniels и соавт. [150], Yazdanbakhsh и соавт. [404] полагают, что Kp a-эффект проявляется только низкой синтезирующей способностью Kp a-аллеля, в результате чего количество гликопротеинов Kell на эритроцитах снижено. Конформационные изменения в Kell-гликопротеине, которые могли бы препятствовать связыванию Kell-антигенов с антителами, не столь выражены.
Рис. 5.3. Результаты исследования семьи, показывающие депрессивный эффект Kpa на k (поWalshисоавт.[390]). Ослабление k наблюдали у I м (Kpa/Ko) и II 2 (Kpa/K).
Waheed, Kennedy [385] на модели экспрессии кДНК-конструктов в клетках эмбриональной почки человека нашли, что Kp a (Trp 281) замедляет продвижение Kell-гликопротеинов к поверхности клетки, удерживая их на уровне аппарата Гольджи. Для того чтобы обеспечить более эффективное продвижение Kell-гликопротеинов к клеточной поверхности, возникли мутации: часто встречающаяся – Kp b (Arg 281) и редко встречающаяся – Kp c (Glu 281).
Daniels и соавт. [150] описали фенотип Ko, который на самом деле таковым не являлся. Несмотря на то что эритроциты этого человека не содержали Kell-антигенов, тем не менее они адсорбировали анти-k-антитела, которые затем обнаруживали в элюате. Кроме того, на эритроцитах пробанда отсутствовал антиген Kx, наличие которого является характерным признаком Ko-фенотипа. Наконец, 3 детей пробанда были Kp(a +b + ), и маловероятно, что пробанд имел ген K o. Анализ экзона 8 показал, что пробанд был гомозиготен по гену Kp a. Авторы отметили также мутации в XK-гене, что позволило в итоге диагностировать у пробанда фенотип McLeod. Как считают авторы, Kell-ингибирующий эффект, приведший к Ko-подобному фенотипу,
387
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
был обусловлен двумя причинами: гомозиготностью по гену Kp a и дефицитом Kx-протеина.
Необходимо отметить, что Kp a-эффект проявляется только в отношении часто встречающихся Kell-антигенов. Редкие антигены Kell (имеющие частоту менее 10 %): K, Js a, Kp a, Kp c и др. – не подвержены ингибиции, поскольку ген Kp a и гены K, Js a, Kp a, Kp c в одном гаплотипе, в положении цис,
не встречаются (см. Ожидаемые, но не встречающиеся гаплотипы KEL). Kikuchi и соавт. [225] привели данные, показывающие, что в отличие от
гена Kp а его редко встречающийся аллель Kp с не влияет на гены KEL, с которыми он находится в положении цис, как это имеет место при Kp a-эффекте. Авторы не отметили подавления экспрессии антигенов k, Js b и других часто встречающихся антигенов Kell и пара-Kell на эритроцитах лиц с фенотипом
Kp(а −b −с + ).
K13-эффект
K13-эффект правильнее называть эффектом отсутствия гена K13, поскольку гаплотип K13 −, а не гаплотип K13, содержит ген, подавляющий экспрессию других антигенов системы Kell и пара-Kell (см. K13).
Marshисоавт.[262],впервыеобнаружившиечеловекасфенотипомK13 −,вначале полагали, что низкая экспрессия антигенов k, Kp b, Js b, Ku и K12 на эритроцитах этого человека связана с его гетерозиготностью по гену Kо. Эритроциты пробанда сильно реагировали с сывороткой анти-Kx, что свидетельствовало о наличии у этого человека гаплотипа Kо.Генотип пробанда соответствовал формуле K13 −/K13 −Kо. Однако, как показали Kaita и соавт. [220], гетерозиготность по гену Kо не могла быть причиной депрессии других Kell-антигенов, поскольку люди, являющиеся генетически Kо / kKpbJsb, нормально экспрессируют антигены k, Kp b и Js b. Таким образом, Marsh и соавт. [262] оставалось сделать единственно правильный вывод относительно ослабления антигенов Kell у лиц K13 −, а именно: низкая экспрессия Kell у лиц K13 − обусловлена антитетичным партнером K13, который, будучи в гомозиготной форме и в позиции цис к другим генам KEL, кодирует более слабую, чем в норме, экспрессию антигенов Kell.
У людей K13 − слабо выражены антигены K18 (Barrasso [98]), K19 и TOU (Sabo и соавт. [337]).
Вполне вероятно, что случаи ослабления Kell-антигенов, наблюдаемые многими авторами, связаны с гетерозиготностью по K13 −, однако это пока невозможно доказать, поскольку отсутствуют сыворотки против указанного гипотетического аллеля K13.
Можно также предположить, что K13-эффект никак не связан с антигеном K13, а является проявлением пока неизвестного генетического процесса, приводящего к уменьшению синтеза антигенов Kell, в том числе антигена K13, который в этом случае не производится вовсе и его экспрессия соответствует 0.
388
Ожидаемые, но не встречающиеся гаплотипы KEL
Как известно, групповые антигены крови наследуются кодоминантно и независимо друг от друга. Однако существует много исключений, которые ставят под сомнение непреложность этого правила и еще раз подчеркивают огромное разнообразие не только форм групповых антигенов крови, но и способов их наследственной передачи. Приведем некоторые примеры:
––частичное доминирование (эпистазия) D над C в позиции цис. В серологических реакциях это проявляется следующим образом: эритроциты лиц CDe / cde (C и D цис) медленнее агглютинируются сывороткой анти-С и агглютинация выражена слабее, чем при тестировании эритроцитов лиц Cde / cDe (C и D транс);
––ослабление выраженности антигена D (D u) под действием гена C, расположенного по отношению к гену D в позиции транс. Этот феномен проявляется в том, что эритроциты лиц CDe / cde реагируют с сывороткой анти-D значительно сильнее, чем эритроциты лиц Cde / cDe; ––Kp a-эффект – подавление синтеза антигенов Kell геном Kpa; ––K13-эффект – подавление синтеза антигенов Kell неизвестным геном, присутствующим в гаплотипе K13 −.
Следует упомянуть еще об одном феномене – неравновесном сцеплении, которое проявляется в том, что антигены двух групповых систем предпочтительно наследуются вместе. Например, у людей, имеющих группу крови M, антиген S встречается в 2 раза чаще, чем у людей, имеющих группу крови N. Среди лиц М + 72 % являются S +, среди N + – 31 % S +. Считается, что ген S близко расположен к гену М, поэтому чаще наследуются вместе с ним, чем с геном N. Неравновесное сцепление генов M и S по сравнению с N и S послужило основанием полагать, что антигены MN и Ss представляют собой тесно связанную антигенную систему MNS.
В наследственной передаче антигенов Kell также проявляются свои особенности. Помимо Kp a- и K13-эффекта существует еще одна необычная генетическая закономерность, а именно отсутствие Kell-гаплотипов, которые по логике вещей должны присутствовать. Речь идет о гаплотипах, кодирующих два редких антигена Kell и более, например: Kp aK, KJs a, Kp aJs a, KKp c и др. Такие гаплотипы до сих пор не обнаружены.
Фенотипы, несущие два редких антигена, встречаются, например: K +k + Kp(a +b + ), K +k + Js(a +b + ), K +k + Ul(a + )Kp(a −b + ). Однако во всех слу-
чаях семейных исследований [154, 249, 251, 252, 288, 357, 402] установлено, что лица с фенотипом K +k + Kp(a +b + ) генетически являются KKp b / kKpa, лица с фенотипом K +k + Js(a +b + ) имеют генотип KJsb / kJsa, а лица с фенотипом
K +k + Ul(a + )Kp(a −b + ) – генотип KKpb / kUla.
Возникает вопрос: почему гены K и Kp a, K и Js a, K и Ula, а также гены других редких Kell-антигенов не наследуются по два и более в одном гаплотипе?
До настоящего времени стройной генетической концепции, объясняющей
389
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
это явление, не предложено. Некоторые авторы разделяют точку зрения Chown о том, что kKpbJsb представляет собой эволюционно более ранний гаплотип, который в результате единичных мутаций трансформировался в гаплотипы KKpbJsb, kKp aJs b, kKp cJs b и kKp bJs a. Далее логика нарушается, поскольку остальные 5 редких генов: Ula, Wk a, K23, K24 и K25 – не имеют аллелей. Согласно предположению Chown, гаплотипы KKp a, KJs a и Kp аJs a могли сформироваться вследствие двойных мутаций, вероятность которых ничтожно мала в связи с редкостью генов K, Kpа, Kpc, Jsa и др. Однако, как полагают Issitt иAnstee [204], с момента открытия редких антигенов Kell выполнено огромное количество исследований, и если бы такие двойные мутации (мутации предыдущих мутаций) существовали, они были бы обнаружены.
Не лишена оснований и другая точка зрения, что антигены системы Kell кодируются 10 гаплотипами (рис. 5.4). Один из них – общий (частый), 9 других – редкие. Первый гаплотип (общий) состоит из гена R − (R-минус), кодирующего все антигены Kell, за исключением редких. Другие 9 гаплотипов представлены одним из редких генов, которые кодируют 1 редкий и все остальные часто встречающиеся антигены.
R −
K
Kpa
Jsa
Ula
Wka k, Kpb, Jsb, 11, 12, 13, 14, 18, 19, 22
Kpc
K23
K24
K25
Рис. 5.4. Гаплотипы KEL. Гаплотип R − производит общие Kell-антигены: k, Kp b,Js b, 11, 12, 13, 14, 18, 19 и 22; гаплотип K – антиген K и общие Kell-антигены; гаплотип Kpa – антиген Kp a и общие Kell-антигены и т. д.
В соответствии с этой схемой гаплотипы, содержащие 2 редких антигена и более, исключены. Остается непонятным, почему в локусе KEL отсутствуют генные конверсии и другие формы обмена генетическим материалом между гомологичными хромосомами, как это имеет место в системе резус. По-видимому, в этом проявляется своеобразие рассматриваемого генного локуса.
Итак, подавляющее большинство людей гомозиготны по гаплотипу R − и соответственно содержат весь набор общих Kell-антигенов: k Kp b Js b 11 12 13 14 18 19 22.
390
