
6 курс / Кардиология / Шляхто_Е_Вред_Кардиология_Национальное_руководство_2019
.pdf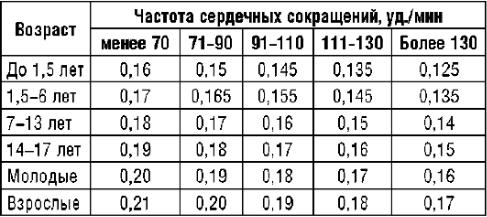
•Травмы сердца.
•Ваготонические влияния.
ПАТОГЕНЕЗ
АВ-блокада - это нарушение проведения возбуждения (замедление или блок) от предсердий к желудочкам вследствие нарушения вегетативной иннервации или воспалительных, дистрофических и дегенеративных изменений в предсердиях, АВ-узле, в системе Гиса-Пуркинье.
КЛИНИЧЕСКАЯ КАРТИНА
АВ-блокада I степени часто не сопровождается специфической клинической симптоматикой. Самочувствие ребенка в течение длительного времени может не страдать. Могут быть жалобы на повышенную утомляемость, снижение переносимости привычных нагрузок, головные боли и трудности в процессе обучения. В случае прогрессирования заболевания до АВ-блокады II степени I или II типа появляются головокружения, синкопальные состояния, отставание в развитии.
ДИАГНОСТИКА
•Изучение анамнеза жизни и анамнеза заболевания.
•Клинический анализ крови, биохимический анализ крови с целью выявления воспалительного процесса. Углубленные вирусологическое, бактериологическое, иммунологическое исследования, метод ПЦР.
•ЭКГ - оценка продолжительности P-Q в зависимости от частоты ритма сердца и возраста пациента (табл. 22.2).
•Суточное мониторирование сердечного ритма - регистрация транзиторной АВ-блокады I степени, пауз ритма за счет АВ-блокады II степени.
•Чреспищеводное ЭФИ - определение антероградной точки Венкебаха (ТВ), эффективного РП АВ-соединения (ЭРП АВС). В норме ТВ у детей до 15 лет составляет 130220 имп/мин, а у пациентов старше 15 лет - 120-210 имп/мин.
•ЭхоКГ с допплерографией - при устойчивом увеличении P-Q более 240 мс и снижении ТВ менее 130 имп/мин в 66,7% отмечается тенденция к дилатации левых камер сердца.
Таблица 22.2. Возрастные значения интервала PQ в зависимости от частоты сердечных сокращений (Трешкур Т.В., 2004)
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
По ЭКГ диагностика АВ-блокады I степени не составляет труда. Дифференциальную диагностику АВ-блокады II степени проводят с блокированными ПЭ.
ЛЕЧЕНИЕ
Медикаментозная терапия
•Комплексное воздействие на нейровегетативную основу АВ-блокады степени у детей.
•Активация метаболизма миокарда.
•Стабилизация клеточных мембран.
•Санация хронических очагов инфекции и комплексное лечение миокардита, лежащего в основе прогрессирующей АВ-блокады I степени.
Хирургическое лечение
Показаний для имплантации ЭКС детям с АВ-блокадой I степени не существует. Показания для имплантации ЭКС при АВ-блокаде II степени II типа - см. ниже.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
•Наблюдение у кардиолога.
•Ежегодные регистрация ЭКГ и проведение суточного мониторирования сердечного ритма.
ПРОГНОЗ
У молодых пациентов с преходящей АВ-блокадой I степени и АВ-блокадой II степени I типа прогноз благоприятный. Что касается АВ-блокады I степени и АВ-блокады II степени I типа, развившейся вследствие миокардита, то до настоящего времени ее лечение остается сложной и еще не решенной проблемой, у 30-50% больных отмечается рецидивирующее течение, приводящее к прогрессированию заболевания с развитием синкопальных состояний.
Полная атриовентрикулярная блокада
КОД ПО МКБ-10
• I44.2 Предсердно-желудочковая блокада полная.
ЭПИДЕМИОЛОГИЯ
Частота возникновения врожденной полной АВ-блокады составляет 1 на 20 000-22 000 новорожденных. Частота развития полной АВ-блокады после хирургической коррекции ВПС составляет до 17%. Этот показатель определяется анатомией порока сердца и видом выполненного кардиохирургического вмешательства.
ПРОФИЛАКТИКА
Мер специфической профилактики не существует. Основные усилия должны быть направлены на предотвращение заболеваний, способных привести к развитию полной АВ-блокады.
СКРИНИНГ
Полная АВ-блокада характеризуется асинхронностью работы предсердий и желудочков, имеющих каждый свой ритм. Предсердные стимулы не проводятся к желудочкам, а желудочки деполяризуются замещающим ритмом, локализация которого и, соответственно, частота ритма - определяющие для развития симптоматики.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления полных АВ-блокад у детей определяются ЧСЖ и асистолиями. Отмечаются жалобы на слабость, утомляемость, снижение толерантности к ФН, эпизоды быстро проходящих головокружений, чувство нехватки воздуха, тяжесть в области сердца, чувство страха смерти, предсинкопальные и синкопальные состояния, синдром внезапной смерти. Длительно существующая полная АВ-блокада приводит к задержке темпов физического и психического развития.
ДИАГНОСТИКА
•Сбор жалоб, изучение анамнеза жизни и болезни, изучение клинической картины пресинкопальных и синкопальных состояний.
•Клинический анализ крови, биохимический анализ крови, вирусологическое и бактериологическое исследования крови, антитела к миокарду, исследование крови методом ПЦР, генетическое тестирование, обследование матери ребенка с врожденной полной АВ-блокадой на наличие SS-А/Rо и SS-В/Lа антител.
•ЭКГ - предсердия и желудочки сокращаются независимо друг от друга. Предсердия сокращаются в ритме СУ, а желудочки - в ритме АВ-соединения или водителя ритма из нижележащего отдела проводящей системы сердца.
•ХМ ЭКГ - разобщение работы предсердий и желудочков в ходе всего исследования. Могут отмечаться эпизоды эктопических замещающих ритмов, снижение вариабельности сердечного ритма, наличие пауз ритма, удлинение интервала Q-T, возможны и другие жизнеопасные нарушения ритма.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Следует дифференцировать полную АВ-блокаду с АВ-диссоциацией, для которой характерна более высокая частота сокращений желудочков, чем предсердий.
ЛЕЧЕНИЕ
Цели лечения См. раздел «Синдром слабости синусового узла».
Показания к госпитализации См. раздел «Синдром слабости синусового узла».
Медикаментозное лечение
• В экстренных случаях (предобморочные или обморочные состояния вследствие значимой брадикардии) внутривенно вводят 0,1% раствор атропина (0,1 мл/год жизни, но не более 2,0 мл). В случае отсутствия эффекта необходима установка временного ЭКС.
•Для увеличения ЧСС используют центральные и периферические холинолитики - беллоид♠, белласпон♠, беллатаминал♠, микстуру с красавкой♠, микстуру Зеленина♠ в возрастной дозировке.
•Стимуляторы β-адренергических рецепторов - изопреналин - стимулируют β1- и β2- рецепторы, увеличивая частоту и силу сокращений сердца с умеренной вазодилатацией.
•Для устранения хронической гипоксии, возможной недостаточности кровообращения, для улучшения метаболических процессов в миокарде, предупреждения развития жизнеугрожающих аритмий у детей с полной АВ-блокадой используют ноотропы, антиоксиданты, кардиотрофики, НПВП, витамины.
Хирургическое лечение Основной метод лечения полной АВ-блокады - имплантация ЭКС.
Абсолютные показания к имплантации ЭКС при АВ-блокаде степени (клинические рекомендации ВНОА, 2011).
•Прогрессирующая АВ-блокада II или III степени в сочетании с симптомной брадикардией, дисфункцией желудочков или снижением СВ (I класс).
•Послеоперационная прогрессирующая АВ-блокада II или III степени, если не прогнозируется ее разрешение после операции на сердце или если она не разрешается в течение 7 дней (I класс).
•Врожденная АВ-блокада III степени с ширококомплексным замещающим ритмом, политопной желудочковой эктопией или дисфункцией желудочков (I класс).
•Врожденная АВ-блокада III степени у грудного ребенка с желудочковым ритмом менее 50-55 ударов в минуту или с ВПС и желудочковым ритмом менее 70 ударов в минуту (I класс).
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
См. раздел «Синдром слабости синусового узла».
ПРОГНОЗ
Для детей без имплантации ЭКС прогноз в целом неблагоприятный. При своевременной имплантации ЭКС и адекватной реабилитации прогноз в целом благоприятный.
Список литературы
1.Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА). Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантированных антиаритмических устройств / Л.А. Бокерия, Р.Г. Оганов, А.Ш. Ревишвили. - М.: Новая редакция, 2011. - 516 с.
2.Клинические рекомендации по детской кардиологии и ревматологии / Под. ред. М.А. Школьниковой, Е.И. Алексеевой. - М., 2011. - 503 с.
3.Белоконь Н.А. Болезни сердца и сосудов у детей. - М.: Медицина, 1987. - Т. 2. - 448 с.
4.Бокерия Л.А. Катетерная абляция аритмий у пациентов детского и юношеского возраста. -М.: Изд-во НЦССХ им. А.Н. Бакулева, 1999. - 66 с.
5.Егоров Д.Ф. Диагностика и лечение брадикардии у детей. - СПб.: Человек, 2008. - 320 с.
6.Диагностика и лечение нарушений ритма сердца у детей: Учебное пособие / Под ред. М.А. Школьниковой, Д.Ф. Егорова. - СПб.: Человек, 2012. - 432 с.
7.Лебедева В.К. Электрофизиологические показатели функции синусно-предсердного узла и предсердно-желудочкового соединения у детей // Вестник аритмологии. - 2002. - №25. - С. 203-206.
8.Ковалев И.А. Нарушения ритма сердца у детей: Основные принципы диагностики и лечения. - Томск: STT, 2006. - 272 с.
9.Кручина Т.К. Суправентрикулярные тахикардии у детей: клиника, диагностика, методы лечения. - СПб.: Человек, 2011. - 356 с.
10.Макаров Л.М. ЭКГ в педиатрии. - М.: Медпрактика, 2006. - 544 с.
11.Школьникова М.А. Жизнеугрожающие аритмии у детей. - М., 1999. - 229 с.

Раздел 27
Глава 23. Заболевания миокарда (О.М. Моисеева, А.Я. Гудкова)
МИОКАРДИТ
Воспалительные заболевания миокарда - одна из немногочисленных нозологических форм в кардиологии, которая, несмотря на почти двухвековую историю, по-прежнему, не имеет четких рекомендаций по диагностике и лечению.
Определение
Всоответствии с определением, данным Н.Р. Палеевым, миокардит - это поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной или протозойной инвазии, химических или физических факторов, а также поражение, возникающее при аллергических и аутоиммунных заболеваниях [1].
Вотличие от определения Н.Р. Палеева, в котором акцент сделан на этиопатогенез заболевания, группа экспертов ВОЗ (1995) рассматривает миокардит как воспалительное заболевание миокарда, которое диагностируют по гистологическим, иммунологическим и иммуногистохимическим критериям, подчеркнув тем самым необходимость морфологического подтверждения диагноза [2].
Классификация
Большинство ныне существующих клинических классификаций миокардитов носит этиопатогенетический характер. K.L. Baughman предлагает выделять первичные (идиопатические) и вторичные миокардиты [3]. К первичным миокардитам относят:
•гигантоклеточный миокардит;
•идиопатический гранулематозный миокардит;
•лимфоцитарные миокардиты, вирусная этиология развития которых наиболее вероятна.
Вторичные, или ассоциированные, миокардиты подразделяют по этиологическому принципу на:
•инфекционные;
•аллергические;
•токсические;
•аутоиммунные.
К клиническим относят и классификацию Н.Р. Палеева, в которой учитывают этиологию, патогенетические и морфологические варианты миокардитов, распространенность процесса, особенности течения, степень тяжести и клинические проявления заболевания
[1].
Классификация воспалительных заболеваний миокарда (Палеев Н.Р., 2009)
♦Этиологическая характеристика.
• Инфекционный миокардит.
• Лекарственно-индуцированный миокардит.
• Аллергический миокардит.
• Токсический миокардит.
• Радиационный миокардит.
• Миокардит при системных заболеваниях.
• Миокардит при ожоговой болезни.
• Трансплантационный миокардит.
• Идиопатический миокардит (неизвестной этиологии).
♦Патогенетические варианты.
•Инфекционно-токсический миокардит.
•Аллергический (иммунологический) миокардит.
•Токсико-аллергический миокардит. ♦ Патогенетические фазы.
•Инфекционно-токсическая фаза.
•Иммуноаллергическая фаза.
•Дистрофическая фаза.
•Миокардиосклеротическая фаза. ♦ Морфологические варианты.
•Альтеративный (дистрофически-некробиотический) миокардит.
•Экссудативно-пролиферативный (интерстициальный) миокардит: - дистрофический вариант; - воспалительно-инфильтративный вариант; - смешанный вариант; - васкулярный вариант.
♦ По распространенности.
•Диффузный миокардит.
•Очаговый миокардит.
♦ По течению.
•Острый миокардит.
•Абортивный миокардит.
•Рецидивирующий миокардит.
•Латентно текущий миокардит.
•Хронический миокардит.
♦ По степени тяжести.
•Легкая (слабо выраженный миокардит).
•Средняя (умеренно выраженный миокардит).
•Тяжелая (ярко выраженный миокардит).
♦ Клинические варианты.
•Малосимптомный миокардит.
•Псевдокоронарный миокардит.
•Аритмический миокардит.
•Псевдоклапанный миокардит.
•Тромбоэмболический миокардит.
•Смешанный миокардит.
•Декомпенсированный миокардит.
Международная классификация болезней (МКБ-10) позволяет присвоить код только острому миокардиту (I.40), так как рубрика «хронический миокардит» отсутствует. В случае известной причины заболевания (инфекционной или аутоиммунной) для классификации миокардитов можно воспользоваться кодами 141.1; 141.0; 141.2; 148.8.
Внедрение в клиническую практику эндомиокардиальной биопсии (ЭМБ) послужило основой для создания клинико-морфологических классификаций миокардита. Наряду с Далласскими критериями диагностики миокардита, в 1991 г. E.B. Lieberman предложил учитывать клинические особенности течения воспалительных заболеваний миокарда для определения прогноза больных [4]. Однако в предложенной им классификации анализируются клинические варианты только лимфоцитарного миокардита. В дальнейшем недостатки классификации E.B. Lieberman устранены L.T. Cooper в его «клиническом сценарии диагностики миокардита», созданном на основе рекомендаций по проведению ЭМБ (табл. 23.1) [5].
Этиология и патогенез
Вирусная инфекция - наиболее частая причина развития миокардита. В зависимости от клинической выборки вирусный геном выявляют у 23-68% больных с миокардитом и у 40% больных ДКМП [6]. С помощью ЭМБ в настоящее время выявлено около 20 различных кардиотропных вирусов, причем спектр этих вирусов постоянно меняется. На смену энтеровирусной инфекции как основной причины развития воспалительных заболеваний миокарда с 1995 г. постепенно приходит аденовирусная [7]. Последние годы активно изучается роль парвовируса В19, а также вирусов гепатита С, гриппа, цитомегаловируса и вируса Эпштейна-Барр в патогенезе современного миокардита. В 12% случаев причиной развития миокардита может быть сочетанная инфекция, чаще всего это сочетание парвовируса В19 и герпесвируса 6 типа [8].
В патогенезе воспалительных заболеваний миокарда, изученном на примере эспериментальных вирусных и аутоиммунных миокардитов, выделяют три патологические фазы [9].
•Первую фазу, фазу внедрения и репликации инфекционного агента, связывают с коксаки-аденовирусными рецепторами (CAR), важнейшими контактными белками вставочных дисков кардиомиоцитов. Взаимодействуя с конексинами и участвуя в организации клеточных контактов, CAR могут участвовать в патогенезе нарушений ритма и проводимости при миокардитах [10]. Наряду с высокой экспрессией CAR, нельзя исключить вклад генетических факторов - генетических мутаций и полиморфных вариантов гена CAR - как причины развития миокардитов и ДКМП. Дальнейшее проникновение вирусов в кардиомиоциты происходит по механизму эндоцитоза или с участием вспомогательных корецепторов: DAF (decay - accelerating factor) для энтеровирусов и αvβ3/αvβ5-интегринов для аденовирусов. Вирус-опосредованный лизис кардиомиоцитов облегчает дальнейшее проникновение вирусов в миокард. Повреждающим действием обладают и эндогенные протеазы вирусов. В частности, протеаза 2А вируса Коксаки, даже при низком уровне репликации последнего, может оказывать протеолитическое действие на белок дистрофин, что приводит к апоптозу кардиомиоцитов и способствует дилатации полостей сердца.
•Презентация вирусных антигенов вызывает активацию противовирусного иммунитета, направленного на элиминацию вируса. Вместе с тем сходство эпитопов вирусных антигенов и белков кардиомиоцитов, так называемый феномен молекулярной мимикрии, приводит к появлению перекрестных реакций и продукции аутоантител, характерных для второй фазы патологического процесса. Избыток иммуноглобулинов G (JgG) в миокарде приводит к его повреждению за счет активации системы комплимента. Присутствие аутоантител может нарушать кальциевый гомеостаз и функциональное состояние миотохондрий [11]. Аутоантитела к β1-адренорецепторам, вызывая экспрессию специфического гена, увеличивают апоптоз кардиомиоцитов в условиях гиперкатехоламинемии [12]. Иммунизация тропонином I экспериментальных животных показала, что тяжесть воспалительных реакций коррелирует с экспрессией провоспалительных хемокинов и рецепторов программируемой гибели кардиомиоцитов [13]. Однако ключевое значение в патогенезе миокардита играет не гуморальный, а клеточный иммунный ответ и прежде всего МНС II-опосредованная, CD4+Т-зависимая лимфоцитарная реакция. Особый интерес представляет популяция CD4+CD25+Т- регуляторных клеток, которые участвуют в поддержании иммунологической аутотолерантности и иммунного гомеостаза, подавляя аномальный иммунный ответ. Показано, что уменьшение числа CD4+CD25+Т-регуляторных клеток приводит к развитию аутоиммунных заболеваний, усиливает иммунный ответ на бактериальную и вирусную инфекцию и является пусковым механизмом развития парадоксальных аллергических реакций на традиционные вещества в окружении человека [14]. Активация Т- лимфоцитов в ответ на антигенную стимуляцию приводит к продукции Th1-цитокинов (интерлейкина-2, интерлейкина-1, интерлейкина-6, фактора некроза опухолей α,
интерферона γ) и Тһ2-цитокинов (интерлейкин-4, -5, -6, -13), которые могут иметь самостоятельное значение в патогенезе воспалительных заболеваний миокарда. В частности, интерферон-γ стимулирует продукцию интерлейкина-1,-6 и ФНО активированными макрофагами, а также повышает чувствительность кардиомиоцитов к апоптозу [15 Таблица 23.1. Клинический сценарий диагностики миокардита
