
6 курс / Кардиология / Кардиология_Национальное_руководство_Е_В_Шляхто_
.pdfбыстро превращается в дабигатран; апиксабан и ривароксабан не нуждаются в предварительной биотрансформации.
Фармакокинетика
Прием пищи не влияет на абсорбцию апиксабана и дабигатрана этексилата и существенно повышает биодоступность риваровсабана. Эффект достигает максимума через 2-3 ч после приема внутрь, Т1/2 составляет около 12 ч (см. табл. 9.26). Препараты различаются по степени участия в их элиминации почек и печени.
Особенности дозирования
Новые пероральные антикоагулянты используют в фиксированных дозах, эффективность и безопасность которых оценена в крупных контролируемых исследованиях с клинически важными конечными точками. Лабораторный контроль выраженности эффекта и индивидуальный подбор дозы на основании лабораторных показателей при использовании новых пероральных антикоагулянтов не предусмотрен. Отдельные лабораторные показатели можно применять в сложных клинических ситуациях для ориентировочного суждения о выраженности действия нового перорального антикоагулянта (прежде всего для оценки риска серьезных кровотечений). При этом наиболее информативна оценка в период ожидаемой минимальной концентрации препарата в крови (через 12-24 ч после приема внутрь).
Особенности дозирования препаратов зависят от показаний; при существенном снижении функции почек рекомендуют снижение дозы. Из-за небольшого Т1/2 при применении новых пероральных антикоагулянтов особенно важно обеспечить надлежащую приверженность к лечению (регулярный прием препарата).
Показания
•Профилактика тромбоза глубоких вен и ТЭЛА при плановом протезировании тазобедренного или коленного суставов.
•Профилактика инсульта и артериальных тромбоэмболий у больных с неклапанной ФП.
В крупных клинических исследованиях получены положительные результаты применения новых пероральных антикоагулянтов в лечении и длительной вторичной профилактике тромбоза глубоких вен и ТЭЛА (после нескольких суток парентерального введения антикоагулянта при использовании дабигатрана этексилата или с самого начала лечения для апиксабана и ривароксабана), однако одобрение их использования по данному показанию в РФ пока получено только для ривароксабана.
Побочные эффекты
Наиболее частое осложнение - кровотечения. Если кровотечение угрожает жизни больного и для его контроля недостаточно прекращения приема антикоагулянта и стандартных мероприятий, для устранения эффекта новых пероральных антикоагулянтов предлагают введение концентрата протромбинового комплекса, активированного фактора свертывания крови VIIa. Однако данные о клиническом значении этих подходов фактически отсутствуют. В первые часы после приема дабигатрана этексилата может быть полезен активированный уголь; удалению препарата из крови способствует гемодиализ.
Другие побочные эффекты, описанные при использовании новых пероральных антикоагулянтов, включают:
•повышение активности трансаминаз;
•гипербилирубинемию;
•диспепсию, боль в животе (характерны для дабигатрана этексилата), диарею. Противопоказания и предостережения Новые пероральные антикоагулянты противопоказаны при:
•аллергии или гиперчувствительности;
•продолжающемся клинически значимом кровотечении;
•геморрагическом диатезе;
•геморрагическом инсульте в анамнезе;
•клиренсе креатинина <30 мл/мин (дабигатрана этексилат) или <15 мл/мин
(апиксабан, ривароксабан);
•выраженной печеночной недостаточности;
•беременности, кормлении грудью;
•возрасте до 18 лет.
Основные лекарственные взаимодействия
Риск кровотечений повышается при сочетании с другими антитромботическими ЛС, НПВП. Возможно повышение концентрации в крови при сочетании с сильными ингибиторами и снижение при сочетании с сильными индукторами гликопротеина Р; аналогичная закономерность отмечается при сочетании апиксабана и ривароксабана с сильными ингибиторами или индукторами изофермента цитохрома P450 3A4. Соответствующие предостережения и нежелательные сочетания ЛС приведены в рекомендациях производителя.
Список литературы
1.De Caterina R., Husted S., Wallentin L. et al. Parenteral anticoagulants in heart disease: Current status and perspectives (Section I). Position Paper of the ESC Working Group on Thrombosis - Task Force on Anticoagulants in Heart Disease // Thromb. Haemost. - 2013. - Vol.
109.- P. 569-579.
2.Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. Parenteral Anticoagulants. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians EvidenceBased Clinical Practice Guidelines // Chest. - 2012. - Vol. 141 (Suppl). - P. e24S-e43S.
3.Weitz J.I., Eikelboom J.W., Samama M.M. New Antithrombotic Drugs. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. - 2012. - Vol. 141 (Suppl). - P. e120S-e151S.
4.Ageno W., Gallus A.S., Wittkowsky A. et al. Oral Anticoagulant Therapy. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians EvidenceBased Clinical Practice Guidelines // Chest. - 2012. - Vol. 141 (Suppl). - P. e44S-e88S.
5.New Oral Anticoagulants in Atrial Fibrillation and Acute Coronary Syndromes. ESC Working Group on Thrombosis - Task Force on Anticoagulants in Heart Disease Position Paper // JACC. - 2012. - Vol. 59. - P. 1413-1425.
6.Heidbuchel H., Verhamme P., Alings M. et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation // Europace. - 2013. - Vol. 15. - P. 625-651.
7.Holbrook A., Schulman S., Witt D.M. et al. Evidence-Based Management of Anticoagulant Therapy. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. - 2012. - Vol. 141 (Suppl). - P. e152S-e184S.
8.Raschke R., Hirsh J., Guidry J.R. Suboptimal monitoring and dosing of unfractionated heparin in comparative studies with low-molecular-weight heparin // Ann. Intern. Med. - 2003. - Vol.
138.- P. 720-723.
9.Linkins L.-A., Dans A.L., Moores L.K. et al. Treatment and Prevention of Heparin-Induced Thrombocytopenia. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. - 2012. - Vol.
141(Suppl). - P. e495S-e530S.
10.Douketis J.D., Spyropoulos A.C., Spencer F.A. et al. Perioperative Management of Antithrombotic Therapy. Anti-thrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. - 2012. - Vol. 141(Suppl). - P. e326S-e350S.
11.Bates S.M., Greer I.A., Middeldorp S. et al. VTE, Thrombophilia, Antithrombotic Therapy, and Pregnancy. Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. - 2012. - Vol. 141(Suppl). - P. e691S-e736S.
12.ESC Guidelines on the management of cardiovascular diseases during pregnancy. The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC) // Eur. Heart J. - 2011. - doi:10.1093/eurheartj/ehr218.
ФИБРИНОЛИТИКИ (И.С. Явелов)
Фибринолитические препараты (активаторы плазминогена) переводят содержащийся в крови неактивный белок плазминоген в активный фермент плазмин, вызывающий лизис фибрина и разрушение тромба (тромболизис). Препараты этой группы не предупреждают дальнейшего тромбообразования, могут способствовать увеличению образования тромбина и усилению агрегации тромбоцитов.
Механизм действия
Стрептокиназа - непрямой активатор плазминогена, получаемый из культуры β- гемолитического стрептококка. Сначала молекула стрептокиназы образует соединение с молекулой плазминогена, которая приобретает способность активировать другие молекулы плазминогена, как связанные с тромбом, так и циркулирующие в крови. В результате из-за возникновения системной плазминемии снижаются уровни фибриногена, плазминогена, факторов свертывания крови V и VIII и возникает гипокоагуляция, сохраняющаяся некоторое время после прекращения введения препарата. После однократного введения стрептокиназы через 3-4 сут в крови могут
появиться антитела, способные сохраняться не менее 10 лет. При введении препарата возможно возникновение артериальной гипотонии, что связывают с образованием брадикинина.
Тканевый активатор плазминогена - сериновая протеаза, идентичная человеческому активатору плазминогена, синтезируемому эндотелием сосудов. В настоящее время используют преимущественно одноцепочечную рекомбинантную молекулу тканевого активатора плазминогена (алтеплаза). Алтеплаза обладает повышенным сродством к фибрину. На его поверхности она становится значительно более активной и избирательно воздействует на находящийся рядом связанный с фибрином плазминоген, превращая его в плазмин. Системное влияние фибринолитика намного менее выражено. Кроме того, по сравнению со стрептокиназой алтеплазаспособна разрушать фибрин с более выраженными перекрестными связями, входящий в состав дольше существующих тромбов. Действию алтеплазы препятствуют ингибиторы активатора плазминогена.
Ретеплаза - мутантная форма алтеплазы, созданная за счет отщепления части исходной молекулы. Т1/2ретеплазы примерно в 2 раза больше, чем у алтеплазы, но она обладает меньшей фибринспецифичностью.
Тенектеплаза - мутантная форма альтеплазы, созданная с помощью генной инженерии за счет замены аминокислотных остатков в трех участках исходной молекулы. Это привело к увеличению Т1/2 в плазме крови, более выраженной фибринспецифичности и появлению устойчивости к влиянию ингибитора активатора плазминогена 1 типа.
Урокиназа - природный прямой активатор плазминогена. Намного менее антигенна, чем стрептокиназа.
Проурокиназа - рекомбинантный одноцепочечный предшественник урокиназы, обладающий небольшой ферментативной активностью. Имеет очень короткий Т1/2 и по фибринспецифичности аналогична тканевому активатору плазминогена. Циркулирует в комплексе с ингибитором, который диссоциирует в присутствии фибрина, что позволяет фибринолитику проявить активность.
Фармакокинетика
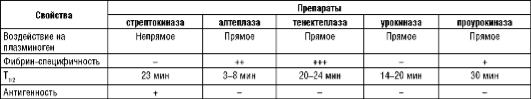
Основные фармакологические свойства фибринолитиков, разрешенных к применению в РФ, представлены в табл. 9.27.
Таблица 9.27. Основные фармакологические свойства фибринолитиков
Особенности дозирования
Зависят от показаний и используемого препарата; изложены в соответствующих разделах Руководства. Специфический коагулологический контроль не требуется. Введение фибринолитиков может сочетаться с применением ацетилсалициловой кислоты, клопидогрела, парентеральным введением антикоагулянта (зависит от показания и препарата).
Показания
•Раннее лечение ОКС со стойкими подъемами сегментов ST на ЭКГ.
•Первые 4,5 ч от начала острого ИИ (только алтеплаза).
•Тяжелая ТЭЛА.
•Тяжелый проксимальный тромбоз глубоких вен.
•Острая артериальная тромбоэмболия.
•Тромбоз центральной артерии и вены сетчатки.
•Тромбоз артериовенозных шунтов.
Побочные эффекты
Наиболее часто встречаются кровотечения. Частота внутричерепных кровотечений больше в пожилом возрасте, при повышенном САД и/или ДАД, у больных с низкой МТ, инсультом в анамнезе, у женщин, чернокожих, при использовании тканевого активатора плазминогена. Серьезное кровотечение требует прекращения инфузии фибринолитика; в ряде случаев оправдано введение свежезамороженной плазмы крови, факторов свертывания крови и антифибринолитических средств.
Другие побочные эффекты, описанные при использовании фибринолитиков, включают:
•аллергические реакции;
•тошноту, рвоту;
•боль в спине (обычно при введении стрептокиназы);
•при применении стрептокиназы не исключено возникновение артериальной гипотонии, что связывают с образованием брадикинина.
Противопоказания и предостережения
Противопоказания к использованию фибринолитиков разделяют на абсолютные и относительные; они зависят от показаний, по которым используют тромболитическую терапию, и изложены в соответствующих разделах данного Руководства.
Многолетнее сохранение антител к стрептокиназе может уменьшить эффективность последующего лечения и стать причиной аллергических реакций, поэтому ее не рекомендуют использовать повторно, если после первоначального введения прошло более 4-5 сут; вместе с тем в большинстве случаев очередное введение препарата не вызывает тяжелых аллергических реакций и данное противопоказание является относительным. Эти ограничения не распространяются на другие фибринолитики.
Основные лекарственные взаимодействия Риск кровотечений повышается при сочетании с другими антитромботическими ЛС. Список литературы
1. Goodman S.G., Menon V., Cannon C.P. et al. Acute ST-Segment Elevation Myocardial Infarction. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) // Chest. - 2008. - Vol. 133. - P. 708S-775S.

ГИПОЛИПИДЕМИЧЕСКИЕ ПРЕПАРАТЫ (ОА. Овчинникова)
Гиполипидемическая терапия направлена на профилактику атеросклероза и его осложнений. Основной принцип эффективной гиполипидемической терапии - сочетание немедикаментозных методов с назначением гиполипидемических препаратов. Основная цель терапии - достижение оптимальных показателей липидов и липопротеинов, а также снижение риска развития ССЗ [1].
Основные мишени гиполипидемической терапии были определены в результате многочисленных клинических исследований. Практически во всех исследованиях уровень ХС-ЛПНП был признан основным маркером эффективности терапии [2; 3]. Было показано, что при снижении уровня ХС-ЛПНП на каждые 1,0 ммоль/л риск развития ОКС уменьшается на 23%, а риск инсульта - на 17% [2]. В клинической практике целевой уровень ХС-ЛПНП расчитывают в зависимости от общего риска развития ССЗ (табл. 9.28).
Немедикаментозная терапия дислипидемии предусматривает назначение диеты, коррекцию веса, повышение физической активности, прекращение курения (табл. 9.29).
Таблица 9.28. Рекомендуемый целевой уровень снижения холестерина липопротеинов низкой плотности [1; 3]
Таблица 9.29. Немедикаментозные способы снижения уровня липидов [1]
Примечание. +++ - эффективность метода доказана и общепринята; ++ - менее выраженная эффективность, но существует доказательная база; + - недостаточная доказательная база.
Медикаментозная терапия направлена на снижение синтеза ХС, уменьшение его всасывания из просвета кишечника, повышение процессов липолиза и синтеза ЛПВП.
К гиполипидемическим ЛС относят:
• ингибиторы 3-гидрокси-3-метилглутарил-коэнзим А редуктазы - статины;
•ингибиторы абсорбции ХС в кишечнике - эзетимиб;
•секвестранты желчных кислот;
•никотиновую кислоту;
•производные фиброевой кислоты (фибраты);
•омега-3 ПНЖК.
Препараты первых трех групп (статины, эзетимиб, секвестранты желчных кислот) применяют в основном для коррекции гиперхолестеринемии. Для снижения уровня ТГ применяют фибраты, никотиновую кислоту и омега-3 ПНЖК.
Статины
Статины - основные препараты выбора для лечения гиперлипидемии и профилактики развития ССЗ.
Многочисленные многоцентровые клинические исследования доказали, что прием статинов снижает заболеваемость и смертность от ССЗ как в случаях первичной, так и вторичной профилактики. Более того, было показано, что прием статинов может снижать скорость атерогенеза и приводить к регрессии атеросклеротических бляшек [4; 5].
В настоящее время в РФ зарегистрированы следующие статины: ловастатин (мевакор♠), правастатин (липостат♠), флувастатин (лескол
форте♠), симвастатин (зокор♠), аторвастатин (липримар♠) и розувастатин (крестор♠), а также большое количество генерических статинов.
Статины были выделены в начале 1970-х годов из бульонной культуры грибковых микроорганизмов Penicillium citrinum, Penicillium brevecompactum, Aspergillus terrens [6].
Именно из двух последних культур были выделены структурные аналоги первых естественных статинов - ловастатина, симвастатина и правастатина. Флувастатин - первый из препаратов, синтезированный химическим путем; также синтезированы аторвастатин и розувастатин.
Статины различаются по фармакокинетическим свойствам - липофильности, абсорбции, связыванию с белками плазмы, взаимодействию с цитохромами, путям выведения и времени полураспада и другим фармакокинетическим параметрам.
Так, ловастатин и симвастатин - это пролекарства, и только после первого прохождения через печень они приобретают свойства активной лекарственной формы, в то время как все остальные статины изначально поступают в виде активного лекарства. Степень абсорбции статинов составляет 20-98%. Многие статины метаболизируются через изоферменты цитохрома P450 (CYP), за исключением правастатина, розувастатина и питавастатина . Ферменты, метаболизирующие статины, экспрессируются в печени и в стенке кишечника, поэтому статины выводятся в основном через печень и гораздо меньшая часть (2-20%) - через почки.
МЕХАНИЗМ ДЕЙСТВИЯ
Статины снижают синтез ХС в печеночных клетках за счет ингибирования фермента 3- гидрокси-3-метилглутарил-коэнзим А редуктазы. В результате уменьшается клеточное содержание ХС, что способствует увеличению количества рецепторов к ЛПНП на

поверхности гепатоцитов. Это, в свою очередь, приводит к более эффективному связыванию и снижению концентрации циркулирующих ХС-ЛПНП и других апо-Б- содержащих липопротеинов, включая обогащенные триглицеридами частицы.
Кроме того, статины обладают плейотропными свойствами, влияя на ряд процессов, не связанных с их гиполипидемической активностью, в частности в высоких дозах они снижают уровень СРБ, улучшают фунцию эндотелия, а также усиливают противовоспалительные и регенеративные процессы в АСБ [5; 7].
Важным свойством статинов считают липофильность (способность к растворению в жировой среде). Наименьшей липофильностью обладают правастатин и розувастатин. Это означает, что они действуют в основном на уровне печеночных клеток и не проникают через клеточные мембраны, которые состоят из двойного слоя липидов, других органов и тканей. В этом есть свой положительный момент, заключающийся в меньшей вероятности повреждения мембран других клеток, например мышечной ткани, что присуще другим, более липофильным статинам. Подтверждением этого положения служит тот факт, что наименьшее число рабдомиолизов зарегистрировано у больных, принимавших правастатин.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
Клиническая значимость статинов подтверждена во многих клинических исследованиях, включивших в сумме более 170 тыс. пациентов. Часть из них представлена в табл. 9.30 [3;
8-16].
Эффективность статинов определяется как изначальной концентрацией липопротеинов в крови, так и дозировкой препаратов [1]. Два крупнейших метаанализа объединили основные клинические исследования и убедительно продемонстрировали, что агрессивная терапия статинами более существенно снижает концентрацию ХС-ЛПНП и ассоциирована со значительным уменьшением общего риска заболеваемости и смертности от ССЗ [2; 17]. Причем существенной разницы в эффективности лечения между мужчинами и женщинами показано не было.
Таблица 9.30. Обзор значимых клинических исследований гиполипидемических препаратов при лечении и профилактике сердечно-сосудистых заболеваний (адаптированно из [3])

Окончание табл. 9.30
Примечание. * - уменьшение риска при сравнении с контрольной группой; ХПН - хроническая почечная недостаточность; СД - сахарный диабет; ИБС - ишемическая болезнь сердца; ОКС - острый коронарный синдром; hsCRP* - высокочувствительный С- реактивный белок (международные нормы); РВ - реваскуляризационные вмешательства.
Как правило, статины назначают однократно во время вечернего приема пищи, поскольку синтез ХС наиболее интенсивно происходит в ночное время. Дозировка статинов и ожидаемые эффекты на липидный профиль представлены в табл. 9.31. Терапия статинами позволяет снизить ХС-ЛПНП на 20-60%, ТГ - на 10-35% и повысить уровень ХС-ЛПВП на 5-16% (табл. 9.31).
Таблица 9.31. Основные гиполипидемические препараты, их дозировки и ожидаемые эффекты на липидный профиль (адаптированно из [3])
Окончание табл. 9.31

Терапию рекомендуют начинать с минимальной дозы любого из статинов, постепенно титруя ее до оптимальной, позволяющей достигнуть целевого уровня ХС-ЛПНП. К назначению максимальной суточной дозы статинов обычно прибегают у больных ИБС с выраженной гиперхолестеринемией и наличием других сердечно-сосудистых ФР. Статины, назначаемые в высоких дозах (40-80 мг/сут), подавляют синтез ЛПОНП в печеночной клетке. Последние, как известно, служат предшественниками ЛПНП. При назначении максимальных доз статинов необходимо регулярно контролировать активность ферментов АЛТ, АСТ и КФК из-за высокой вероятности развития побочных эффектов (нарушения функции печени или развитие миопатии и рабдомиолиза).
ПОБОЧНЫЕ ЭФФЕКТЫ
Статины даже в высоких дозах хорошо переносят, однако их прием может сопровождаться болями в животе, метеоризмом, запорами, болью и слабостью в мышцах. Такие факторы, как пожилой возраст, низкий ИМТ, женский пол, почечная или печеночная недостаточность, периоперативный период, гипотиреоз и злоупотребление алкоголем, увеличивают риск развития побочных эффектов.
Самое серьезное осложнение приема статинов - миопатия с развитием рабдомиолиза и в последующем почечной недостаточности в результате блокирования почечных канальцев. КФК - основной маркер распада мышечной ткани, поэтому его повышение в 5 раз от верхнего предела нормы лаборатории при двух последовательных измерениях
