
6 курс / Кардиология / Кардиология_Национальное_руководство_Е_В_Шляхто_
.pdf
Антикоагулянты для парентерального введения
Основные фармакологические свойства антикоагулянтов для парентерального введения представлены в табл. 9.21.
Таблица 9.21. Фармакологические свойства антикоагулянтов для парентерального введения
Примечание. АВС - активированное время свертывания крови; АЧТВ - активированное частичное тромбопластиновое время; РЭС - ретикулоэндотелиальная система; ФСК - фактор свертывания крови.
НЕФРАКЦИОНИРОВАННЫЙ ГЕПАРИН
Механизм действия
Гепарин - антикоагулянт, синтезируемый тучными клетками (лаброцитами), базофилами, а также клетками других линий. Нефракционированный гепарин (НФГ) экстрагируют из органов домашних животных (в основном из слизистой оболочки кишечника свиней и бычьих легких). Он представляет собой смесь сильно сульфатированных полисахаридов (гликозамингликанов) разной молекулярной массы (300030 000 Да, в среднем около 15 000 Да).
Около трети полисахаридов, входящих в состав НФГ, способны связываться с антитромбином, значительно увеличивая способность антитромбина инактивировать ряд факторов свертывания крови (IIa, Ка, Ха, XIa и XIIa). Наиболее чувствительны к инактивации комплексом гепарина и антитромбина факторы свертывания крови Ха и особенно IIa (тромбин). В дальнейшем полисахариды могут отщепляться от образовавшегося комплекса антитромбина с фактором свертывания крови и взаимодействовать с новыми молекулами антитромбина.
Для инактивации фактора свертывания крови Ха достаточно связи с антитромбином участка молекулы гепарина, содержащего уникальную последовательность из пяти моносахаридов (пентасахарид). Для инактивации тромбина требуется образование связи молекулы гепарина как с антитромбином, так и с тромбином при участии еще как минимум 13 моносахаридов. Соответственно, молекулы, содержащие менее 18 моносахаридов, не способны катализировать инактивацию тромбина. Отношение активности против фактора свертывания крови Ха (анти-Ха) к активности против фактора свертывания крови На (анти-На) у НФГ составляет 1:1.
Независимо от сродства к антитромбину в высоких концентрациях НФГ способен связываться с кофактором гепарина II, способствуя инактивации тромбина; кроме того, в еще более высоких концентрациях НФГ угнетает образование фактора свертывания крови Ха без участия антитромбина и кофактора II.
Другие аспекты антикоагулянтного действия НФГ включают стимуляцию выделения ингибитора пути тканевого фактора, угнетающего комплекс тканевого фактора с фактором свертывания крови VIIa, а также инактивацию фактора фон Виллебранда, оказывающего проагрегантное действие. Их клиническое значение не ясно. Кроме того, НФГ образует соединение с остеобластами с последующей активацией остеокластов (что способствует остеопорозу), стимулирует высвобождение липопротеинлипазы. НФГ способен усиливать агрегацию тромбоцитов, а также повышать проницаемость сосудистой стенки.
Фармакокинетика
После внутривенного болюсного введения действие начинается немедленно и достаточно быстро достигает максимума. После начала внутривенной инфузии без болюсного введения эффект нарастает постепенно в зависимости от скорости инфузии; Т1/2 зависит от дозы и составляет примерно 90 мин (60-120 мин). При подкожном введении биодоступность составляет 10-40%, препарат начинает действовать через 20-60 мин; Т1/2составляет 8-12 ч.
При использовании терапевтических доз выведение НФГ из организма осуществляется преимущественно за счет быстронасыщаемого зависимого от дозы механизма (соединение с рецепторами эндотелиальных клеток и макрофагов с последующей деполимеризацией). В связи с этим увеличение интенсивности и длительности антикоагуляции происходит непропорционально повышению дозы препарата.
Т1/2 зависит от функции печени, почек, наличия некоторых заболеваний (ТЭЛА, инфекция).
Клиренс высокомолекулярных молекул НФГ осуществляется быстрее клиренса полисахаридов, обладающих низкой молекулярной массой.
Из-за выраженного отрицательного заряда НФГ неспецифически связывается с белками плазмы крови (включая белки острой фазы, тромбоцитарный фактор 4 и фактор фон Виллебранда), эндотелиальнами клетками и макрофагами. Это является причиной изменчивого и непредсказуемого антикоагулянтного действия и части случаев резистентности к препарату.
Особенности фармакокинетики и непостоянная антитромботическая активность различных партий НФГ определяют необходимость коагулологического контроля при индивидуальном подборе дозы препарата.
Особенности дозирования
Устойчивое антитромботическое действие НФГ следует поддерживать с помощью постоянной внутривенной инфузии или регулярных подкожных инъекций (в дозах, достаточных для преодоления низкой биодоступности). Для быстрого создания необходимой концентрации препарата в крови используют внутривенное болюсное введение. Учет МТ при выборе начальной дозы позволяет уменьшить риск достижения чрезмерного уровня антикоагуляции в начале лечения.
При использовании лечебных и высоких профилактических доз НФГ в широкой врачебной практике определяют активированное частичное тромбопластиновое время (АЧТВ), обычно коррелирующее с концентрацией препарата в крови 0,1-1 ЕД/мл. Абсолютные значения АЧТВ (в секундах) зависят от чувствительности реактива и особенностей методики определения, поэтому следует учитывать его относительное увеличение по отношению к нормальным (контрольным) значениям для конкретной лаборатории (верхняя граница нормы или среднее значение у здоровых лиц). При применении более высоких доз НФГ во время инвазивных внутрисосудистых вмешательств, гемодиализа, искусственного кровообращения (ИК) определяют активированное время свертывания (АВС) крови, которое линейно увеличивается при нарастании концентрации препарата в крови 1-5 ЕД/мл. Учитывают абсолютные значения показателя (в секундах). Менее доступное определение анти-Ха активности в крови, точнее характеризующее концентрацию НФГ, может потребоваться при резистентности к НФГ, антифосфолипидном синдроме (поскольку циркулирующий антикоагулянт удлиняет АЧТВ).
Непрерывная внутривенная инфузия под контролем АЧТВ - метод выбора, если требуется поддерживать терапевтический уровень антикоагуляции. Инфузию начинают после внутривенного введения болюса НФГ. В дальнейшем скорость инфузии (дозу) НФГ изменяют в зависимости от достигнутого АЧТВ. В зависимости от показаний стремятся к увеличению АЧТВ в 1,5-2,5 раза или в 1,5-2,0 раза по отношению к нормальному (контрольному) для лаборатории конкретного лечебного учреждения (конкретные дозы и особенности введения НФГ приведены в соответствующих главах данного Руководства). Вместе с тем есть свидетельства, что для большинства современных реактивов терапевтическому уровню НФГ в крови соответствует увеличение АЧТВ в 2,0-3,0 раза по отношению к контрольным. В связи с этим наилучший подход к определению терапевтических границ АЧТВ - предварительно установить соответствие между степенью удлинения АЧТВ и выраженностью угнетения фактора Ха свертывания крови
для конкретной лаборатории с учетом применяемого реактива, оборудования и препарата НФГ.
В начале введения НФГ и после любого изменения его дозы АЧТВ необходимо определять каждые 6 ч.
Переходить на более редкие определения АЧТВ (1 раз в 24 ч) можно не ранее, чем в двух последовательных анализах будут достигнуты терапевтические значения показателя. АЧТВ желательно оценить также до начала введения НФГ, однако откладывать начало лечения до получения результата не следует.
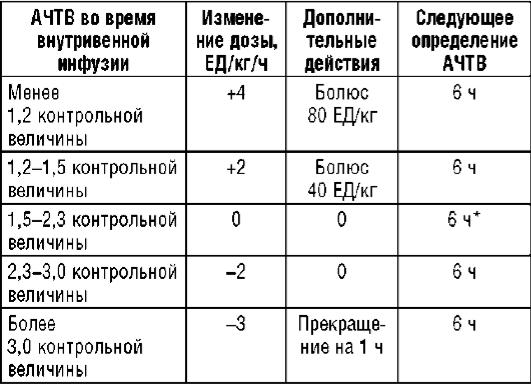
Для облегчения подбора дозы НФГ при его внутривенной инфузии используют протоколы (номограммы), регламентирующие характер изменения дозы препарата в зависимости от достигнутых значений АЧТВ. Абсолютные значения АЧТВ в каждой из номограмм необходимо рассчитать с учетом нормальных (контрольных) значений для лаборатории конкретного лечебного учреждения. Одна из номограмм, разработанных для лечения ТЭЛА, приведена ниже (табл. 9.22).
Таблица 9.22. Номограмма подбора дозы нефракционированного гепарина с использованием относительных изменений АЧТВ
Примечание. * - в первые 24 ч повторять каждые 6 ч; в дальнейшем, если АЧТВ не выходит за терапевтические границы, перейти на определение 1 раз в сутки (каждое утро).
У некоторых больных для поддержания терапевтических значений АЧТВ могут потребоваться более высокие, чем обычно, дозы НФГ. В случаях, когда приходится использовать суточную дозу, превышающую 35 000 ЕД, говорят о резистентности к НФГ. Этот феномен может быть связан как с уменьшением антитромботического действия НФГ, так и с пониженной способностью АЧТВ отражать содержание НФГ в крови (например, при высоком уровне фактора свертывания крови VIII, который уменьшает ответ АЧТВ, не затрагивая антитромботического действия НФГ). Причинами резистентности к НФГ могут быть:
•дефицит антитромбина;
•увеличенный клиренс НФГ;
•повышенное содержание белков, связывающих НФГ, включая фибриноген (в ответ на острое заболевание, беременность) и тромбоцитарный фактор 4;
•повышенный уровень фактора свертывания крови VIII;
•взаимодействие с апротинином;
•взаимодействие с нитроглицерином.
При выявлении лабораторной резистентности к НФГ его дозу рекомендуют подбирать, ориентируясь на анти-Ха активность препарата в крови. Терапевтическим считают уровень 0,3(0,35)-0,7 МЕ/мл.
Подкожное введение высоких (лечебных) доз НФГ под контролем АЧТВ обычно служит заменой внутривенных инфузий НФГ в случаях, когда требуется поддержание терапевтического уровня антикоагуляции в течение долгого времени (альтернатива - использование пероральных антикоагулянтов или лечебной дозы НМГ). Начальная доза составляет 250 ЕД/кг или 17 500 ЕД; в дальнейшем НФГ следует вводить каждые 12 ч под контролем АЧТВ (определять через 6 ч после инъекции). При устойчивых терапевтических значениях АЧТВ контроль рекомендуют осуществлять от 2 раз в неделю до 1 раза в 2 недели. Из-за особенностей фармакокинетики добиться поддержания достаточного уровня антикоагуляции с помощью подкожных введений НФГ достаточно трудно.
Подкожное введение низких (профилактических) доз НФГ используют для профилактики тромбоза глубоких вен и ТЭЛА. При этом НФГ вводят в дозе 5000 ЕД 2-3 раза в сутки; контроль АЧТВ не требуется.
Для профилактики тромбообразования в просвете катетеров, помещенных в просвет крупных сосудов, их периодически промывают небольшими порциями раствора, содержащего НФГ в дозе 100 ЕД/мл, или постоянно вводят раствор, содержащий НФГ в дозе 0,5-1 ЕД/мл; контроль АЧТВ не требуется.
Внутривенное болюсное введение высоких доз НФГ под контролем АВС крови используют для предотвращения тромбообразования при инвазивных вмешательствах. Действия препарата обычно хватает для выполнения недлительных процедур (например, ангиопластики/стентирования КА); при затянувшихся вмешательствах может потребоваться введение дополнительных болюсов или начало внутривенной инфузии НФГ.
Показания
•Раннее лечение ОКС (ИМ, НС).
•Профилактика и лечение тромбоза глубоких вен, ТЭЛА.
•Подготовка к кардиоверсии при ФП или ТП.
•Профилактика и лечение тромботических осложнений при наличии протезов клапанов сердца.
•Профилактика тромботических осложнений при манипуляциях в просвете сосудов, гемодиализе, ИК.
• Предотвращение тромбообразования в просвете внутрисосудистых катетеров.
Побочные эффекты
Наиболее частое осложнение при использовании НФГ - кровотечения. Их риск увеличивается при:
•сочетании НФС с другими антитромботическими ЛС;
•использовании слишком высоких доз НФГ;
•наличии потенциального источника кровотечения (недавнее хирургическое вмешательство, язва желудка или двенадцатиперстной кишки с недавним кровотечением и др.);
•бактериальном эндокардите;
•врожденных или приобретенных дефектах гемостаза;
•тромбоцитопении или нарушенной функции тромбоцитов;
•тяжелом заболевании печени;
•почечной недостаточности;
•высоком неконтролируемом АД;
•гипертонической или диабетической ретинопатии;
•инвазивных вмешательствах;
•возрасте старше 60 лет, особенно у женщин.
Для своевременного выявления кровотечения необходим активный поиск его признаков, включая регулярное определение содержания Hb и гематокрита. При любом значительном ухудшении состояния больного, получающего НФГ, необходимо определить АЧТВ, содержание Hb и гематокрит.
При возникновении кровотечений во многих случаях достаточно отмены НФГ. Антидот гепарина - протамина сульфат, вызывающий диссоциацию комплекса гепарина с антитромбином. 1 мг протамина сульфата нейтрализует 100 ЕД анти-На и анти-Ха активности НФГ. При выборе дозы следует учитывать количество введенного гепарина (его ожидаемое количество в крови с учетом способа введения и времени, прошедшего после последней инъекции НФГ или прекращения его инфузии). Т1/2 протамина сульфата составляет в среднем 90 мин (60-360 мин). После введения чрезмерных доз протамина сульфата или при слишком раннем прекращении его использования возможно возобновление кровотечений. Из-за опасности возникновения тяжелых побочных эффектов (брадикардия, артериальная гипотензия вплоть до шока, анафилактические реакции) препарат следует использовать только в случаях, когда требуется немедленное прекращение действия гепарина, вводить только внутривенно медленно, предварительно убедившись в отсутствии гиповолемии, и иметь наготове средства оказания неотложной помощи.
При введении гепарина может возникнуть тромбоцитопения. Обычно она незначительна, не требует лечения и проходит самопроизвольно (даже при продолжении введения НФГ).
Иммунная тромбоцитопения, вызванная гепарином, часто сочетается с тромбозами и является одним из наиболее тяжелых осложнений гепаринотерапии. Иммунная тромбоцитопения - следствие появления антител к комплексу гепарина и тромбоцитарного фактора 4; образовавшиеся иммунные комплексы вызывают активацию и агрегацию тромбоцитов, повреждение эндотелия сосудов и образование тромбина. Ее развития можно ожидать на 5-15-е сут при первом контакте с гепарином или раньше (иногда через несколько часов) у имевших контакт с гепарином в предшествующие несколько месяцев. В связи с этим в начале введения гепарина необходимо контролировать содержание тромбоцитов в крови ежедневно или хотя бы 1 раз в 2-3 дня в 4-14-е сутки или до более ранней отмены препарата. В случаях, когда больной получал препараты гепарина в ближайшие 3,5 мес, количество тромбоцитов следует оценить в первые 24 ч от начала введения НФГ, а при любом неожиданном ухудшении состояния больного в ближайшие 30 мин после внутривенного введения - немедленно. Критерии диагностики иммунной тромбоцитопении, вызванной гепарином, включают:
•появление тромбоцитопении во время введения гепарина (независимо от дозы);
•выраженное уменьшение содержания тромбоцитов в крови (более 50% исходного, особенно при их концентрации ниже 100х109/л);
•появление новых тромбозов, тромбоэмболий или некрозов кожи в местах введения гепарина (даже при отсутствии тромбоцитопении);
•отсутствие других причин тромбоцитопении;
•постепенное исчезновение тромбоцитопении после прекращения использования гепарина;
•положительные результаты лабораторных тестов (повышенная активация и агрегация тромбоцитов цитратной плазмы здорового донора или отмытых тромбоцитов в сыворотке или плазме крови больного в присутствии гепарина и/или выявление связывания антител с иммобилизованным комплексом тромбоцитарного фактора 4 и гепарина).
Подозрение на наличие иммунной тромбоцитопении - показание к немедленному прекращению любого использования гепарина (как НФГ, так и НМГ). До восстановления числа тромбоцитов (по крайней мере, выше 100х109/л) следует использовать ингибиторы тромбина прямого действия (бивалирудин); в последующем при сохранении потребности в антикоагулянтах можно начать использование пероральных антикоагулянтов (подбор дозы антагониста витамина К необходимо начинать с низких доз).
Другие побочные эффекты, описанные при использовании НФГ, включают:
•различные проявления аллергии;
•остеопороз (при длительном использовании высоких доз);
•гиперкалиемию (за счет угнетения синтеза альдостерона);
•головную боль, озноб, повышение температуры тела;
•тошноту, рвоту, запор;
•частую или длительную эрекцию;
•повышение активности трансаминаз (обычно бессимптомное; возможна нормализация при продолжении лечения);
•местные реакции в местах подкожных инъекций (раздражение, боль, гематома, редко - изъязвление, некроз кожи);
•периферическую нейропатию;
•облысение.
Противопоказания и предостережения НФГ противопоказан при:
•гиперчувствительности;
•содержании тромбоцитов в крови менее 100х109/л;
•иммунной тромбоцитопении, вызванной гепарином в анамнезе;
•неконтролируемом активном кровотечении (кроме связанного с наличием диссеминированного внутрисосудистого свертывания крови);
•предполагаемом внутричерепном кровотечении.
Из-за угрозы возникновения гематом гепарин нельзя вводить внутримышечно. Во время использования гепарина нежелательны любые внутримышечные инъекции.
У больных старше 60 лет легче возникает передозировка НФГ. У курильщиков и больных СД для достаточного увеличения АЧТВ могут потребоваться более высокие дозы НФГ. Требуется осторожность при наличии печеночной и/или почечной недостаточности. В случаях, когда антикоагулянтное действие во время операции нежелательно, внутривенную инфузию НФГ следует прекратить за 4-6 ч до вмешательства. Подкожные инъекции высокой дозы НФГ желательно заранее заменить более управляемой внутривенной инфузией или прекратить за 12-24 ч до вмешательства. При подкожном введении достаточно высокой дозы НФГ за 12 ч до операции во время нее возможно сохранение некоторого антикоагулянтного эффекта. НФГ не проникает через плаценту и в грудное молоко, не тератогенен, однако его применение у беременных и при кормлении грудью возможно только по строгим показаниям и при тщательном наблюдении.
Основные лекарственные взаимодействия
Риск кровотечений повышается при сочетании с другими антитромботическими ЛС, НПВП, цефалоспоринами, парентеральным введением пенициллина, некоторыми пищевыми продуктами (чеснок, зеленый чай, женьшень, гинкго, конский каштан, некоторые травяные сборы). Увеличение антикоагулянтного эффекта ожидается при сочетании с антигистаминными средствами, тетрациклином, хинидином, дигоксином; уменьшение - при внутривенной инфузии нитроглицерина. При одновременном использовании калийсберегающих диуретиков, ИАПФ, БРА повышен риск развития гиперкалиемии.
НИЗКОМОЛЕКУЛЯРНЫЕ ГЕПАРИНЫ
Низкомолекулярные гепарины (НМГ) получают в результате химической или ферментативной деполимеризации НФГ. НМГ состоят из смеси полисахаридов с более
низкой молекулярной массой -100010 000 Да, в среднем 4000-6000 Да. В РФ зарегистрированы бемипарин натрия, дальтепарин натрия, надропарин кальция и эноксапарин натрия.
Механизм действия Механизм действия у НМГ и НФГ сходен, однако имеются и некоторые различия:
•из-за преобладания более коротких полисахаридных цепей НМГ в большей степени способствуют нейтрализации антитромбином фактора свертывания крови Ха, чем тромбина;
•НМГ в большей степени стимулируют высвобождение ингибитора пути тканевого фактора и предупреждают острофазовое увеличение уровня фактора фон Виллебранда в крови;
•НМГ меньше связываются с тромбоцитами, тромбоцитарным фактором 4 и остеобластами.
Эти свойства лежат в основе менее выраженной способности активировать тромбоциты, вызывать иммунную тромбоцитопению и остеопороз.
Фармакокинетика
После внутривенного введения НМГ действие начинается немедленно, максимальная анти-Ха и анти-??а активность в плазме крови достигается примерно за 5 мин. В зависимости от дозы и препарата повышенная анти-Ха активность может сохраняться в течение 5-8 ч; анти-??а активность изчезает быстрее (за 2-4 ч).
При подкожном введении биодоступность НМГ составляет как минимум 90%. Максимальная анти-Ха активность в плазме крови достигается через 3-4 ч и сохраняется повышенной не менее 12 ч (зависит от дозы и препарата). Соответственно, при применении НМГ для поддержания устойчивого уровня антикоагуляции нет необходимости проводить постоянную внутривенную инфузию; достигнуть желаемого эффекта можно при подкожном введении 1-2 раза в сутки.
НМГ в значительно меньшей степени, чем НФГ, неспецифически связываются с белками крови, эндотелиальными клетками и макрофагами.
Выведение НМГ осуществляется преимущественно почками (ненасыщаемый линейный механизм элиминации) и не зависит от дозы. При почечной недостаточности клиренс анти-Ха и анти-??а активностей в плазме крови уменьшается (особенно выраженные изменения происходят при СКФ <30 мл/мин). При беременности фармакокинетика НМГ может меняться из-за изменения объема распределения и увеличения клубочковой фильтрации.
Из-за лучшей биодоступности, более длительного T1/2 и клиренса, не зависящего от дозы, ответ на введение НМГ более предсказуем, чем на введение НФГ.
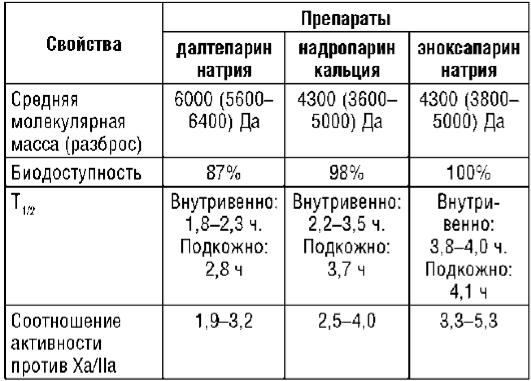
Препараты НМГ получают из НФГ с помощью различных химических процессов; в итоге они заметно различаются по составу и биологической активности (табл. 9.23). В связи с этим их рассматривают как отдельные, не взаимозаменяемые ЛС. Соответственно, результаты, полученные с одним НМГ, нельзя механически переносить на другие препараты, относящиеся к этой группе. Выбор НМГ и подходы к дозированию должны
основываться на данных об эффективности и безопасности, полученных в клинических исследованиях с каждым конкретным препаратом по каждому конкретному показанию. Из-за сложности, непостоянства и недостаточной изученности химического состава при воспроизведении оригинальных препаратов НМГ можно создать только в чем-то похожее, но не абсолютно идентичное ЛС (биологический аналог). Проблема клинической взаимозаменяемости оригинальных препаратов НМГ и их биологических аналогов пока не решена.
Таблица 9.23. Некоторые свойства препаратов низкомолекулярного гепарина (на основании анти-Ха активности)
Особенности дозирования
НМГ дозируют в единицах активности против Ха фактора свертывания крови (анти-Ха МЕ). Схема дозирования каждого НМГ индивидуальна и представлена в аннотациях к препаратам. При введении лечебных доз НМГ может удлиняться АЧТВ, но этот показатель отражает в основном действие препаратов на тромбин и только частично характеризует антитромботическую активность НМГ. Практическое значение влияния НМГ на другие составляющие процесса свертывания крови пока не определено.
С учетом достаточно предсказуемой фармакокинетики полагают, что для выбора лечебной дозы НМГ в большинстве случаев можно ориентироваться только на массу тела больного. Эффективность и безопасность такого подхода продемонстрированы во многих клинических исследованиях. Схема дозирования отдельных НМГ предполагает предварительное внутривенное введение болюса. Для профилактики венозных тромбозов используют как фиксированные (без учета МТ), так и подобранные по ней дозы НМГ (особенности дозирования зависят от показания, степени риска и препарата). Имеются данные о возможности проведения внутрисосудистых манипуляций на КА после внутривенного болюсного введения НМГ (эноксапарина) без обязательного контроля достигнутого уровня антикоагуляции.
Коррекция дозы с учетом анти-Ха активности в крови может потребоваться при СКФ <30 мл/мин, беременности, выраженном ожирении. При этом рекомендуют поддерживать
