
6 курс / Кардиология / Кардиология_Национальное_руководство_Е_В_Шляхто_
.pdfсегментов. За сходство со специальным приспособлением, используемым в Японии для ловли осьминогов, имеющем форму округлого горшка с узким горлышком, называемым в Японии такотсубо, этот синдром и получил свое название. При этом синдроме часто отмечаются инфарктоподобные изменения сегмента ST-T на ЭКГ, отсутствие или незначительное повышение уровня кардиоспецифичных ферментов. Пусковым фактором часто является физический или эмоциональный стресс. МРТ позволяет выявить характерные признаки синдрома, а также исключить инфаркт, что позволяет дифференцировать синдром такотсубо с острым ИМ. Однако до сих пор не прекращаются споры, считать ли КМП такотсубо отдельной нозологической единицей или нет.
В целом при подозрении на наличие у пациента КМП следует по возможности использовать помимо обычных методов исследования МРТ и МСКТ. Оба этих метода заняли одно из основных мест в диагностике КМП.
МРТ в диагностике заболеваний перикарда
Обычно для диагностики заболеваний перикарда вполне достаточно ЭхоКГ исследования. Изменения околосердечной сумки (скопление жидкости, утолщение листков перикарда, их обызвествление) хорошо видны при КТ. В проблемных случаях можно использовать МРТ. Как известно, в норме между листками перикарда содержится тонкий слой жидкости (не более 50 мл). Обычно на МР-изображениях можно видеть границу между листками перикарда в виде тонкой темной полосы. Она особенно хорошо видна в области правых отделов и при хорошей выраженности эпикардиального жира. Даже небольшие скопления жидкости в сердечной сумке хорошо видны при МРТ. Метод может помочь в случаях ограниченных, локализованных скоплений жидкости, особенно необычной локализации. МРТ позволяет отличить негеморрагические экссудаты от геморрагических (последние характеризует высокая интенсивность сигнала). При МРТ хорошо определяется утолщение листков перикарда. Их толщина более 3-4 мм (при соответствующих клинических данных) указывает на констриктивный перикардит. При этой патологии характерно увеличение предсердий при нормальном или уменьшенном объеме желудочков, нарушенное диастолическое заполнение ЛЖ и ПЖ, расширение НПВ и верхней полой вены. При свободных скоплениях жидкости в сердечной сумке их локализация и распределение зависят от объема и состава экссудата (транссудата). Поскольку МРТ обычно выполняют в положении лежа на спине, при небольших объемах жидкость определяется в области правых отделов сердца и в верхних отделах перикарда. Если в жидкости имеется значительная примесь белка, клеток крови, может отмечаться повышение интенсивности сигнала от нижних слоев экссудата (за задней стенкой сердца) из-за частичной седиментации содержимого. Иногда при больших скоплениях жидкости качество МР-изображений снижается из-за артефактов, связанных с хаотичными сигналами от жидкости, и плохой синхронизации с ЭКГ. При МРТ, в отличие от КТ, нельзя со 100% уверенностью высказаться о наличии кальцинатов в перикарде.
МРТ в диагностике опухолей сердца и средостения
Несмотря на сравнительно малую распространенность, опухоли сердца представляют собой серьезную клиническую проблему. Это связано с тяжестью течения заболевания, трудностями его диагностики и лечения. Частота случаев опухолей сердца, по данным аутопсий, составляет 0,001-0,28%. Развитие и совершенствование ЭхоКГ облегчило диагностику опухолей сердца. В настоящее время она является первой и основной в ряду неинвазивных методик визуализации сердца. Однако часто при обследовании пациентов
с опухолями сердца, особенно при их экстракардиальном распространении, возникает необходимость применения еще одной неинвазивной методики с большим полем изображения. В связи с этим при диагностике опухолей сердца решающее значение имеют такие достоинства МРТ, как свободное от артефактов получение изображений сердца в любой плоскости, хорошая визуализация структур средостения, хороший мягкотканный контраст, чувствительность к скорости и характеру тока крови. Как известно, наиболее часто встречающиеся опухоли предсердий у взрослых - миксомы, которые могут локализоваться в левом или правом предсердии, а они также могут быть биатриальными. На МР-изображениях миксомы выглядят как объемные образования округлой формы, с ровными четкими контурами, с промежуточной интенсивностью МРсигнала на Т1-ВИ, неоднородной структурой за счет наличия участков некроза и кровоизлияний. Практически во всех случаях удается установить источник роста опухоли: типично из МПП, иногда из области овального окна, реже определяется нетипичное место прикрепления - задняя стенка ЛП. В небольшом количестве случаев четко установить место фиксации опухоли невозможно. Как правило, в этих случаях речь идет об образованиях, заполняющих большую часть предсердий, тесно соприкасающихся со стенками предсердий, фиксированных. Следует отметить, что при диагностике миксом следует использовать как последовательность «спин-эхо», так и кино-МРТ, поскольку на изображениях, полученных по методике «спин-эхо», границы образований иногда выглядят нечеткими, размытыми, опухоль не всегда легко отличается от сигнала от кровотока.
Кино-МРТ позволяет преодолевать это ограничение: опухоль четко визуализируется на фоне яркого сигнала от крови, можно увидеть пролабирование миксомы в левое или правое АВ-отверстие, а также выявить низкоинтенсивные турбулентные потоки крови, обтекаюшие миксому или вызванные динамической обструкцией опухолью приносящего тракта ЛЖ или ПЖ. В некоторых случаях (когда МР-картина подозрительна на внутрисердечный тромбоз) для установления точного диагноза возникает необходимость во введении контрастного препарата. После введения гадолиния отмечается значительное усиление интенсивности МР-сигнала от образования, что свидетельствует о его васкуляризации и позволяет отвергнуть диагноз тромбоза.
Наиболее простой является МР-диагностика липом сердца. Анализ характеристик МРсигнала, типичных для жировой ткани (повышение интенсивности на Т1- и Т2взвешенных изображениях), позволяет точно поставить диагноз. При диагностике эхинококкоза сердца внутри полости ЛЖ визуализируются кистозные структуры большого диаметра с тонкими стенками и низкоинтенсивным содержимым, дающим МРсигнал, характерный для жидкости с примесью белка.
При выявлении сарком сердца (чаще всего встречаются ангиосаркомы) МРТ позволяет отчетливо продемонстрировать инвазивный характер роста опухоли, оценить ее распространенность (рис. 6.99, см. цв. вклейку). У больных с раком правой почки в случае прорастания опухоли в почечную вену и НПВ с распространением вверх до нижних отделов правой почки образование в правой почке представляет собой опухолевый тромб. В этой подгруппе больных МРТ особенно информативна. На сагиттальных и фронтальных изображениях четко визуализируется первичная опухоль, ее рост по почечной вене в полую вену, прохождение опухолевой массы через печеночный сегмент и вхождение в правую почку. При контрастном усилении гадолинием отмечается усиление интенсивности образования, что подтверждает его опухолевой генез. Важным дополнением к исследованию являются программы МР-ангиографии и МР-флебографии. На них лучше визуализируются остаточный просвет вены, участки реканализации
опухолевого тромба, состояние устьев печеночных вен. Результаты МРТ исследования у этих больных позволяют лучше оценить распространенность опухоли и спланировать ход оперативного лечения, а в дальнейшем - оценить его результаты.
МРТ хорошо рекомендовала себя в оценке результатов оперативного лечения объемных образований сердца. Учитывая относительную редкость опухолей сердца, представляется, что МРТ сердца должна проводиться, при возможности, всем пациентам с предполагаемыми, а также с выявленными опухолями сердца при планирующемся оперативном лечении.
МРТ в диагностике заболеваний грудной аорты
К настоящему времени убедительно доказано, что чреспищеводная эхокардиография (ЧПЭ), МРТ и КТ - надежные методы диагностики аневризм и коарктаций грудной и брюшной аорты. Диагностика аневризм аорты с помощью МРТ не представляет никаких трудностей - уже на поперечных срезах можно отчетливо видеть аневризму и анализировать ее характеристики (диаметр, толщина стенок, взаимоотношение с соседними структурами, устьями КА, наличие расслоения, тромбов и др.). Наклонные срезы по ходу аорты позволяют отчетливо увидеть протяженность аневризмы, оценить диаметр перешейка в месте перехода на неизмененную аорту (что является важным для формирования дистального анастомоза с целью выбора кондуита соответствующего диаметра). Расслоение аневризмы проявляется как второй контур внутри просвета аорты; при разной скорости кровотока в истинном и ложном просветах интенсивность крови в них была различной (более высокой при медленном кровотоке). Косые срезы дают дополнительную информацию о топографии расслоения, соотношении истинного и ложного просветов, наличии и локализации фенестраций. Чувствительность и специфичность МРТ в диагностике расслоения аорты, по данным различных авторов, достигает 100%. МРТ позволяет оценивать диаметр и протяженность аневризмы, состояние ее стенок, наличие пристеночных тромбов, расслоения и его распространения, взаимоотношение отслоившейся интимы с сосудами дуги аорты, КА, наличие фенестраций, АН, размеры и функцию камер сердца. При необходимости исследование может быть дополнено изучением брюшной аорты и ее ветвей или брахиоцефальных артерий. В этом случае может быть использована МР-ангиография с контрастным усилением гадолинием, которая позволяет получать трехмерные реконструкции ветвей грудной и брюшной аорты, анализировать распространение расслоения и взаимоотношение отслоившейся интимы с устьями магистральных артерий. Наиболее оптимально выполнение исследования на задержке дыхания, по ходу аорты.
При послеоперационном обследовании с помощью МРТ можно изучать состояние кондуита и коронарного протеза, мест анастомозов, парапротезного пространства и его соустья с ПП; аорты выше дистального анастомоза; наличие резидуального расслоения; динамику состояния камер сердца (размеры, объемы, масса миокарда).
МР-ангиография коронарных артерий
Существует достаточно большое число публикаций об использовании МРТ (методика МР-ангиографии) для выявления стенозов КА у больных с ИБС.
Методика МР-КАГ достаточно сложна. Для ее выполнения требуются высокопольный томограф с полем 1,5 или 3 тесла, специальная радиочастотная катушка для сердца или
грудной клетки, устройство для синхронизации с ЭКГ и специальное программное обеспечение.
МР-ангиография основана на быстрых градиентных импульсных последовательностях, при которых сигнал от движущейся крови выглядит ярким. При исследовании коронарных сосудов применяют подавление сигнала от эпикардиального жира. Импульсные последовательности для получения МР-ангиограмм КА могут быть двухмерными (несколько срезов толщиной 2-3 мм, получаемых при задержке дыхания) либо (что более предпочтительно) трехмерными. В этом случае объемные области (толщиной 20-40 мм) помещают вдоль хода КА и выполняют исследование на задержке дыхания либо при свободном дыхании, применяя синхронизацию сбора данных с движением диафрагмы. Пространственное разрешение в этом случае приближается к 1 мм. Для усиления сигнала от крови может использоваться внутривенное болюсное введение гадолиниевых контрастных агентов, однако, в отличие от КТ, оно не является обязательным. Общее время выполнения МР-ангиографии КА существенно больше, чем у КТ, и составляет 20-40 мин. Соответственно этому растет риск появления артефактов от движений пациента и дыхания.
На основании данных проведенных клинических исследований показатели чувствительности и специфичности коронарной МР-ангиографии колеблются в пределах 75-90 и 77-85% соответственно. Однако процент неудачных исследований составляет 1540%, что существенно хуже, чем в случае КТ. Кроме того, МРТ обладает более низким (по сравнению с КТ) пространственным разрешением, требует для выполнения гораздо больше времени (20-50 мин) и более чувствительна к различным артефактам. При прямом сопоставлении КТ-ангиографии и МР-ангиографии лучшие показатели были у первой методики.
Всвязи с меньшей надежностью диагностики, невозможностью надежного выявления коронарного кальциноза, большей длительностью исследования и меньшей доступностью МР-установок, пригодных для исследований КА, МР-КАГ на сегодняшний день пока по-прежнему применяют в основном в исследовательских целях, а КТангиографию уже широко используют в клинической практике.
Всвоем современном варианте МРТ пока не показана для диагностики стенозов в КА в условиях повседневной практики.
Заключение
Опыт использования МРТ сердца и сосудов показывает, что при правильно выбранных показаниях к исследованию и оптмизированном подходе к его выполнению этот метод существенно улучшает диагностику ССЗ.
Мировой опыт использования МРТ показал, что с практической точки зрения наибольшую практическую значимость имеет ее применение в следующих случаях:
•основное показание к МРТ сердца: уточнение данных ЭхоКГ (анатомия и функция камер сердца, состояние клапанного аппарата, наличие интра- и паракардиальных объемных образований) в сомнительных случаях;
•МРТ может применяться при болезнях аорты и ЛА (как альтернатива МСКТ);
•подозрение на опухоль сердца, артимогенную КПМ ПЖ, апикальную ГКМП;
•изучение жизнеспособности и перфузии миокарда при ИБС (по показаниям);
•обследование пациентов со сложными ВПС (особенно в тех случаях, когда требуется оценка анатомии магистральных сосудов или количественная оценка кровотока по ним);
•точная количественная оценка массы миокарда, объемов желудочков, а также их общей и сократительной функции (например, в научных исследованиях по оценке эффективности различных видов терапии);
•неинвазивная диагностика врожденных аномалий и аневризм КА, выявление окклюзий венозных и аортальных коронарных шунтов с помощью МР-КАГ (как альтернатива МСКТ).
Другие показания к применению МРТ (например, изучение структуры АСБ, спектроскопия сердца) пока являются исследовательскими и не применяются в клинической практике. По мере совершенствования МРТ и накопления опыта ее применения показания к ее использованию будут меняться.
Список литературы
1.Беленков Ю.Н., Терновой С.К., Синицын В.Е. Магнитно-резонансная томография сердца и сосудов. - М.: Видар, 1997.
2.Трамовиг В.В., Синицын В.Е., Гордин М.П. и др. Количественная оценка перфузии миокарда с помощью магнитно-резонансной томографии // Кардиология. - 2004. - № 8. -
С. 4-12.
3.Ринк П.А. Магнитный резонанс в медицине. - М.: ГЭОТАР-Медиа, 2003.
4.Синицын В.Е. Магнитно-резонансная томография сердца // В кн.: Национальное руководство «Кардиология» / Под ред. Ю.Н. Беленкова, Р.Г. Оганова. - М.: ГЭОТАР-Медиа,
2007. - С. 84-88.
5.Синицын В.Е., Терновой С.К. Магнитно-резонансная томография в новом столетии. // Радиология-практика. - 2005. - № 4. - С. 17-22.
6.Bunce N.H., Pennell D.J. Magnetic resonance of coronary arteries // Eur. Radiol. - 2001. - Vol. 11(5). - P. 721731.
7.Cardiovascular Magnetic Resonance. Eds.W.J. Manning, D.J. Pennell. - Churchill Livingstone, NY, 2002.
8.Coronary Radiology. Ed. M.Oudkerk. - Springer, 2004.
9.Gerber B.L., Garot J., Bluemke D.A. et al. Accuracy of contrast-enhanced magnetic resonance imaging in predicting improvement of regional myocardial function in patients after acute myocardial infarction // Circulation. - 2002. - Vol. 106. - P. 1083-1089.
10.Hendel R.C. et al. ACCF/ACR/SCCT/SCMR/ASNC/ NASCI/SCAI/SIR Appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging // J. Am. Coll. Cardiol. - 2006. - Vol. 48(7). - P. 1475-1497.
11.Pennell D.J., Sechtem U.P., Higgins C.B. et al. Clinical indications for cardiovascular magnetic resonance (CMR): Consensus Panel report // European Heart Journal. -2004. - Vol. 25. - P. 1940-1965.
ДРУГИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Оптическая когерентная томография в кардиологической практике (А.В. Козленок)
Несмотря на значительный успех, достигнутый в последние десятилетия в области диагностики и лечения ИБС, все еще остается актуальным вопрос повышения объема и качества информации, получаемой при исследовании коронарного русла. Наряду с уже прочно вошедшими в ежедневную практику селективной ангиографией КА, МСКТ и ВСУЗИ, развиваются методы дополнительной визуализации и обработки сигнала, обладающие уникальными свойствами. К их числу относят оптическую когерентную томографию (ОКТ), инфракрасную спектроскопию ближнего поля, прямую коронарную ангиоскопию и внутрисосудистую эластографию. Наиболее перспективной методикой в настоящее время признается ОКТ, которая будет более подробно описана далее.
Принцип ОКТ состоит в освещении изучаемого объекта оптическим излучением с последующим определением степени отражения и рассеивания этого излучения по глубине среды. Техника проведения ОКТ напоминает технику ВСУЗИ и заключается в помещении в просвет сосуда эндоскопического зонда с излучателем и воспринимающим устройством. Таким образом, данный вид исследования аналогичен ультразвуковому, но с той разницей, что при нем для визуализации слоев изучаемого объекта используют не звуковые, а световые волны, имеющие много меньшую длину волны (700-1300 нм). Эта особенность многократно увеличивает пространственное разрешение метода, однако в равной степени уменьшает его проникающую способность. Так, современные системы ОКТ позволяют различать в просвете сосуда объекты величиной от 5 мкм и видеть структуру его стенки на протяжении 2,0 мм, тогда как при ВСУЗИ эти показатели составляют 100-200 мкм и 10 мм соответственно. На рис. 6.100 (см. цв. вклейку) представлено изображение неизмененной КА, на котором можно отчетливо различить слои стенки сосуда. Такая детализация структуры сегодня недостижима для любого другого метода диагностики in vivo, что делает ОКТ уникальным инструментом для изучения морфогенеза атеросклероза и оценки качества малоинвазивных хирургических вмешательств.
ОКТ позволяет не просто оценивать наличие и выраженность стенозирования пораженного сосуда, но и обладает значительным потенциалом в идентификации тонких процессов, обычно видимых только при гистологическом исследовании. Несмотря на то, что для использования всех возможностей этого метода на практике требуется проведение дополнительных клинических испытаний, уже на данный момент очевидна его применимость для выявления нестабильной бляшки с тонкой или поврежденной фиброзной капсулой, визуализации ангиогенеза и кровоизлияния в толще бляшки, оценки наличия в ней воспалительных клеток - кластеров лимфоцитов и макрофагов, определения типа соединительной ткани, отслеживания эффективности терапевтических мероприятий.
Крайне важной является возможность детальной оценки состояния имплантируемых стентов, в том числе биодеградируемых. ОКТ намного более точно, чем ВСУЗИ, позволяет непосредственно во время вмешательства, а также в отдаленном периоде увидеть позицию страт относительно интимы (неполное прилегание или протрузию), оценить наличие тромботических наслоений и гиперплазированной неоинтимы внутри стентированного участка, идентифицировать краевую диссекцию интимы на самых ранних стадиях ее появления.
Сравнительные изображения ВСУЗИ и ОКТ, дающие представление о преимуществах последней, приведены на рис. 6.101 (см. цв. вклейку).
Основные ограничения ОКТ - небольшая проникающая способность и необходимость кратковременной искусственной окклюзии кровотока в зоне исследования с отмыванием просвета сосуда прозрачным раствором. Последнее требование связано с тем, что эритроциты рассеивают излучение, используемое при ОКТ, и препятствуют получению качественного изображения. Однако в последние годы происходит постоянное и быстрое развитие технологии исследования. На смену довольно медленной методике во временном диапазоне (20 кадров в секунду) приходит ОКТ в частотном диапазоне, которая не требует проксимальной окклюзии кровотока и отличается быстродействием (до 100 кадров в секунду) при той же разрешающей способности. Это позволяет строить трехмерные изображения длинных участков артерий за несколько секунд без опасности появления или усугубления ишемии миокарда, в том числе на уровне устьев главных КА. Кроме того, в настоящее время развиваются способы автоматической обработки получаемых изображений, которые позволят избежать субъективных ошибок при интерпретации конкретных компонентов строения стенки сосуда.
Таким образом, ОКТ сегодня признана безопасным, высокоэффективным, недорогим и постоянно совершенствующимся методом диагностики, который весьма вероятно в ближайшее время станет «золотым стандартом» оценки коронарного русла у пациентов с ИБС.
Кардиопульмональный нагрузочный тест (А.В. Березина)
Уровень физической работоспособности, характеризующий способность индивидуума выполнять максимальную ФН, - один из критериев здоровья человека, поэтому его оценка имеет важное диагностическое и прогностическое значение. Потребление кислорода при ФН - строгий количественно измеряемый параметр, характеризующий уровень физической работоспособности. Эталонный метод оценки уровня физической работоспособности - кардиопульмональный нагрузочный тест (КПНТ) или спироэргометрия, объединяющий тест с ФН с одновременной оценкой газообмена в условиях ФН, что позволяет проследить за всем процессом доставки и утилизации кислорода в организме от внешнего до тканевого дыхания. С помощью КПНТ возможно оценить работу всех систем и органов, участвующих в обеспечении организма кислородом (ССС, легочная система и система крови), а также его утилизацию (мышечная система) и выявить неадекватно функционирующий орган или систему в условиях ФН. Преимущества этой методики очевидны:
•определяется уровень потребления кислорода;
•комплексно и интегрально оценивается работа всех систем организма, обеспечивающих доставку кислорода.
Таким образом, основные задачи КПНТ - обнаружение систем и конкретных механизмов, лимитирующих выполнение нагрузки, а также объективная оценка функциональных резервов организма. Показания для применения теста [1]:
•оценка физической работоспособности;
•дифференциальная диагностика расстройств, вызывающих неясное снижение физической работоспособности;
•оценка пациентов с ССЗ:
- ИБС: диагностика ишемии у больных с измененной ЭКГ (БЛНПГ, систолическая перегрузка ЛЖ и другие изменения реполяризации), безболевая ишемия миокарда (ББИ);
-СН: диагностика ранних стадий СН, оценка эффективности терапии;
-ВПС: диагностика шунта «справа-налево», возникающего во время нагрузки;
•аритмии и ЭКС: гемодинамическая значимость, диагностика нарушений в работе;
•оценка пациентов с респираторными заболеваниями:
•дифференциальная диагностика заболеваний легких (интерстициальные болезни легких, ХОБЛ, заболевания легочных сосудов и др.);
•бронхоспазм, индуцируемый ФН;
•дифференциальная диагностика одышки;
•полная оценка газообмена;
•предоперационная оценка пациентов, направляемых на резекцию легких, бариатрические вмешательства;
•отбор больных на трансплантацию сердца (ТС) и легких;
•диагностика болезней с нарушением биоэнергетической функции мышц (миопатии и др.);
•подбор тренирующих программ для реабилитации пациентов с сердечно-сосудистыми и легочными заболеваниями;
•использование в спортивной медицине: оценка физической работоспособности и подбор тренирующих программ для спортсменов.
Кардиопульмональный нагрузочный тест имеет две модификации: неинвазивную и инвазивную.
Неинвазивная методика КПНТ позволяет одновременно регистрировать показатели вентиляции (VE, Fr, Vt), газообмена (концентрации О2 и СО2 в выдыхаемом воздухе) и ССС
(ЭКГ, ЧСС, АД) во время пробы с ФН определенной мощности (WR). На основании этих данных рассчитывают наиболее важные показатели, такие как пиковое значение
потребления кислорода (VO2peak), анаэробный порог (AT), кислородный пульс (O2pulse), максимальная вентиляция (VEmax), вентиляторные эквиваленты по кислороду и углекислоте
(VE/VO2, VE/VCO2) и др. Параллельно измеряют АД и сатурацию кислорода с помощью пульсоксиметра (SpO2).
При инвазивной методике, помимо вышеперечисленного, измеряют парциальные давления O2 и CO2 в артериальной крови (PaO2, PaCO2), pH, лактат, SaO2, отношение мертвого пространства к дыхательному объему (Vd/Vt), альвеолярно-артериальную разницу по кислороду P(A-a)O2 и др. Забор артериальной крови производят с помощью катетера, введенного в лучевую артерию. Пробы артериальной крови берут несколько раз на протяжении теста: в покое, в конце разминки, каждую минуту нагрузки и на 2-й минуте восстановительного периода. На рис. 6.102 представлены основные приборы и показатели, используемые для выполнения КПНТ [2].
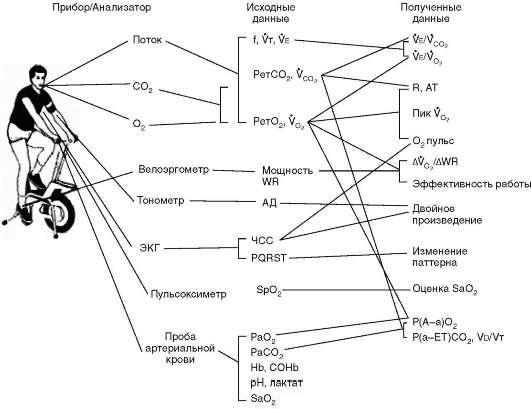
Рис. 6.102. Оборудование и показатели кардиопульмонального нагрузочного теста
Современное оборудование позволяет определять потребление кислорода и выделение углекислого газа непрерывно (breath by breath метод) с помощью газоанализатора. Данные теста регистрируют в режиме on-line и изображают в виде графиков и таблиц. ФН при КПНТ выполняют на тредмиле или велосипеде, используются стандартные или индивидуально подобранные нагрузочные протоколы; противопоказания к проведению теста такие же, как и для обычной пробы с ФН. Основа интерпретации теста - сравнительная оценка полученных результатов и должных значений.
Важные интегральные показатели КПНТ, отражающие адекватность доставки кислорода, - максимальное или пиковое потребление кислорода (VO2max, VO2peak) и анаэробный порог. VO2max определяется как наивысшая величина потребления кислорода, которая не изменяется (плато - leveling off), даже несмотря на дальнейшее увеличение мощности ФН. VO2max могут достигнуть только хорошо тренированные люди или спортсмены, поэтому чаще всего при спироэргометрии оценивают пиковое потребление кислорода. VO2peak - это тот наивысший уровень потребления кислорода, которого достиг человек при выполнении ФН. Анаэробный порог (АП) - это такой уровень потребления кислорода при ФН, на котором к процессу аэробного пути образования энергии присоединяется анаэробный, что сопровождается увеличением уровня лактата в крови, накоплением ионов водорода и развитием метаболического ацидоза.
В настоящее время доказано, что пиковое потребление кислорода (VO2peak), потребление кислорода на уровне анаэробного порога, вентиляторный эквивалент CO2 (VE/VCO2), определяемые при КПНТ, имеют высокую прогностическую значимость у больных ХСН. Так, VO2peak <14 мл/кг/мин у больных с ХСН ассоциируется с низкой выживаемостью в течение года и поэтому является одним из критериев отбора больных на ТС [3; 4]. Также установлено, что VE/ VCO2 >34 является пограничным значением, разделяющим благоприятное и неблагоприятное течение ХСН. Риск смерти прогрессивно увеличивается, если значение VE/VCO2 возрастает от нормы (<30) до >40 при
наблюдении в динамике. Наихудший прогноз выявлен у больных ХСН с сочетанием
VO2peak <10 мл/ кг/мин и VE/VCO2 >40 [5]. Риск неблагоприятных событий у больных ХСН увеличивается при значении потребления О2 на уровне анаэробного порога менее 11
мл/кг/мин.
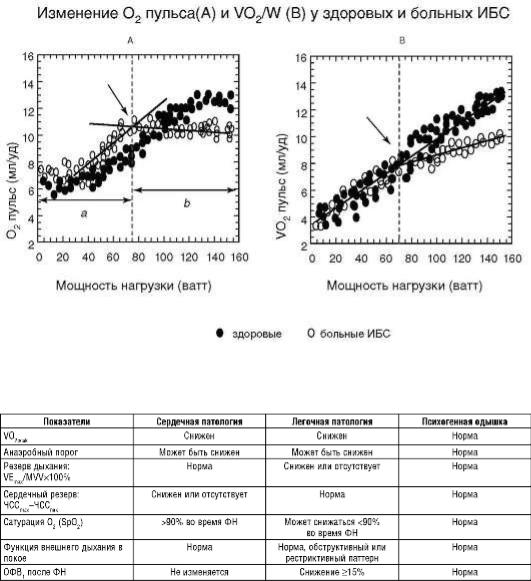
КПНТ - объективный метод, позволяющий диагностировать стресс-индуцируемую ишемию миокарда у лиц с подозрением на ИБС и измененной ЭКГ или атипичным болевым синдромом. В ходе теста возможно определить снижение УО вследствие индуцированной ишемией дисфункции ЛЖ, что характеризуется ранним снижением прироста кислородного пульса и доставки О2 на выполняемую работу [6] (рис. 6.103).
Наиболее распространенная жалоба, заставляющая пациента прекратить выполнение ФН, - одышка. Именно КПНТ позволяет клиницисту выявить генез данного синдрома [7] (табл. 6.26).
Рис. 6.103. Кардиопульмональный нагрузочный тест Таблица 6.26. Дифференциальная диагностика одышки
Примечание: VO2peak - пиковое потребление кислорода; MVV - максимальная произвольная вентиляция; ОФВ1 - объем форсированного выдоха за 1 с.
Таким образом, при КПНТ клиницист получает уникальную и разностороннюю информацию о компенсаторных возможностях и функциональном состоянии не только
ССС, но и других систем, обеспечивающих адекватную жизнедеятельность организма, что позволяет дать комплексную оценку состояния здоровья человека.
