6 курс / Диетология и нутрициология / Спортивная_нутрициология_Дмитриев_А_В_,_Гунина_Л_М
.pdf


422 |
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
|
|
|
|
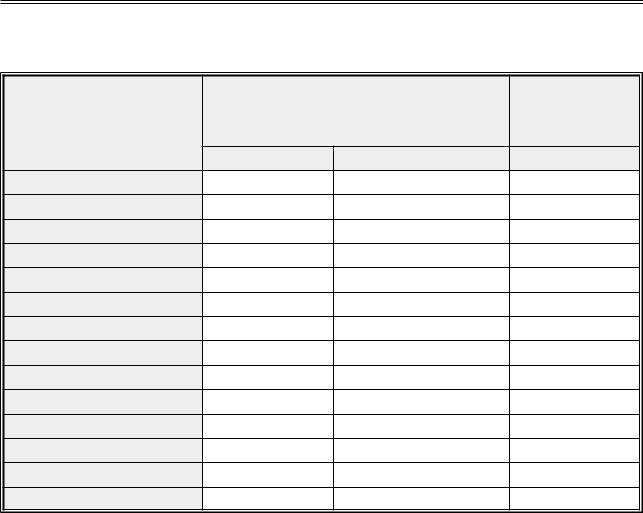
Таблица 97. Классификация и основные представители нестероидных противовоспалительных препаратов (цит. по: Дмитриев А.В., Гунина Л.М., 2018)
Структурная основа препаратов
Производные салициловой кислоты |
Производные уксусной кислоты |
• аспирин |
• диклофенак |
• дифлунизал |
• этодолак |
Производные пропионовой кислоты |
• индометацин |
• беноксапрофен* |
• сулиндак |
• фенбуфен |
• толметин |
• фенопрофен |
Бутазоны |
• флурбипрофен |
• азапропазон |
• ибупрофен |
• оксифенбутазон |
• кетопрофен |
• фенилбутазон |
• набуметон |
Сульфонанилиды |
• напроксен |
• нимесулид |
• пирпрофен |
Другие |
• тиапрофеновая кислота |
• мефенамовая кислота |
Оксикамы |
|
• пироксикам |
|
• теноксикам |
|
• лорнаксикам |
|
• мелоксикам |
|
Примечание: * – изъят фирмой-изготовителем по соображениям безопасности.
нестероидные противовоспалительные средства |
анальгетиками– простовопросмедицинскихвзгля- |
снижают синтез гликозаминогликанов, необходи- |
дов, а не научно доказанный факт. В большин- |
мых для регенерации хряща. В наибольшей сте- |
стве исследований НПВП они сравниваются друг |
пени отрицательно на хрящ влияют производные |
с другом или с плацебо. Лишь в нескольких каче- |
индол-уксусной кислоты (индометацин), а также |
ственных исследованиях, описанных достаточно |
производные пропионовой кислоты (ибупрофен, |
давновобзорнойработеS.A. Mazzuca и соавторов |
напроксен и др.), ускоряя примерно на 30% про- |
(1991), амногопозднеетакжевобзореT. Narsinghani |
грессирование деформирующего остеоартроза |
и R. Sharma (2014), в которых сравнивались |
(по данным рентгенографии). |
поэффективностиНПВПианальгетики, былопока- |
К сожалению, до настоящего времени не суще- |
зано, что использование НПВП для купирования |
ствует хорошо поставленных контролируемых |
боли в суставах при наличии ОА лишь ненамного |
исследований, которые продемонстрировали бы, |
эффективнееилиэквивалентнолечению«чистыми» |
что в лечении симптомов остеоартрита НПВП |
анальгетиками, зато существенно токсичнее, как |
лучше, чем простые анальгетики, такие как пара- |
заключили G. Singh и соавторы на основе анализа |
цетамол. Хотя эффективность НПВП не ставится |
историй болезни более 27 тысяч пациентов (1994). |
под сомнение, их превосходство над «чистыми» |
В решении вопроса о выборе препарата из этой |
|
|