
4 курс / Дерматовенерология / Эффективная_лазерная_терапия_Том_1_Основы_лазерной_терапии_С_В_Москвин
.pdf
ОСНОВЫ ЛАЗЕРНОЙ ТЕРАПИИ
личныеизмененияимеютсяивантропометрическихданных. Так, массателаи ростноворождённыхотбеременных, получавшихмедикаментознуютерапию в сочетании с ВЛОК, достоверно (р < 0,05) выше, чем в подгруппе беременных, получавших только медикаментозную терапию [Вафоева Н.В., 2001].
Таблица 3.63
Оценка состояния по шкале Апгар (баллы), массы тела (г), роста (см) обследованных новорождённых
Группа (после лечения) |
Шкала Апгар |
Масса тела |
Рост |
||
Контрольная |
|
8,31 ± 0,68 |
3450,0 ± 41,3 |
52,4 ± 0,72 |
|
Основная |
Только медикаментозное |
6,88 ± 0,5 |
2920,0 ± 135,1 |
49,3 ± 0,6 |
|
лечение |
|||||
группа |
|
|
|
||
ВЛОК |
7,2 ± 0,7 |
3313,0 ± 59,8 |
51,2 ± 0,7 |
||
|
|||||
В послеродовом периоде принципиальные лечебно-оздоровительные преимущества включения в комплексное лечение беременных с фетоплацентарной недостаточностью курсовой ЛТ определяются существенным уменьшением послеродовых осложнений: эндометритов – в 6,8 раза, субинволюций матки– в5,9 раза, обостренийэкстрагенитальныххроническихзаболеваний– в 5,1 раза. Средняя масса тела новорождённых в основной группе оказалась на 436 ± 7,9 г больше, чем в контрольной. У них также отмечено достоверное уменьшение постгипоксических кардиопатий (в 7,1 раза), дыхательных расстройств (в 4,2 раза), различных синдромов перинатального поражения ЦНС (в 2,4 раза), а также инфекционных (ОРЗ, пневмонии, менингиты и др.) заболеваний (в 4,3 раза). В целом же на базе полученных результатов можно констатировать, что новая технология по известным критериям сравнения более чем в 3 раза повышает общую эффективность оздоровления системы «мать– плацента– плод– новорождённый», сокращаяобщуюдозу(в1,7 раза) и длительность применения фармпрепаратов (в 1,8 раза). Осложнений после ЛТ не выявлено [Васильева О.А., 1998; Васильева О.А. и др., 2006; ГазазянМ.Г., ВасильеваО.А., 2000]. Приреабилитацииноворождённого, перенёсшего внутриутробную гипоксию, необходимо учитывать, что у таких детей имеют место нарушения микроциркуляции на фоне превалирования тонуса симпатического отдела ВНС [Туровский Я.А., 2005].
Благотворное влияние оказывает ВЛОК на состояние фетоплацентарной системы у беременных с инфекционно-воспалительными заболеваниями. В исследовании В.Е. Артемьева и Л.А. Ецко (1997) различной степени выраженности нарушения маточно-плацентарного кровотока установлены у большинства женщин, у части из них они приближались к критическому уровню. Проведение курса ВЛОК благоприятно влияло на их динамику: уменьшалось время заполнения крупных сосудов маточно-плацентарного комплекса и межворсинчатого пространства (Т1 и Т2), улучшались показатели кровотока в
660
Рекомендовано к покупке и прочтению разделом по дерматологии сайта https://meduniver.com/

Часть III. Частные методики лазерной терапии
межворсинчатомпространстве(S3) до30%, скоростькровотокавматочно-пла- центарном бассейне возрастала до 50%, что можно объяснить значительным улучшением реологических свойств крови при лазерном освечивании. После курсаВЛОКпроисходилоповышениеуровняплацентарноголактогена, нормализацияпоказателейпрогестеронаикортизолавсывороткекрови. Вовсехслучаях родились живые дети, удовлетворительно перенёсшие родовой стресс и раннийнеонатальныйпериод. Исследованиядоказалиблагоприятноевлияние ВЛОК на состояние фетоплацентарной системы в III триместре беременности, выражающееся в нормализации гормональных соотношений, улучшении важнейших параметров маточно-плацентарного кровотока. При этом ВЛОК, по мнению авторов, можно рассматривать не только как средство улучшения кровотока в плаценте, но и как функциональную пробу для оценки компенсаторных возможностей фетоплацентарной системы, оптимизации сроков родоразрешения. ЛТцелесообразноиспользоватьдлялеченияипрофилактики фетоплацентарнойнедостаточности, гипоксииигипотрофиивнутриутробного плода [Артемьев В.Е., Ецко Л.А., 1997].
ВЛОКрекомендуетсятакжедляпрофилактикиперинатальныхосложнений фетоплацентарнойнедостаточности[КартелишевА.В. идр., 2006]. Комплексное лечение беременных женщин с фетоплацентарной недостаточностью, включающее ЛТ, благоприятно влияет на состояние плода, уменьшает проявления вегетативного дисбаланса, улучшает процессы ранней адаптации новорождённых [Тулупова М.С., 2002].
Лазеропунктура способствует ускорению формирования биологической готовности к родам, приводит к улучшению функционального состояния фетоплацентарнойсистемы, повышаяеёгормональнуюактивность. Применение комплексногометодаподготовкикдосрочномуродоразрешениюспособствует ограничению до минимума лекарственной терапии без снижения лечебного эффекта. Лазеропунктура способствует укорочению прелиминарного и безводного периодов, общей продолжительности родов, снижению кровопотери
ичастоты оперативных вмешательств. Подготовка к родам с применением лазеропунктурысоздаётблагоприятныеусловиядляплода, чтоподтверждено позитивной динамикой эстриола, кортизола, плацентарного лактогена и аль- фа-фетопротеина, данными наружной кардиотокографии и более высокими оценками состояния новорождённого в послеродовом периоде [Сиднев Д.А., 1993]. Лазеропунктурав1,8 разаповышаетэффективностьглюкозо-эстрогено- витамино-кальциевого фона [Сиднев Д.А., 2000].
Одной из причин фетоплацентарной недостаточности и потери беременности различного срока гестации является антифосфолипидный синдром, клинико-иммунныйсимптомокомплекс, которыйхарактеризуетсявенознымии артериальнымитромбозами, рецидивирующейпотерейплоданеясногогенеза
итромбоцитопенией. С целью раннего выявления и коррекции гемокоагуляционных нарушений, а также для контроля за состоянием фетоплацентарного комплекса рекомендуется проводить плановую госпитализацию беременных
661

ОСНОВЫ ЛАЗЕРНОЙ ТЕРАПИИ
в сроке 8–9, 17–18, 28–29 и 35–36 недель. С ранних сроков гестации, основываясьнапоказателяхгемостазиограммы, пациенткамназначаютдифференцированную лазерную терапию (импульсное ИК НИЛИ, наружное воздействие) с применением дезагрегантов, антагонистов кальция, ангиометаболитов по схемам, представленным в табл. 3.64 [Башмакова Н.Б., 2000].
Таблица 3.64
Схема лечения фетоплацентарной недостаточности у больных с антифосфолипидным синдромом
Подготовка |
Антагонисты кальция в течение 3 мес. и/или лазеротерапия |
|
к беременности |
(10 сеансов) в сочетании с дезагрегантами и/или ферментами |
|
|
Лазеротерапия (предпочтительно) и/или антагонисты кальция, |
|
I триместр (8–9 недель) |
дезагреганты, по показаниям вобэнзим, хорионический |
|
|
гонадотропин |
|
II триместр |
Антагонисты кальция, лазеротерапия, по показаниям вобэнзим, |
|
инфузионные курсы: реополиглюкин + трентал (N3), актовегин |
||
(17–18 и 28–29 недель) |
||
(N5), -миметики |
||
|
||
III триместр (35–36 недель) |
Антагонисты кальция, инфузионные курсы: реополиглюкин + |
|
|
трентал (N3), по показаниям актовегин (N5) |
Исследованияпоказали, чтопослепроведенияпрегравидарнойподготовки одним из вышеперечисленных способов беременности заканчиваются рождением живых доношенных детей в 83% случаев, тогда как при отсутствии таковой благоприятный исход зарегистрирован только в 33% случаев [Баш-
макова Н.Б., 2000].
Методика ВЛОК-635, длина волны 635 нм, мощность на выходе одноразового стерильного световода 1,5–2 мВт, экспозиция 10–15 мин. На курс 5–6 ежедневных процедур.
Методика ВЛОК-635 + ЛУФОК® (табл. 2.11).
662
Рекомендовано к покупке и прочтению разделом по дерматологии сайта https://meduniver.com/

Часть III. Частные методики лазерной терапии
ИММУНОЛОГИЯ (соавт. О.А. Гизингер)
Слово «иммунитет» происходит от латинского «immunitas», что означает «освобождение», «избавление». Этозащитнаясистемаорганизма, способность противостоять действию повреждающих агентов, сохраняя свою целостность и биологическую индивидуальность. Благодаряиммунитету организм побеждает болезнь и выздоравливает.
Главная функция иммунной системы – сохранять «своё» и устранять чужеродное. Носители «чужого», с которыми иммунная система сталкивается повседневно, – это прежде всего микроорганизмы. Кроме них она способна устранятьзлокачественныеновообразованияиотторгатьтрансплантатычужеродных тканей. Для этого иммунная система обладает сложнейшим набором постоянно взаимодействующих неспецифических и специфических механизмов. Неспецифическиемеханизмыотносятсякврождённым, аспецифические приобретаются в процессе «иммунологического обучения».
Пониженный иммунитет приносит массу страданий: вызывает болезненность и слабость, негативно отражается на трудоспособности, внешности, личной жизни (шелушащаяся потрескавшаяся кожа, землистый цвет лица, тусклые секущиеся волосы, ломкие слоящиеся ногти, плохая осанка, некрасивая походка, потухший взор, хронические заболевания дёсен и зубов…). Одним словом, налицо все признаки десинхроноза – нарушения слаженности (симфонии) регулирующих систем организма. Таким образом, иммунитет – интегральная характеристика качества функционирования сложнейшей системы – живого организма, а нормализация функционирования иммунной системы предполагает реабилитацию, восстановление нормального (согласованного) функционированиявсехсистеморганизма, обеспеченияегоэнергией.
Коренные социальные изменения последних лет, произошедшие в России, нарушили привычный уклад жизни различных слоёв населения и способствовали количественному росту патологических нарушений здоровья людей. Избыточные эмоциональное и физическое перенапряжения, формирование внутреннего конфликта, хроническая бессонница, пребывание в состоянии длительного стресса отрицательно сказываются на защитных функциях человеческого организма (неврологический компонент иммунитета). Ухудшение экологии (окружающая среда, питание) способствует ещё большему ослаблению иммунитета и неспецифической резистентности организма человека (физиологическийкомпонентиммунитета). Медикаментозноелечениенаэтом фоне зачастую только усугубляет эти нарушения.
Возникающие при стрессе сложные физиологические и биохимические превращения являются результатом древней, эволюционно сложившейся оборонительной реакции, при которой происходит рефлекторная активация коры надпочечников и «вторичный» мощный выброс в кровь адреналина и
663

ОСНОВЫ ЛАЗЕРНОЙ ТЕРАПИИ
норадреналина, медиаторов симпатической нервной системы. В наше время стресс чаще всего не требует от человека энергичных физических действий, скорее наоборот, и в результате поражаются органы. Первоначальный выброс истощает запас гормонов в коре надпочечников, и начинается ускоренный синтез новых. Через некоторое время после стресса достаточно даже слабого воздействия, чтобы началось их повышенное выделение. Именно так возникают ситуации, когда после неприятностей, например, на работе возникают срывы по мелочам на близких.
Эпифиз и лимбическая система, участвующие в возникновении десинхронозов, наиболее чувствительны к стрессам, в том числе и эмоциональным. Нарушениебалансасеротонинаимелатонинавызываетпсихофизическуюдепрессию, снижение иммунитета и регенераторных способностей тканей. При отсутствии антистрессовой защиты и при воздействии постоянно повторяющихся стрессов развиваются различные заболевания: язва желудка, инфаркт миокарда, гипертоническая болезнь, частые простудные заболевания и т. д. Направленностьпораженийзависитотвозраста, индивидуальныхособенностей эндокринной системы, от чувствительности к стрессу, наследственной предрасположенности к развитию тех или иных заболеваний, а также связано со свойствами личности и характером переживаний.
У людей, как и у всех млекопитающих, уровень смертности среди самцов выше, чем среди самок, начиная с возраста достижения половой зрелости. Одна из причин этого заключается в том, что мужчины хуже защищены от инфекций. Показано, в частности, что тестостерон подавляет деятельность иммунной системы [Furman D. et al., 2014].
Абортыиихосложнениятакжеприводятквозникновениюиммунодефицита. Наблюдается угнетение Т- и В-системы иммунитета наряду с активацией факторов местной защиты. Имеются сведения о снижении концентрации IgA
итенденции к снижению уровня IgG и IgM [Трубин В.Б., 2003]. Выявлены значимыеотклоненияТ-клеточногоиммунитетаотнормыубольныхсоспеци- фическимиосложнениямипослереконструктивныхоперацийнааорто-бедрен- номсегменте, чтопозволяетрассматриватьснижениеиммунитетакакодиниз фактороввозникновенияпозднихспецифическихосложненийпротезирования аорто-бедренного сегмента [Раповка В.Г., 2002].
Характерпротеканияместныхаутоиммунныхивоспалительныхпроцессов зависит от общего состояния иммунитета больного. У лиц пожилого возраста наблюдаетсяснижениеобщейрезистентностиорганизма[МирошниченкоИ.В.
идр., 2003]. Инфекция, воспаление и аутоиммунизация повышают риск коро-
нарных событий в 2–4 раза [Huittinen T. et al., 2003].
Нормальные эритроциты способны при собственном диаметре 7,5–8 мкм проходить по капиллярам с диаметром просвета менее 3 мкм. При ухудшении эластичности мембраны и повышении внутренней вязкости изменяется деформируемость эритроцитов и нарушается соотношение поверхность/объём. Этиизмененияхарактерныдляинфекций, сахарногодиабета, циррозапечени,
664
Рекомендовано к покупке и прочтению разделом по дерматологии сайта https://meduniver.com/

Часть III. Частные методики лазерной терапии
малярии, уремии, алкалоза, ацидоза, осмотических расстройств, гиперлипидемии, старения, курения, алкоголизма и др. [Трошкина Н.А. и др., 2007].
Поэтомулогиченповышенныйинтересисследователейкприроднымадаптогенам, нелекарственным (физическим) методам восстановления иммунитета. Экспериментально-клинические данные, полученные отечественными учёными за последние 30 лет, свидетельствуют о том, что одним из наиболее перспективных факторов нормализации иммунитета является лазерный свет. Учитывая, чтолазернаятерапияэффективнаприразнообразныхзаболеваниях и неспецифична к биологическому виду (наблюдается в живых организмах от одноклеточных до человека), физическую причину этого явления следует связывать с универсальным биологическим процессом. Экспериментальноклинические исследования показали, что воздействие НИЛИ на организм опосредуется практически всеми иерархическими уровнями ВНС и ЦНС.
Исследования по лазерной коррекции иммунитета в настоящее время вышли на новый качественный уровень и позволяют ожидать в скором времени новых открытий. В разделе приводятся отдельные схемы эффективных, но щадящих научно обоснованных комплексов мероприятий, направленных на решение данной проблемы.
Влияние НИЛИ на изменения функциональной активности
и скорости НАДФ-оксидазной реакции нейтрофилов периферической крови человека (экспериментальное исследование)
Поиск способов избирательного воздействия на отдельныеэтапы развития иммунного ответа является одной из приоритетных задач биологии и фундаментальной медицины [Гизингер О.А., 2010; Горяйнов И.И. и др., 1998; Киселева Р.Е. и др., 2001; Нечипуренко Н.И. и др., 2008]. Перспективным подходом к решению данной проблемы может являться воздействие НИЛИ в качестве неспецифического физического фактора, стимулирующего функциональную активность нейтрофилов – клеток с широким функционалом и потенциалом по осуществлению иммунобиологического надзора в общей системе гомеостаза [Гизингер О.А., 2009]. Активация нейтрофильных гранулоцитов представляетсобойспецифическийамплификационный и эффекторный компонент иммунного ответа [Гизингер О.А., 2010; Горяйнов И.И. и др., 1998; Киселева Р.Е. и др., 2001]. Активация рецепторов нейтрофила запускает каскад киназ, действующих на транскрипционный фактор NF-kB, который транслоцируетсявядроиосуществляеттранскрипциюоколо120 генов, ответственных за активацию клетки [Меньшикова Е.Б. и др., 2006]. На следующем этапепроисходитактивациякаспаз, НАДФ-оксидазнойсистемы, чтовызывает образование активных форм кислорода. Активированный нейтрофил может осуществлять биоцидные функции либо реализуя фагоцитарный потенци-
665

ОСНОВЫ ЛАЗЕРНОЙ ТЕРАПИИ
ал, либо с помощью выделения наружу биологически активных продуктов, осуществляя процесс дегрануляции [Киселева Р.Е. и др., 2001]. Регистрация изменений функционально-метаболического статуса нейтрофилов в результате воздействия НИЛИ может стать полезной при выборе параметров освечивания в исследовательских мероприятиях по изучению иммунотропных эффектов, проведение которых, в свою очередь, чрезвычайно перспективно в клиническом плане, поскольку полученные результаты дадут возможность оптимизировать методики лазерной терапии.
Известно, чтонейтрофилыявляютсякакактивнымиучастникамипроцесса фагоцитоза, так и секретирующими клетками, способными высвобождать широкий спектр микробоцидных компонентов – эндогенных антимикробных пептидов, синтезироватьвазоактивныеихемотаксическиелипидныемедиаторы [Меньшикова Е.Б. и др., 2006]. Поглощение ими лазерного света приводит кизменениюметаболическихпроцессов, икакследствие, ихфункциональной активности [Гизингер О.А., 2010; Горяйнов И.И. и др., 1998; Karu T. et al., 1991]. Нейтрофилы, активизируясь, мобилизуютсодержимоегранул, секретируя его в эндоцитозные вакуоли или наружу, в окружающую среду, проявляя при этом свой бактерицидный потенциал. Секреторная дегрануляция активированных лазером нейтрофилов сопутствует практически всем формам его реактивности, в томчислеи респираторномувзрыву, прикоторомпроисходит резкое увеличение потребления кислорода [Нечипуренко Н.И. и др., 2008; Чернова Н.И. и др., 2014]. Одним из ключевых ферментов, участвующих в восстановлении молекулярного кислорода, является НАДФ-оксидаза, осуществляющая транспорт электронов от НАДФ-цитозоля к молекулярному кислороду. Лазерный свет, нормализуя функциональные дефекты системы нейтрофильных гранулоцитов, вполне может служить физическим стимулятором активности НАДФ-оксидазы, сниженной при угнетении биоцидных возможностей нейтрофила. Кроме того, определённый уровень активности НАДФ-оксидазынеобходимдляобразованиясупероксиданиона, поддержания глутатионового цикла, образования оксида азота из аминокислоты аргинина приучастииСа2+-зависимойNO-синтазы[ГизингерО.А., 2010; ГоряйновИ.И.
идр., 1998], известны также и другие Са2+-зависимые внутриклеточные процессы, активируемые НИЛИ, в которых прямо или косвенно принимает участие НАДФ-оксидаза [Москвин С.В., 2008, 2014].
Необходимоболеедетальноразобратьсявдействииэнергиилазерногосве- танадегрануляционныевозможностиискоростьНАДФН-оксидазнойреакции нейтрофилов, выделенных из периферической крови здоровых доноров, что
иопределило цель настоящего исследования. Выбор донорских нейтрофилов какобъектаисследованияобусловлен, соднойстороны, ихполифункциональной ролью в поддержании защитной реакции организма [Горяйнов И.И. и др., 1998; ТихомироваЕ.И., 2007], асдругой– определённойпростотой, связанной с отработанной методикой выделения и исследования функций этих клеток.
666
Рекомендовано к покупке и прочтению разделом по дерматологии сайта https://meduniver.com/

Часть III. Частные методики лазерной терапии
В эксперименте in vitro на примере сброса лизосомальных гранул мы изу- чалидегрануляционныевозможностинейтрофиловискоростьНАДФН-окси- дазной реакции при воздействии лазерного света [Гизингев О.А. и др., 2016].
Для выделения нейтрофилов использована кровь здоровых доноров в возрасте20 ± 5 летбезтяжёлойсоматическойиинфекционнойпатологии. Отвсех доноров-добровольцевбылополученописьменноеинформированноесогласие на участие в исследовании в соответствии с основами законодательства РФ «Об охране здоровья граждан, правил проведения клинической практики в РФ» (приказ МЗ РФ № 266 от 19.07.03 г.; приказ Росздравнадзора № 2325-
Пр/06 от 17.10.06 г.).
Для получения нейтрофилов использовали 15,0 гепаринизированной (10– 15 ЕД/мл гепарина) периферической крови. Нейтрофилы выделяли из лейкоцитарной взвеси в двойном градиенте плотности стерильных растворов фиколла-верографина. Плотность верхнего слоя градиента составляла 1,075– 1,077 г/мл, нижнего1,093–1,095 г/мл. Объёмкаждогоградиента– 1,5 мл. Через 40 мин центрифугирования при 1500 об/мин на границе между градиентами образовывалось кольцо гранулоцитов с чистотой 98–100%. Кольцо нейтрофилов собирали, переносили в стерильные центрифужные пробирки, трижды отмывали от градиента стерильным физиологическим раствором хлорида натрия, центрифугировали при 1500 об/мин в течение 10 мин и доводили до концентрации 5×106 клеток/млн. Опытные и контрольные пробы, содержащие взвесь нейтрофилов, подвергали инкубации при температуре 37 °C для исключения влияния разницы температур на активность клеток. Количество проб, состоящих из взвеси нейтрофилов – 60 (30 проб контрольных, состоящих из «неактивированных» нейтрофилов, 30 проб опытных, состоящих из нейтрофилов, на которые воздействовали НИЛИ). При проведении эксперимента учитывали, что термин «неактивированные нейтрофилы» принимается условно, т. е. безлазерногоосвечивания, посколькуихинкубацияпроисходила не в физиологических условиях, а in vitro.
Параметры лазерного воздействия: длина волны 635 нм, непрерывный режим, плотность мощности 0,12 мВт/см2, экспозиция 10, 30, 90, 120, 150 с в автоматическом режиме таймера и 100 с – ручное выключение (особенности лазерного терапевтического аппарата). Световое поле для освечивания взвеси клеток конфигурировали таким образом, чтобы в любой точке значение отклонения плотности светового потока было не более чем на 10%, что обеспечивало практически одинаковые условия для равномерного освечивания всей суспензии нейтрофилов.
Подсчёт лизосомальной активности проводили по методу И.С. Фрейдлин (1986). Для определения лизосомальной активности 0,2 мл взвеси нейтрофиловвфизиологическомрастворе(концентрация5×106 клеток/мл) соединялис 0,02 мл раствора акридинового оранжевого в концентрации 2 мкг/мл. Клетки инкубировали 30 мин при 37 °С. После 30-минутной инкубации пробы центрифугировали при 1500 об/мин в течение 5 мин. Каплю осадка помещали на
667

ОСНОВЫ ЛАЗЕРНОЙ ТЕРАПИИ
предметное стекло, накрывали покровным стеклом и микроскопировали под маслянойиммерсиейвпотокесине-фиолетовогосветалюминесцентногомик- роскопа «МикМед» (г. Санкт-Петербург). Определение активности фермента НАДФН-оксидазывнейтрофилахбылоисследованоспектрофотометрическим способом на спектрофотометре Shimadzu (Япония). В состав пробы входил K,Na-фосфатныйбуфер, взвесьнейтрофиловвконцентрации5×106 нейтрофилов/мл, субстратНАДФН(0,5 нмоль/мл) («БиохимМак», Россия). Активность фермента определяется по скорости НАДФН-оксидазной реакции, которую рассчитывали по убыли поглощения субстрата НАДФН при 340 нм за счёт его окисления по формуле: v = ( D·60·1000)/(ε·t·α), где v – скорость реакции, пмоль/(мин·103 клеток); D – измеренная убыль оптической плотности за период измерения; t – период измерения, с; ε – коэффициент миллимолярной экстинкции, равный6,22 мМ; α– количествоклетоквпробе; 60 – коэффициент пересчёта секунд в минуты; 1000 – коэффициент пересчёта на 1000 клеток. Результаты исследования представляли графически по методу Корниш–Бо- умена. Вместо обычной формы записи уравнения Михаэлиса–Ментен в виде зависимости w от s использовали преобразованную форму – зависимость V от Km, V = v + v/s·K, где v – скорость реакции, пмоль/(мин·103 клеток); s – концентрация НАДФН, нмоль/мл; Km – константа Михаэлиса, мкМ; V – максимальная скорость реакции, пмоль/(мин·10 кл). Для пары значений v и s строили график v(s), Km и V определяли графически.
Полученные результаты исследований были подвергнуты обработке методами вариационной статистики с помощью пакета прикладных программ «Statistica for Windows», базисная версия. Результат считался достоверным при р < 0,05.
В экспериментальной модели был изучен процесс дегрануляции лизосомальных гранул нейтрофильными гранулоцитами и изменения содержания данными клетками фермента НАДФ-оксидазы под действием НИЛИ в непрерывном режиме за различные временные промежутки. За рабочую гипотезу принято предположение о том, что изменение дегрануляции лизосом лейкоцитов может быть связано с изменением концентрации фермента НАДФоксидазы, причём усиление дегрануляционных возможностей находится в пропорциональнойзависимостиотвыработкиэтогофермента. Былопоказано, что максимальные активность лизосом и сброс лизосомальных гранул проис- ходятприэкспозиции90–100 спривозникновенииплатоприэкспозициях120 и150 с(р< 0,05). ПрименьшихэкспозицияхосвечиванияНИЛИнейтрофильных гранулоцитов (10 и 30 с) выраженного эффекта также не наблюдалось
(р > 0,05, р = 0,9) (рис. 3.63).
Такимобразом, НИЛИкрасногоспектраприпараметрахвоздействия(длина волны 635 нм) является физическим стимулом, усиливающим экзоцитоз нейтрофиламилизосомальныхгранулin vitro. Ответнейтрофиловналазерное воздействие, выражающеесяврезкомусиленииихлизосомальнойактивности приоптимальнойэкспозиции60–100 с, позволяетпредположить, чтовоздейс-
668
Рекомендовано к покупке и прочтению разделом по дерматологии сайта https://meduniver.com/
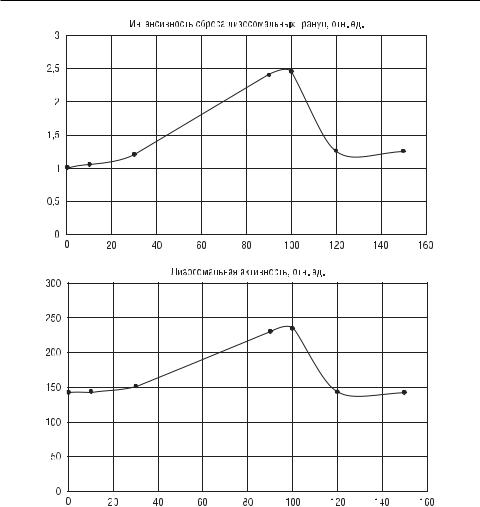
Часть III. Частные методики лазерной терапии
Рис. 3.63. Лизосомальная активность и интенсивность сброса лизосомальных гранул нейтрофилов, выделенных из периферической крови доноров при действии НИЛИ (635 нм, непрерывный режим, 0,12 мВт/см2) в зависимости от экспозиции (с)
твие НИЛИ является «триггером», запускающим экзоцитоз гранул нейтрофилов, что в конечном итоге приводит к усилению метаболических процессов в нейтрофилах, в частности усилению выработки фермента НАДФ-оксидазы. Этот результат косвенно подтверждает высказанное ранее предположение о ведущей роли ионов кальция, высвобождаемых из внутриклеточных депо [Москвин С.В., 2008, 2014], которые, как известно, распространяются в виде волн с периодом 100 с [Alexandratou E. et al., 2002].
ДляизученияактивностиферментаНАДФ-оксидазывсерииопытоввана- логичныхусловияхвыделенныеизкровидоноровнейтрофилыподвергалила-
669
