
5 курс / Госпитальная педиатрия / Сепсис новорожденных
.pdfВажное значение в патогенезе септического шока имеет оксид азота (NO), являющийся естественном энзимом, распространенным в организме межклеточным и внутриклеточным медиатором. Под влиянием ЛПС, TNF-a, IL-1, IL-6, IL-8 активируется фермент оксид-азот-синтетаза, что увеличивает образование NO. Оксид азота является первым выявленным эндотелийзависимым релаксирующим фактором (ЭЗРФ). NO – это чрезвычайно сильный вазодилататор. Он предопределяет развитие тяжелой вазодилатации, которая нечувствительна к вазопрессорам, что характерно для септического шока. Артериальная гипотензия в случае эндотоксинили цитокининдуцированного септического шока может быть преодолена при использовании ингибиторов оксид-азот-синтетазы.
Клинические признаки септического шока:
•ухудшение перфузии тканей;
•симптом белого пятна свыше 5 с;
•бледность, мраморность кожи;
•снижение артериального давления;
•снижение температуры конечностей;
•тахикардия;
•олигурия;
•угнетение ребенка;
•неусвоение энтерального питания.
Патогенез перинатального сепсиса
Сепсис рассматривают как синдром системного воспалительного ответа макроорганизма на бактерии и прочие микроорганизмы, который сопровождается повышенным продуцированием цитокинов, лимфокинов, простагландинов с поражением многих органов и систем организма.
Патофизиология сепсиса обусловлена иммунопатологической реакцией, которая происходит вследствие взаимодействия эндотоксинов грамнегативных бактерий, суперантигенов грампозитивных бактерий, вирусов и прочих с иммунными клетками организма, прежде всего макрофагами и моноцитами.
Согласно данным W.B. Klimstra et al (1999), в патофизиологии перинатального сепсиса с синдромом системного воспалительного ответа важная роль принадлежит вирусам. Патофизиологические процессы, которые происходят в организме в случае сепсиса, можно рассматривать как иммунологический ответ организма на внедрение микробных агентов. Иммунологический ответ организма состоит в процессах взаимодействия макрофагов, моноцитов с эндотоксином грамнегативных бактерий липополисахаридом (ЛПС), вирусами, следствием чего является активация продуцирования цитокинов – межклеточных медиаторов иммунного ответа
(R.S. Silveira, 1999).
ЛПС индуцирует продуцирование цитокинов (цитокиновый каскад), а именно фактора некроза опухолей-а (ФНП-а) или туморнекротизирующего фактора (TNF-tx), IL-1, IL-6, IL-8, угнетает синтез иммунного ɣ-ин-
10

терферона (ɣ-IFN). ЛПС – главный индуктор эндотоксинового шока. Повышенная цитокиновая реакция иммунных клеток сопровождается высоким уровнем цитокинов в крови, именно это обусловливает клиническую манифестацию синдрома системного воспалительного ответа с развитием интоксикации, дыхательных расстройств, клинических проявленный поражения ЦНС, нарушений гемодинамики гомеостаза, метаболизма. Кроме того, в патофизиологии сепсиса важную роль играют ɣ-интерферон, нейтрофилы, комплемент, оксид азота, свободные радикалы, простагландины, эйкозаноиды, бактериальные антигены грампозитивных бактерий.
Активация системы комплемента приводит к вазодилатации, повышению проницаемости клеточных мембран, стимулирует агрегацию тромбоцитов. Важная роль в патогенезе сепсиса принадлежит фактору коагуляции Хагемана (ХП фактор), который предопределяет развитие синдрома диссеминированного внутрисосудистого свертывания, стимулирует синтез брадикинина, что в свою очередь является одним из патогенетических факторов снижения артериального давления.
Таким образом, сепсис можно рассматривать как сложный клиникоиммунопатологический процесс, непосредственно связанный с микробными агентами, которые предопределяют активную цитокиновую реакцию с высоким уровнем продуцирования цитокинов. Это приводит к поражению многих органов и систем организма как с формированием септикопиемических очагов, так и без них. Тяжелый сепсис с развитием гипотензии рассматривается как септический шок. Клинической манифестацией перинатального сепсиса может быть полиорганная недостаточность у новорожденных с перинатальной патологией.
Гемодинамические нарушения при сепсисе
Активация кининовой системы, комплемента, освобождение простагландинов, гистаминов
Вазодилатация |
|
Повышение проникновения капилляров |
|
|
↓ |
|
|
↓ |
|
|
|
|
|
|
Депонирование крови |
|
Потеря жидкости в межклеточном пространстве |
|
|
|
|
↓ |
|
|
|
|
Гиповолемия |
|
|
Снижение сократительной |
Снижение перфузии |
Снижение метаболизма клеток. |
|
|
способности миокарда |
тканей (шок) |
Гипогликемия |
|
|
Активация системы |
↓ |
↓ |
|
|
гемостаза |
|
|||
|
|
|
||
Нарушение |
Системная полиорганная |
Нарушение утилизации |
|
|
микроциркуляции |
недостаточность |
кислорода |
|
|
11
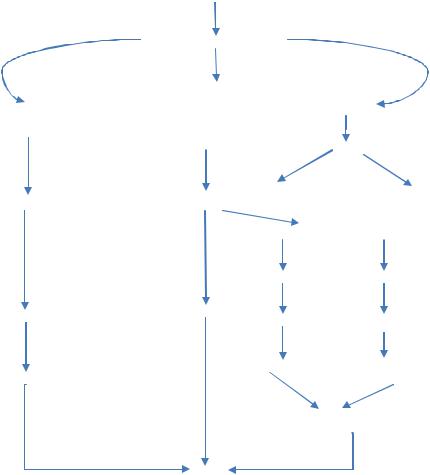
Схема патогенеза синдрома системного воспалительного ответа (SIRS)
Инфекция
ЛПС, Эндо- и экзотоксины
Брадикинин
Плазмин
Комплемент
Протеазы
Проницаемость мембран
Повреждение тканей
Макрофаги
↓
Цитокины  Эндотелиальные клетки
Эндотелиальные клетки
TNF
IL-1, IL-6
NO
Цитотоксичность Вазодилатация Кислородные радикалы
Метаболиты арахидоновой кислоты
Липоксигеназы Циклооксигеназы
Пероксидазы Лейкотриены Тромбоксан, простагландины
Вазоконстрикция Агрегация тромбоцитов
Повреждение тканей Гипоксия
СПОН
ЛПС – липополисахариды
TNF – туморнекротический фактор
IL-1, IL-6 – интерлейкины 1, 6, соответственно NO – оксид азота
СПОН – синдром полиорганной недостаточности
12
ДИАГНОСТИКА
І. Лабораторные критерии диагностики:
1.Клинический анализ крови – лейкопения или лейкоцитоз < 5000 L
>25000 L, анемия, увеличение соотношения незрелых нейтрофилов к общему количеству нейтрофилов I : T > 0,2.
2.Микробиологическое обследование:
=> Бактериологическое обследование:
•кровь;
•моча;
•ликвор (по показаниям);
•содержимое септикопиемических очагов;
•эндотрахеальный секрет (по показаниям);
•бактериоскопия мазков крови, мочи, ликвора с окраской по Граму;
•антибиотикограмма.
=> Вирусологическое обследование (иммунофлуоресцентный метод, иммуноферментный анализ) на ведущие перинатальные TORCH-патогены соответственно факторам риска перинатального анамнеза матери и клинического состояния ребенка.
=> Обследование (по показаниям) на хламидии, микоплазмы, уреаплазмы, токсоплазмы.
=> Обследование на грибы (Candida albicans et al.). 3. Биохимический мониторинг:
•глюкоза крови;
•билирубин, фракции, АЛТ, ACT;
•общий белок, фракции;
•мочевина, креатинин;
•щелочная фосфатаза.
4. Определение кислотно-щелочного состояния, газов крови: pH < 7,25; BE < 12 ммоль/л – метаболический ацидоз.
5.Определение уровня С-реактивного белка – диагностический критерий > 10–15 мг/л.
6.Прокальцитонин > 0,5 нг/мл.
7.Иммунологическое обследование:
•TNF-a, IL-1, IL-6, IL-8;
•интерферонного статуса (сывороточный, ɑ- и ɣ-IFN);
•сывороточные иммуноглобулины G, М, А;
•НСТ-тест спонтанный и индуцированный (активность фагоцитов);
•функциональный резерв фагоцитов (НСТ-тест – спонтанный, индуцированный);
•иммуноферментный анализ (по показаниям) на TORCH-патогены;
•серологическое исследование сыворотки крови.
8. Полимеразная цепная реакция (по показаниям).
ІІ. Другие клинико-параклинические методы диагностики:
• обзорная рентгенография;
13
•нейросонография;
•эхокардиография, ЕКГ;
•ультразвуковая диагностика органов брюшной полости (по показаниям).
Проводится мониторинг:
•насыщения гемоглобина кислородом – контроль сатурации методом пульсоксиметрии;
•артериального давления;
•частоты дыхания;
•частоты сердечных сокращений;
•диуреза.
ПРИНЦИПЫ ИНТЕНСИВНОЙ ТЕРАПИИ ПЕРИНАТАЛЬНОГО СЕПСИСА Современные представления патофизиологии перинатального сепсиса, в особенности системной воспалительной реакции, составляют фун-
дамент главных компонентов лечения сепсиса – антибактериальной и противовирусной терапии, коррекции нарушений гомеостаза, а также адекватного хирургического вмешательства.
1. Антибактериальная и противовирусная терапия
Антибактериальная терапия в наше время служит основой лечения септических больных. Важное место в лечении новорожденных с септическими заболеваниями занимает противовирусная терапия, в особенности пораженных герпетическими инфекциями. В развитии перинатального сепсиса важную роль играют герпесвирусы I и II типа, цитомегаловирусы. Таким образом, в случае перинатального инфицирования новорожденного вирусами герпес I и II типа у ребенка нередко выявляется генерализованная герпетическая инфекция с септическим течением или герпес-бактериальный сепсис.
Сложности лабораторной диагностики герпетической инфекции у новорожденного с тяжелой перинатальной патологией ставят перед врачом вопрос относительно целесообразности назначения специфической противогерпетической терапии только на основании анамнеза матери, факторов перинатального риска и клинического состояния ребенка. Мы считаем целесообразной тактику превентивной терапии лечения зовираксом по клиническим показаниям до получения результатов лабораторного обследования для подтверждения герпетической инфекции.
Угнетение иммунитета в случае вирусно-бактерийного сепсиса у новорожденных нуждается в применении иммуноглобулинов для внутривенного введения: Сандоглобулина (Новартис, Швейцария), иммуноглобулина Био-фарма, а также препаратов рекомбинантного интерферона: лаферона, интрона А (Шеринг-Плау, США) и др.
2. Коррекция нарушений гомеостаза:
=> респираторная поддержка:
•кислородная палатка;
•СРАР через назальные канюли;
14
•искусственная вентиляция легких (по клиническим и газометрическим показаниями или если для поддержки SaO2 необходимо FiO2 > 0,6);
=> поддержка адекватной гемодинамики:
•контроль артериального давления, диуреза;
•инфузионная терапия;
• допамин, добутрекс (по показаниям). |
1 |
|
=> белково-энергетическое обеспечение => терапия, направленная на уменьшение выделения и связывание
цитокинов: пентоксифилин (трентал); моноклональные антитела против TNF-a; моноклональные антитела против ЛПС.
=> трансфузия гранулоцитов.
Перспективным направлением лечения сепсиса (особенно у преждевременно родившихся грудных детей) является применение цитокинов в терапевтических (профилактических) дозах, а именно: рекомбинантного гранулоцита колоний стимулирующего фактора (G-CSF), рекомбинантного макрофагогранулоцитоколонии стимулирующего фактора (GM-CSF – Лейкомакс, Novartis, Швейцария), которые вводятся внутривенно (нормальное содержимое указанных факторов в сыворотке крови детей и взрослых < 50 pg/ml). G-CSF, GM-CSF определяют функцию гранулоцитов, метаболизм полиморфноядерных нейтрофилов, а также фагоцитоз. Применение G-CSF, GM-CSF в комплексном лечении сепсиса повышает эффективность антибактериальной терапии. Абсолютным показанием для назначения рекомбинантных гемопоэтических цитокинов является нейтропения.
II.АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ СЕПСИСА НОВОРОЖДЕННЫХ.
ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Главные критерии выбора антибактериальной терапии
Клиническая оценка состояния больного.
Определение этиологического возбудителя сепсиса методами современной диагностики и подбор целенаправленных противобактерийных препаратов.
Оценка состояния иммунитета.
Оценка фармакокинетики препаратов.
Знание микробиологического пейзажа лечебного учреждения.
Учет соотношения «стоимость – эффективность».
Трѐхступенчатая концепция антибактериальной терапии сепсиса включает:
1)эмпирическую терапию;
2)целенаправленную терапию;
3)терапию долечивания.
Рекомендуемые схемы эмпирической антибактериальной терапии при лечении перинатального сепсиса
15
Синдром системного воспалительного ответа (ССВО): Вариант I
Новорожденные в возрасте от 0 до 2 нед: зинацеф в дозе 100 мг/сутки в два приема в/в;
нетромицин (нетилмицин) в дозе 7,5 мг/кг/сут × 1 раз. Вариант II
Пенициллин G в дозе 50000 ед/кг × 2 раза в сутки в/в, в/м; 1 нетромицин 5 мг/кг/сут × 1 раз в/в, в/м; пробиотик (энтерол, симбитер).
Вариант III
Оксациллин в дозе 50 мг/кг × 3 раза в сутки в/в, в/м; зинацеф в дозе 100 мг/кг/сут в два приема.
ССВО. Пневмония. Менингит:
Вариант I
Новорожденные в возрасте от 0 до 2 нед:
цефтазидим (фортум) в дозе 50 мг/кг × 2 раза в сутки в/в, в/м; амикацин 10 мг/кг – при массе более 2000 г × 2 раза в сутки, при массе менее 2 000 – 7,5 мг/кг × 2 раза в сутки в/в, в/м; пробиотик (энтерол, симбитер, линекс).
Вариант II
Цефтриаксон (роцефин, офрамакс, лендацин) в дозе 100–150 мг/кг/сут × 1 раз в/в, в/м; нетромицин в дозе 7,5 мг/кг/сут × 1 раз в/в, в/м;
пробиотик (энтерол, симбитер, линекс). Вариант III
Цефепим (максипим) – у новорожденных старше 3 нед в дозе 150 мг/кг/сут × 3 раза в/в, в/м; пробиотик (энтерол, симбитер, линекс).
Вариант IV
Новорожденные и младенцы до 3 мес:
цефтазидим (фортум) в дозе 50 мг/кг × 3 раза в сутки в/в, в/м, нетромицин в дозе 7,5–9 мг/кг/сут × 1 раз в/в, в/м; пробиотик (энтерол, симбитер, линекс).
ССВО. Септический артрит. Гематогенный остеомиелит: Новорожденные и младенцы до 3 мес
Вариант I
Цефтриаксон (роцефин, лендацин, офрамакс) в дозе 100 мг/кг × 1 раз в сутки в/в, в/м; нетромицин в дозе 8 мг/кг/сутки × 1 раз в/в, в/м;
апротинин (контрикал) в дозе 1000 АтрЕ/кг × 2 раза в сутки в/в; пентоксифилин в/в 1 раз в сутки, пробиотик (энтерол, симбитер, линекс).
16
Вариант II
Цефтриаксон (роцефин, лендацин. офрамакс) в дозе 100 мг/кг × 1 раз в сутки в/в, в/м; гентамицин / тобрамицин в дозе 2,5 мг/кг × 2 раза в сутки в/в, в/м;
апротинин (контрикал,) в дозе 1000АтрЕ/кг × 2 раза в сутки в/в; пентоксифилин в/в 1 раз в сутки; пробиотик (энтерол, симбитер, линекс).
Вариант III
(при множественных септических артритах):
Цефтазидим (фортум) в дозе 50–100 мг/кг × 3 раза в сутки в/в, в/м; клиндамицин (далацин Ц) в дозе 20 мг/кг × 2 раза в сутки в/в, в/м; апротинин (контрикал) в дозе 1000АтрЕ/кг × 2 раза в сутки в/в; пентоксифилин в/в 1 раз в сутки; нетромицин в дозе 8 мг/кг/сутки 1 раз в/в, в/м; пробиотик (энтерол, симбитер, линекс).
Вариант IV
(при госпитальной инфекции):
Цефепим (максипим) у новорожденных старше 3 нед в дозе 150 мг/кг/сут × × 3 раза в/в; ванкомицин (ванмиксан, эдйцин) в дозе 10 мг/кг × 4 раза в сутки в разве-
дении 1 : 1 с 0,9 % хлоридом натрия (физраствор) при длительности капельного введения 60 мин, в/в; амикацин в дозе 10 мг/кг/сут × 1 раз в/в, в/м;
апротинин (контрикал) в дозе 1 000 АтрЕ/кг × 2 раза в сутки в/в; пентоксифилин в/в 1 раз в сутки; флюконазол в/в 10 мг/кг × 1 раз в сутки; пробиотик (энтерол, симбитер, линекс).
ССВО. НЭК ІІ–ІІІ степень:
Вариант І Ванкомицин (эдицин, ванмиксан) в дозе 10 мг/кг × 4 раза в сутки в разве-
дении 1 : 1 с 0,9 % хлоридом натрия (физраствор) при длительности капельного введения 60 мин в/в; амикацин в дозе 10 мг/кг/сут × 1 раз в/в, в/м; метронидазол 7,5 мг/кг/сут;
апротинин (контрикал) в дозе 1 000 АтрЕ/кг × 2 раза в сутки в/в; пробиотик (энтерол, симбитер, линекс).
Вариант II
Азтреонам в дозе 30 мг/кг × 4 раза в сутки в/в; амоксиклав (амоксациллин/клавулоновая кислота) в дозе 30 мг/кг/сут в 3 приема в/в; метронидазол 7,5 мг/кг/сут;
апротинин (контрикал) в дозе 1 000 АтрЕ/кг × 2 раза в сутки в/в; пробиотик (энтерол, симбитер, линекс)
17
ДОЗИРОВАНИЕ АНТИБАКТЕРИАЛЬНЫХ АГЕНТОВ, ПРИМЕНЯЕМЫХ У ДЕТЕЙ*
Дозирование в мг/кг/сут или мг/кг с рекомендуемой частотой
Лекарства |
Масса тела менее 2 кг |
Масса тела более 2 кг |
Старше |
|||
0–7 дней |
8–28 дней |
0–7 дней |
8–28 дней |
28 дней |
||
|
||||||
Амикацин |
7,5/18–24 ч |
7,5/12 ч |
10/12 ч |
10/12 ч |
10/8 ч |
|
Гентамицин/тобрамицин |
2,5/18–24 ч |
2,5/12 ч |
2,5/12 ч |
2,5/12 ч |
2,5/8 ч |
|
Азтреонам, в/в |
30/12 ч |
30/8 ч |
30/8 ч |
30/6 ч |
30/6 ч |
|
Цефазолин, в/в, в/м |
20/12 ч |
20/12 ч |
20/12 ч |
20/8 ч |
20/8 ч |
|
Цефатоксим, в/в, в/м |
50/12 ч |
50/8 ч |
50/12 ч |
50/8 ч |
50/8 ч (75/6 ч |
|
|
|
|
|
|
для менингита) |
|
Цефокситим в/в, в/м |
|
|
20/12 ч |
|
80–160/6 ч |
|
Цефподоксим, в/в, в/м |
|
|
|
|
10 раз/сут |
|
|
|
|
|
|
(макс. 400 мг/сут) |
|
Цефпрозид, в/в, в/м |
|
|
|
|
15–30/сут |
|
|
|
|
|
|
(макс. 1 г) |
|
Цефтазидим в/в, в/м |
50/12 ч |
50/8 ч |
50/8 ч |
50/8 ч |
50/8 ч |
|
Цефтизоксим, в/в |
|
|
|
|
33–66/8 ч |
|
Цефтриаксон в/в, в/м |
50/сут |
50/сут |
50/сут |
75/сут |
50–75/сут |
|
|
|
|
|
|
(при менингите – 100) |
|
Цефуроксим, в/в |
50/12 ч |
50/8 ч |
50/8 ч |
50/8 ч |
50/8 ч (80/8 ч – |
|
|
|
|
|
|
для менингита) |
|
|
|
|
|
|
10–15/сут (макс 1 г) |
|
Хлорамфеникол, в/в |
25/24 ч |
25/24 ч |
25/24 ч |
15/12 ч |
12,5–25/6 ч |
|
|
|
|
|
|
(макс. – 2 г/сут) |
|
Имипинем, в/в |
|
|
25/12 ч |
25/8 ч |
15–25/6 ч |
|
|
|
|
|
|
(макс 2 г/сут) |
|
Меропенем, в/в, в/м |
|
|
|
|
60–120/8 ч |
|
Эритромцин, в/в |
10/12 ч |
10/8 ч |
10/12 ч |
13/8 ч |
10/6 ч |
|
|
|
|
|
|
7,5/12 ч |
|
Кларитромицин, в/в |
|
|
|
|
(макс.1 г/сут) |
|
Ванкомицин в/в |
12,5/12 ч |
15/12 ч |
18/12 ч |
22/12 ч |
40–60/6–8 ч |
|
|
|
|
|
|
60–120/сут/8 ч |
|
Меропенем |
|
|
|
|
(120 для менингитов) |
|
Метронидазол, в/в |
7,5/24 ч |
7,5/12 ч |
7,5/12 ч |
15/12 ч |
7,5/6 ч |
|
Нафциллин, оксациллин, в/в |
25/12 ч |
25/8 ч |
25/8 ч |
37/6 ч |
37/6 ч (8–12 г/сут) |
|
Мезлоциллин в/в, в/м |
75/12 ч |
75/8 ч |
75/12 ч |
75/8 ч |
75/6 ч |
|
Диклоксациллин, в/м |
|
|
|
|
12–25/6 ч |
|
Клоксациллин, в/м |
|
|
|
|
50–100/6 ч |
|
Амписульбин (Уназин), в/в |
|
|
|
|
100–300/6 ч |
|
Пиперациллин/Тазобактам, |
75 мг/кг/12 ч |
75 мг/кг/12 ч |
75 мг/кг/8 ч |
75 мг/кг/8ч |
100–300/4–6 ч |
|
в/в |
|
|
|
|
|
|
Тикарциллин, в/в |
75/12 ч |
75/8 ч |
75/8 ч |
75/6 ч |
75/6 ч |
|
Тикарциллин/Клав, в/в |
75/12 ч |
75/8 ч |
75/8 ч |
75/6 ч |
75/6 ч |
|
Пенициллин, в/в |
50 000/12 ч |
75 000/8ч |
50 000/8 ч |
50 000/6 ч |
50 000/кг/сут |
|
* Источник – Гид антимикробной терапии. Стенфорд. Калифорния, США. 2002 г
18
ИММУНОТЕРАПИЯ
Сандоглобулин = иммуноглобулин человеческий нормальный:
•Изготовлен из пула плазмы 16 000 доноров.
•Состав: IgG – 96 %, IgA – в небольшом количестве, IgM – в небольшом количестве.
•При в/в инфузии 100 % биодоступность.
•Антитела сандоглобулина имеют такие же фармакокинетические характеристики, как и антитела эндогенного IgG.
•Содержит в своем составе антитела к цитомегаловирусу в титре 1.2560. Рекомендации к употреблению:
•Тяжелые бактериальные инфекции, сепсис, вирусные инфекции.
•Профилактика инфекций у недоношенных детей с низкой массой тела при рождении.
•Заместительная терапия для профилактики инфекций при первичных и вторичных иммунодефицитах.
•Профилактика и лечение инфекций при терапии цитостатиками и иммунодепрессантами.
•Профилактика обычного аборта.
•Идиопатическая тромбоцитопеническая пурпура.
•Тромбоцитопения иммунного происхождения (посттрансфузионная пурпура).
•Гемофилия, связанная с антителами к фактору Р.
Тесты для самоконтроля
1. Основные показания к проведению спинномозговой пункции у новорожденных:
A. Апноэ без видимой причины.
Б. Повышение температуры тела до 38–39 ºС. В. Судороги.
Г. Мозговой крик. Е. Все варианты.
2.Какой нормальный состав цереброспинальной жидкости у новорожденного 10 дней?
А. Цитоз – 0–20, белок – 0,33 г/л, глюкоза 1,2 – 2,4 ммоль/л. Б. Цитоз –30–40, белок – 0,66 г/л, глюкоза 1,2 – 2,4 ммоль/л.
В. Цитоз – 100–200, белок – 0,33 г/л, глюкоза 1,2 – 2,4 ммоль/л. Г. Цитоз – 0–10, белок – 2,33 г/л, глюкоза 1,1 – 1,4 ммоль/л.
Д. Цитоз – 35–45, белок – 1,33 г/л, глюкоза 1,2 – 2,4 ммоль/л.
3.Ребенок в сроке гестации 34 нед. У матери обострение хронического пиелонефрита, преждевременный разрыв плодовых оболочек, безводный период 54 ч. На 2-е сутки отмечается ухудшение состояния вследствие нарастания дыхательных расстройств, вялости, отказа от еды. Взята кровь на С-реактивный белок и прокальцитонин. Тесты положительны. Какой наиболее вероятный диагноз у ребенка?
19
