
- •ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
- •ПРЕДИСЛОВИЕ
- •СПИСОК СОКРАЩЕНИЙ
- •1. Введение
- •1.1. Освещение по Кёлеру
- •1.1.1. Принципы метода
- •1.1.2. Предварительная проверка оборудования
- •1.2. Установка света по Кёлеру
- •2.1. Преломление
- •2.1.1. Числовая апертура
- •2.2. Отражение, поглощение и пропускание
- •2.3. Флуоресценция/фосфоресценция
- •2.4. Поляризация
- •2.5. Дифракция
- •2.5.1. Тестовые пластинки Аббе
- •2.5.2. Формирование первичного изображения
- •2.5.3. Разрешающая способность
- •2.5.4. Роль конденсора в разрешении микроскопа
- •2.5.5. Увеличение
- •2.5.6. Увеличение и разрешение
- •4. Поле зрения
- •5. Резюме
- •6. Литература для дальнейшего чтения
- •1. Введение
- •1.1. Определение контраста
- •2. Светлопольная микроскопия
- •3. Фазовый контраст
- •3.2. Дифрагированный свет в фазовом контрасте
- •4. Темнопольная микроскопия
- •4.1. Освещение по Рейнбергу
- •4.2. Темнопольные конденсоры высокого разрешения
- •4.3. Темнопольное изображение
- •5. Поляризованный свет
- •5.1. Использование одиночного поляризатора
- •5.2. Использование скрещенных поляризаторов
- •5.2.2. Направление двулучепреломления
- •6.3. Интерференционная отражательная микроскопия
- •6.3.2. Физические основы метода
- •6.3.3. Интерпретация результатов
- •7.1. Красители
- •7.2. Использование светофильтров
- •7.3. Срезы
- •7.4. Качество препарата
- •8. Другие методы
- •8.1. Дисперсионное окрашивание
- •10. Благодарности
- •11. Литература
- •ФИКСИРОВАНИЕ ИЗОБРАЖЕНИЯ
- •1. Введение
- •2. Рисование
- •3. Фотомикрография
- •4.1. Разрешение
- •4.2. Разрешающая способность и размер отпечатка
- •4.4. Освещение
- •5. Микроскоп для фотомикрографии
- •5.1. Штатив микроскопа
- •5.2. Оптика
- •5.2.1. Числовая апертура и увеличение объективов
- •5.2.2. Исправление аберраций
- •5.2.4. Иммерсионные объективы
- •5.2.5. Глубина резкости
- •5.2.6. Кривизна поля зрения
- •5.2.7. Типы конденсоров
- •5.2.8. Чистка линз
- •6. Камера для фотомикрографии
- •6.1. Выбор размера пленки
- •6.3. Специальная фотомикрографическая камера
- •6.4. Микроскопы со встроенными фотосистемами
- •6.5. Камера с мехами
- •7. Наведение на фокус и определение экспозиции
- •7.1. Наведение на фокус
- •7.2. Определение экспозиции
- •7.3. Контроль экспозиции
- •8. Выбор условий для фотомикрографии
- •8.1. Фотографический процесс
- •8.1.1. Чувствительность пленки
- •8.1.2. Зернистость
- •8.1.3. Контрастность
- •8.2. Черно-белая фотомикрография
- •8.3. Цветная фотомикрография
- •8.3.1. Цветные отпечатки или слайды
- •8.3.2. Печать со слайдов
- •8.3.3. Цветовая температура
- •8.3.4. Коррекция цветовых искажений
- •8.3.6. Выбор чувствительности пленки
- •8.4. Поляроидные клетки
- •8.4.2. Камера Поляроид SX70
- •8.4.3. Поляроидные слайды
- •8.5. Хранение неэкспонированной пленки
- •9. Фотомакрография
- •9.1.1. Стереомикроскопы для фотомикрографии
- •9.1.2. Макроскопы
- •9.1.3. Фотомакрографические объективы
- •9.2. Освещение для фотомакрографии
- •9.3. Определение экспозиции при фотомакрографии
- •10. Завершение процесса фотомикрографии
- •10.1. Содержание записей
- •10.2. Хранение негативов
- •10.3. Хранение слайдов
- •10.4. Монтаж слайдов
- •10.5. Хранение отпечатков
- •10.6. Определение и указание увеличения
- •11. Практическое руководство
- •11.2. Начальная калибровка экспонометра
- •12. Литература для дальнейшего чтения
- •ИММУНОГИСТОХИМИЯ
- •1. Введение
- •2. Антитела
- •2.1. Структура иммуноглобулинов
- •2.2. Поликлональная антисыворотка
- •2.3. Моноклональные антитела
- •2.4. Очистка антител
- •2.5. Специфичность реакций антител
- •2.6. Хранение антител
- •3.1. Выбор условий обработки ткани
- •3.2. Выявление скрытых антигенов
- •4. Выбор способа мечения
- •4.1. Флуоресцентные метки
- •4.2. Ферментные метки
- •4.2.1. Пероксидаза хрена
- •4.2.2. Щелочная фосфатаза
- •4.2.3. Глюкозооксидаза
- •4.2.4. Галактозидаза
- •4.3. Коллоидное золото
- •4.4. Выбор метки
- •5. Методы окраски
- •5.1. Прямой метод
- •5.2. Непрямой метод
- •5.4. Системы с использованием биотин — авидина
- •5.5. Другие методы
- •6. Экспериментальные методы
- •6.1. Общее описание метода
- •6.2. Выбор правильного разведения антител
- •6.3. Флуоресцентные метки
- •6.4. Пероксидаза
- •6.4.1. Ингибирование эндогенного фермента
- •6.5. Щелочная фосфатаза
- •6.5.1. Блокирование эндогенного фермента
- •6.5.2. Мера предосторожности
- •6.6. Глюкозооксидаза
- •6.7. Галактозидаза
- •6.9. Некоторые общие процедуры
- •6.9.1. Покрытие предметных стекол
- •6.9.2. Дополнительное окрашивание
- •7.1. Контрольные препараты
- •7.2. Решение проблем
- •9. ДНК-зонды для гибридизации in situ
- •9.1. Принцип метода гибридизации
- •9.2. Экспериментальная процедура
- •9.2.1. Выявление Y-хромосомы
- •9.2.2. Выявление цитомегаловируса
- •10. Цитологические препараты
- •11. Количественная оценка
- •12. Оборудование
- •13. Благодарности
- •14. Литература
- •ГИСТОХИМИЯ И СВЕТОВАЯ МИКРОСКОПИЯ
- •1. Введение
- •1.1. Объекты для гистохимического окрашивания
- •1.1.1. Что такое окрашивание?
- •2. Приготовление и хранение срезов препаратов
- •2.1. Необходимые характеристики препарата
- •2.2. Методы приготовления и хранения препаратов
- •2.2.1. Получение тонких слоев
- •3. Что можно выявлять? Некоторые примеры
- •3.1. Выявление химических свойств
- •3.1.1. Химические фрагменты
- •3.1.2. Специфические вещества
- •3.1.3. Классы веществ
- •3.2. Выявление биологических объектов
- •3.2.1. Биологические объекты
- •3.2.2. Биологические процессы
- •3.3. Морфологические исследования
- •4. Выбор методов
- •5.1. Оценка селективности методов
- •5.2. Оценка локализации окрашивания
- •5.4. Оценка чистоты реагентов
- •5.5. Номенклатура реагентов
- •6. Что необходимо для гистохимической работы
- •6.1. Оборудование и материалы
- •6.2. Как научиться работать?
- •7. Почему используются гистохимические методы
- •8. Благодарности
- •ФЛУОРЕСЦЕНТНАЯ МИКРОСКОПИЯ
- •1. Введение
- •2. Флуорохромы
- •3. Флуоресцентный микроскоп
- •3.1. Способы освещения
- •3.1.1. Освещение проходящим светом
- •3.1.2. Освещение падающим светом
- •3.2. Источники света
- •3.3. Домики для ламп
- •3.4. Фильтры
- •3.4.1. Возбуждающие фильтры
- •3.4.2. Запирающие фильтры
- •3.4.3. Цветные светоделительные зеркала
- •3.5. Объективы и окуляры
- •4. Применение флуоресцентных красителей
- •4.1. Нуклеиновые кислоты
- •4.1.1. Прижизненное окрашивание флуорохромами
- •4.2. Иммунофлуоресценция
- •4.3. Флуоресценция нейромедиаторов
- •4.4. Двойное окрашивание
- •5. Микрофлуориметрия
- •5.1. Введение
- •5.2. Стандарты флуоресценции
- •5.3. Оборудование
- •5.3.1. Инвертированные микрофлуориметры
- •5.3.2. Сканирующие микрофлуориметры
- •5.4. Измерения содержания ДНК
- •5.4.1. Оборудование
- •5.4.2. Подготовка материала
- •5.4.3. Процедура окрашивания
- •5.4.4. Проведение измерений
- •6. Анализ изображения при флуоресценции
- •7. Сканирующая лазерная микроскопия
- •8. Литература
- •МИКРОМЕТРИЯ И АНАЛИЗ ИЗОБРАЖЕНИЯ
- •1. Введение
- •2. Простая микрометрия
- •2.1. Измерения длины
- •2.1.3. Окуляр-микрометр сдвига
- •2.1.4. Другие методы измерения длины
- •2.2 Измерения углов
- •2.3. Измерение толщины
- •2.4. Счетные камеры
- •2.4.2. Техника работы с гемоцитометром
- •3.1.1. Определение АA в двухфазном препарате
- •3.2. Принципы измерения площади поверхности
- •4. Измерения с использованием дигитайзера
- •5.2. Измерения с помощью компьютера
- •6. Приборы и математическое обеспечение работ
- •7. Литература
- •ВИДЕОМИКРОСКОПИЯ
- •1. Видеомикроскопия и оборудование для нее
- •1.1. Введение
- •1.1.1. Видеоусиление
- •1.1.2. Видеоинтенсификация
- •1.1.3. Цифровая обработка изображения
- •1.2.1. Условия ограниченного числа фотонов
- •1.3. Различные методы видеомикроскопии
- •1.3.1. Видеомикроскопия с усилением
- •1.3.2. Аналоговое усиление контраста
- •1.3.3. Цифровая обработка изображения
- •1.4.1. Камеры и контроллеры камер
- •1.4.5. Видеопроцессорные платы
- •1.4.6. Монофункциональные процессоры
- •1.4.7. Взгляд в будущее
- •1.5. Условия, налагаемые на микроскоп
- •1.6. Как соединить телекамеру с микроскопом
- •2.1. Различные виды VEC-микроскопии
- •2.2. Приготовление препаратов
- •2.3. Получение изображения
- •2.4. Интерпретация изображений
- •2.5. Типичные применения и ограничения метода
- •2.5.1. Светлопольная микроскопия
- •2.5.2. Темнопольная микроскопия
- •2.5.4. Фазовый контраст
- •2.5.5. Поляризационная микроскопия
- •2.5.7. Отражательная контрастная микроскопия
- •2.5.8. Флуоресцентная микроскопия
- •2.5.9. Примеры применения в биологии и биохимии
- •3.1. Введение
- •3.2. Процесс формирования изображения
- •3.2.1. Условия, касающиеся микроскопа
- •3.2.2. Получение статических изображений
- •3.2.3. Получение изображений подвижных объектов
- •3.3. Типичные приложения
- •3.3.2. Картирование отношений
- •3.3.4. Визуализация молекул
- •3.3.6. Люминесценция
- •3.3.7. Нейробиология
- •4.1. Пространственные измерения
- •4.2. Измерения по интенсивности
- •5.1. Видеозапись и редактирование
- •5.1.1. Стандарты видеотехники
- •5.1.2. Форматы видеопленок
- •5.1.3. Качество видеопленок
- •5.1.4. Видеомагнитофоны
- •5.1.5. Видеомагнитофоны с цейтраферной записью
- •5.1.6. Запись при видеомикроскопии
- •5.1.8. Копирование и редактирование видеозаписей
- •5.2.1. Оборудование
- •5.3. Перенос видеозаписей в видеофильм
- •5.4. Рисование с монитора
- •6. Благодарности
- •7. Литература
- •1. Введение
- •2. Классификация сегментов хромосом
- •2.1. Гетерохроматиновые сегменты
- •2.2. Эухроматиновые сегменты
- •2.3. Ядрышковые организаторы
- •2.4. Кинетохоры
- •4.2. G-окрашивание
- •4.2.1. ASG-метод
- •4.2.3. Метод Галлимора и Ричардсона
- •4.3. R-окрашивание
- •4.4. Q-окрашивание
- •4.4.1. Q-окрашивание с помощью акрихина
- •4.5.2. Процедура окраски
- •5.1. Окрашивание ДАФИ/дистамицином
- •5.2.1. Метод культивирования клеток
- •5.2.2. Методика окраски
- •5.3.2. Синхронизация с помощью БУДР [39]
- •5.3.3. Синхронизация с помощью ФУДР [13, 40]
- •6. Наблюдение и регистрация сегментов хромосом
- •6.3. Фотографирование сегментированных хромосом
- •6.4.1. Получение профилей сегментов
- •6.4.2. Отражательная микроскопия
- •6.4.3. Измерение полиморфизма хромосом
- •7. Благодарности
- •8. Литература
- •9. Литература для дальнейшего чтения
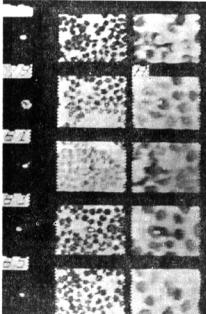
Вновь сконструированный многопараметрический микроскоп фирмы Leitz позволяет проводить одновременно анализ поглощения гемоглобина эритроцитов и флуоресценции меченных ФИТЦ клеток, содержащих гемоглобин S, причем можно анализировать миллионы клеток. Система (LEYTAS), соединенная с анализирующим изображение компьютером, сначала фокусируется и считает все эритроциты вдоль одного ряда полей зрения, используя нижнее освещение фиолетовым светом (415 нм). После сканирования по одной линии длиной 8 см освещение по команде компьютера меняется с проходящего на падающее, и все поля зрения вдоль линии сканирования анализируются повторно, причем сканирование для определения флуоресцирующих объектов ведется в соответствии с кривой ранее определенных положений фокуса. Для каждого определенного объекта его флуоресцентное и поглощающее изображение хранятся в памяти в виде уровней серого. Из памяти изображение выводится на телевизионный экран, что позволяет визуально оценить выбранные объекты (рис. 6.9). От каждого подозрительного сигнала в памяти сохраняется одно флуоресцентное и два поглощающих изображения. Визуальное сравнение флуоресцентного и поглощающего изображений при большом увеличении позволяет определить природу данного сигнала. Таким образом артефакты можно отличить от заслуживающих внимания клеток. То, что сигнал действительно соответствует мутантной клетке, подтверждается с помощью микроскопа. Поскольку все координаты сохраняются в памяти, то выставление клеток производится автоматически. Большинство сигналов являются артефактами. На рис. 6.9 только кадр № 79 относится, вероятно, к мутантной клетке [43], что можно было бы подтвердить с помощью микроскопа.
Рис. 6.9. Выявление с помощью системы LEYTAS подозрительных изображений в препарате, окрашенном меченной ФИТЦ сывороткой против S-гемоглобина. Эти изображения выводятся на монитор. Слева направо: номер кадра, его флуоресцентное изображение и изображение того же кадра, формирующееся за счет поглощения при большем увеличении
Другие антитела против мутантных эритроцитов были использованы Лэнглойсом с соавт. [44], определявшими мутантные клетки с помощью проточной цитометрии. Можно предположить, что частота выявленных в этой работе мутантов была значительно выше, чем частота встречаемости клеток с HbS.
Помимо определения редких мутантов, анализ изображения может быть также применен для определения редких раковых клеток в период ремиссии, а также инфицированных вирусом клеток на ранней стадии инфекционного заболевания.
7. Сканирующая лазерная микроскопия
Обычно в микроскопии изображения очень мелких структур получают путем освещения всего препарата и увеличения изображения объективом. При использовании вместе с микроскопом телевизионной камеры принцип получения изображения не изменяется — изображение также создается объектом, и лишь затем сканируется телекамерой. Фактически все методы сканирования применялись в основном в весьма ограниченной области микрофотометрии — для определения величин поглощения, флуоресценции или отражения. Недавно техника сканирования была применена для создания высококачественных изображений с помощью мощных и хорошо сколлимированных лазерных пучков. В оптической лазерной сканирующей микроскопии объект не освещается целиком, а сканируется шаг за шагом [17, 45—47]. В каждой освещенной точке измеряется прошедший, отраженный или испускаемый свет. Изображение создается за счет накопления результатов этих измерений для каждой точки после их аналоговой или цифровой обработки, как матрица в памяти компьютера.
В приборе, имеющемся в нашей лаборатории (Zeiss, ФРГ), сканирование выполняется с помощью гальванометров с сервоприводами. Время сканирования сравнительно короткое (2 с на поле из 512x512 пикселов). Процесс сканирования контролируется микропроцессором. В качестве фотодетектора используется ФЭУ. Его сигнал проходит через блок аналоговой обработки, который контролирует яркость и контрастность.
129
После оцифровки этот сигнал попадает в буферную память, куда он записывается с видеочастотой. Соответственно стационарное изображение на мониторе получается при условии, что во время считывания столик стоит неподвижно. Плавно меняющееся увеличение может быть получено с помощью блока переменного увеличения. Сканирующий лазерный микроскоп можно использовать как с обычным, так и с лазерным источником света. С помощью лазера можно получить как падающее освещение (для отражения и флуоресценции), так и проходящее освещение (для поглощения, фазового или дифференциального интерференционного контраста). В качестве обычного источника света можно использовать только лампу накаливания, снабженную световодом. Для обеспечения лучшей фокусировки и возможностей поиска на препарате, а также для исследования препаратов с двойным окрашиванием, мы добавили к лазерному сканнеру обычный блок эпиосвещения. Принципиальными преимуществами лазерного сканирования являются:
1)низкий уровень аутофлуоресценции в оптическом пути, который достигается благодаря точечному освещению;
2)высокая чувствительность микроскопа, возникающая вследствие использования мощного лазерного света, сфокусированного в точке. Можно наблюдать даже слабо флуоресцирующие ДНК-зонды;
3)использование оптики с малым увеличением. Интенсивность флуоресценции достаточно высока, что позволяет работать с объективом Х2,5. Это является важным преимуществом при проведении исследований мозга;
4)низкий уровень выцветания, так как время освещения каждой точки очень короткое;
5)возможность проведения многофакторного анализа;
6)последовательное сканирование на разных уровнях при конфокальной сканирующей микроскопии. Данный метод применяется в тех исследованиях, где надо работать с очень слабой флуоресценцией,
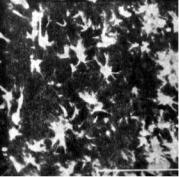
например при проведении реакции гибридизации. Лазерная сканирующая микроскопия много дала также для исследований мозга, поскольку она позволяет использовать оптику с малым увеличением, необходимую при исследовании связей в нервных сетях. На рис. 6.10 представлены нервные клетки из гиппокампа крысы. Эти клетки были маркированы для выявления специфических молекул. По сравнению с нормальной флуоресцентной микроскопией контраст между изображением и фоном, получаемый с помощью лазерного сканирования, намного выше: здесь остается только очень низкий уровень нежелательного фонового свечения. С помощью лазерного сканирования реакцию можно также оценить количественно, поскольку данная техника позволяет установить порог между клетками и фоном для улучшения контраста изображения, получаемого с препаратов с очень низким содержанием продукта реакции.
Кроме того, лазерное сканирование открывает новые возможности для исследования с помощью световой микроскопии без дополнительного окрашивания ультратонких срезов, изготовленных для электронной микроскопии [48, 49].
Рис. 6.10. Флуоресцентное изображение гиппокампа крысы, полученное с помощью лазерного сканирующего микроскопа. Срезы были обработаны флуоресцентно меченными антителами к гуанинмонофосфату. Увеличение: объектив Х40; окуляр ХЮ. Шкала 100 мкм.
8. Литература
1.Yong, M. R. (1961) Quart. J. Microsc. Sci., 102, 419.
2.Price, Z. H. (1965) Am. J. Med. Technol., 31, 45.
3.Rost, F. W. (1972) In Histochemistry, Theoretical and Applied. Everson Pearse, A. G (ed.), Churchill Livingstone, Edinburgh, Vol. 2, p. 1171,
4.Siegel, J. I. (1982) Int. Lab., 12, 46.
5.Ploem, J. S. and Tanke, H. (1987) Introduction to Fluorescence Microscopy. Royal Microscopical Society, University Press, Oxford.
6.Lansing Taylor, D., Waggoner, A. S., Murphy, R. F., Lanni, F. and Birge, R. R. (1986) Applications of Fluorescence in the Biomedical Sciences. Alan Liss, New York.
7Patzett, W. (1972) Lietz-Mitt. Wiss. und Techn., Bd V, Nr 7, 226.
8Giloh, H. and Sedat, J. W. (1982) Science, 217, 1252.
9Johnson, G. D. and de C. Nogueira Araujo, G. M. (1981) J. Immunol. Methods, 43, 349.
10Ploem, J. S. (1967) Zeitschrift Wiss. Microskopie, 68, 129.
11Nairn R. С (1976) Fluorescent Protein Tracing. Livingstone, Edinburgh.
12.Kraft, W. (1973) Leitz Techn. Inform., 2, 97.
130
