
2 курс / Гистология / Мяделец.Частная гистология
.pdf
– пре-В-лимфоцит; нзрВ – незрелый В-лимфоцит; зрВ – зрелый (наивный) В- лимфоцит; АГ – антиген; В-ИМБЛ – В- иммунобласт; ПЛВЛ – плазмобласт; ПЛЦ – плазмоцит; Вп – В-клетка памяти (по В.Л. Быкову)
В про-В-лимфоците еще не происходит реаранжировка генома. Она наблюдается на стадии пре-пре-В-лимфоцита. В пре-В-лимфоците в цито-
плазме появляются иммуноглобулины класса М. В незрелом В-лимфоците Ig M экспрессируется на цитолемме, а на поверхности зрелой клетки одновременно экспрессируются Ig M и Ig D.
Т-лимфоцитопоэз протекает по схеме: СКК КОЕ-Л про-Т пре-Т незрелый Т-лимфоцит зрелый Т-лимфоцит. Дифференциров-
ка В- и Т-лимфоцитов заключается в уменьшении размеров клетки, уплотнении ядра.
Зрелые лимфоциты, прошедшие антигеннезависимую дифференцировку (они называются «наивными» лимфоцитами, поскольку не имели контакта с антигенами) способны вновь превращаться в бластные клетки под влиянием антигена (реакция бласттрансформации, см. главу 21) и усиленно делиться, а затем повторно дифференцироваться, но уже в высокоиммунные клетки.
Т-лимфобласты дифференцируются в высокоиммунные Т-хелперы, Т-
цитотоксические лимфоциты и Т-лимфоциты памяти. Под влиянием ан-
тигена Т-цитотоксические лимфоциты далее превращаются в Т-киллеры. В- лимфобласты превращаются в плазмоциты, вырабатывающие антитела, и в
В-лимфоциты памяти.
Рис. 20.5. Развитие Т-лимфоцитов: 1 – антигеннезависимое, 2 – антигензависимое: ГСК – гемопоэтическая стволовая клетка; КОЕ-Л – колониеобразующая единица лимфоцитопоэза; про-Т – про-Т-лимфоцит; пре-Т – пре-Т-лимфоцит; нзр-Т - незрелый Т-лимфоцит; зрТ – зрелый (наивный) Т-лимфоцит; АГ – антиген; Т-ИМБЛ – Т-иммунобласт; Тх – Т-хелпер; Т-эфф – Т-эффектор; Тп – Т-клетка памяти
321
КОСТНЫЙ МОЗГ (КМ)
ФУНКЦИИ. 1. Красный костный мозг (ККМ) является универсальным гемопоэтическим органом. В нем находится основная часть стволовых кроветворных клеток, происходит развитие клеток миелоидного лимфоидного рядов, причем предпочтение отдается миелопоэзу. 2. ККМ является первичным органом иммуногенеза. В нем осуществляется антигеннезависимый В- лимфопоэз, в ходе которого образуются «наивные» В-лимфоциты. Кроме того, в ККМ протекают начальные этапы Т-лимфопоэза: образуются про-Т- лимфоциты, которые поступают в тимус, где в субкапсулярной зоне коры превращаются в пре-Т-лимфоциты (пре-Т-тимоциты). 3. Депонирующая функция ККМ выражается в том, что в нем накапливаются зрелые и заканчивающие дифференцировку форменные элементы крови. При экстремальных ситуациях (гипоксии, кровопотере и др.) они быстро мобилизуются в кровоток, что имеет важное приспособительное значение. 4. Участие в остеогенезе (в эмбриональном периоде). 5. КМ содержит стволовые клетки стромальных механоцитов, потомками которых являются фибробласты, фиброциты и адипоциты рыхлой соединительной ткани, ретикулярные клетки ретикулярной ткани, остеобласты и остеоциты костных, хондробласты и хондроциты хрящевых тканей.
РАЗВИТИЕ. Источником развития КМ является мезенхима. В эмбриогенезе костный мозг появляется на 2-м месяце в плоских костях и позвонках, на 4-м месяце - в трубчатых костях. В это время в нем происходит подготовка к гемопоэзу: накапливаются стволовые клетки крови и стволовые клетки стромальных механоцитов (СКСМ). СКСМ участвуют в остеогенезе и поэтому КМ в этот период называется остеобластическим. В нем формируется система костных перекладин, выполняющих опорную функцию для кроветворных клеток. С 12-14-й недель эти клетки формируются вокруг образовавшихся кровеносных сосудов, начинают делиться и дифференцироваться в клетки крови. С 20-й по 36-ю неделю эмбриогенеза костные перекладины в диафизе начинают усиленно резорбироваться остеокластами, в результате красный костный мозг постепенно перемещается в область эпифизов, а в диафизах в конце беременности нарастает количество жировых клеток и формируется желтый костный мозг.
СТРОЕНИЕ. У взрослых людей КМ подразделяется на красный и желтый костный мозг (соответственно ККМ и ЖКМ).
ККМ находится в эпифизах трубчатых костей, губчатом веществе плоских костей, костях черепа. Несмотря на территориальную разобщенность, функционально костный мозг связан в единый орган благодаря миграции клеток и регуляторным механизмам. Масса красного костного мозга составляет 1,3-3,7 кг (3-6% от массы тела).
Строение костного мозга в целом подчиняется строению паренхиматозных органов. Его строма представлена: 1. Основным компонентом стромы является ретикулярная ткань. 2. Жировая ткань или небольшие скопления
322

адипоцитов. 3. Эндост костных перекладин, образованный соединительной тканью. В этих компонентах находится множество кровеносных сосудов, в основном синусоидных капилляров, не имеющих базальной мембраны и со щелевидными порами в эндотелии. Межклеточное вещество стромы состоит из коллагеновых и ретикулярных волокон, гликопротеинов, протеогликанов
идругих биополимеров.
Впетлях ретикулярной ткани находятся гемопоэтические клетки на разных стадиях дифференцировки: от стволовой до зрелых (паренхима ор-
гана, Рис. 20.6)). Количество стволовых клеток в красном костном мозге наибольшее (5 106 клеток). Большинство развивающихся клеток крови формируют островки, представленные различными дифферонами клеток крови.
Рис. 20.6. Мазок красного костного мозга 1 – мегакариоцит; 2 – нейтрофильные гранулоциты; 3 – бласт; 4 – базофильный эритробласт; 5 – оксифильный эритробласт
Эритробластические островки обычно формируются вокруг макрофага, который называется клеткой-кормилкой. Клетка-кормилка захватывает железо, высвобождающееся в кровь из погибающих в селезенке старых эритроцитов, и отдает его образующимся эритроцитам для включения в ге-
моглобин. |
|
гранулобластические |
Созревающие |
гранулоциты формируют |
323
островки. Эти островки локализуются вблизи эндоста, в результате чего развивающиеся клетки гранулоцитарного ряда могут контактировать с ретикулярными клетками и преадипоцитами. Клетки тромбоцитарного ряда (мегакариобласты, про- и мегакариоциты) лежат рядом с кровеносными синусоидными капиллярами. Как отмечалось выше, лентовидные отростки мегакариоцитов проникают через поры эндотелия в капилляр, и от них постоянно отделяются тромбоциты. Вокруг кровеносных сосудов встречаются небольшие группы лимфоцитов и моноцитов.
Среди клеток костного мозга преобладают зрелые и заканчивающие дифференцировку клетки. В этом выражается депонирующая функция костного мозга. Они при необходимости поступают в кровь. В норме в кровь поступают только зрелые клетки. Предполагают, что при этом в их цитолемме появляются ферменты, разрушающие основное вещество вокруг капилляра, что облегчает выход клеток в кровь. Незрелые клетки таких ферментов не имеют. Второй возможный и наиболее вероятный механизм селекции зрелых клеток - появление у них специфических рецепторов, взаимодействующих с эндотелием капилляров. При отсутствии таких рецепторов взаимодействие с эндотелием и выход клеток в кровоток невозможны. Нельзя исключить также сочетание двух механизмов селекции зрелых клеток крови.
Наряду с красным костным мозгом существует желтый костный мозг. Он обычно находится в диафизах трубчатых костей. Желтый костный мозг состоит из ретикулярной ткани, которая местами заменена на жировую. Кроветворные клетки отсутствуют. Желтый костный мозг представляет собой своеобразный резерв для красного костного мозга. При кровопотерях в него заселяются гемопоэтические элементы, и он превращается в красный костный мозг. Таким образом, желтый и красный костный мозг можно рассматривать как два функциональных состояния одного кроветворного органа.
КРОВОСНАБЖЕНИЕ И ИННЕРВАЦИЯ КОСТНОГО МОЗГА
В кровоснабжении костного мозга принимают участие артерии, питающие кость. Поэтому характерна множественность его кровоснабжения. Артерии проникают в костномозговую полость и делятся на две ветви: дистальную и проксимальную. Эти ветви спирально закручиваются вокруг центральной вены костного мозга. Артерии разделяются на идущие радиально артериолы, отличающиеся небольшим диаметром (до 10 мкм). Для них характерно отсутствие прекапиллярных сфинктеров. Капилляры костного мозга подразделяются на истинные капилляры, возникающие в результате дихотомического деления артериол, и синусоидные капилляры (синусы) , продолжающие истинные капилляры. В синусоидные капилляры переходит только часть истинных капилляров, тогда как другая их часть вхо-
324
дит в гаверсовы каналы кости и далее, сливаясь, дает последовательно венулы и вены. Истинные капилляры костного мозга мало отличаются от капилляров других органов. Они имеют сплошной эндотелиальный слой, базальную мембрану и перициты. Эти капилляры выполняют трофическую функцию.
Синусоидные капилляры большей частью лежат вблизи эндоста кости и выполняют функцию селекции зрелых клеток крови в кровоток, а также уча-
ствуют в заключительных этапах созревания клеток крови, осуществляя воздействие на них через молекулы клеточной адгезии. Им свойственна также депонирующая функция. Диаметр синусоидных капилляров составляет от 100 до 500 мкм. На срезах синусоидные капилляры могут иметь веретеновидную, овальную или гексагональную форму. Они выстланы эндотелием с выраженной фагоцитарной активностью. В эндотелии имеются фенестры, которые при функциональной нагрузке легко переходят
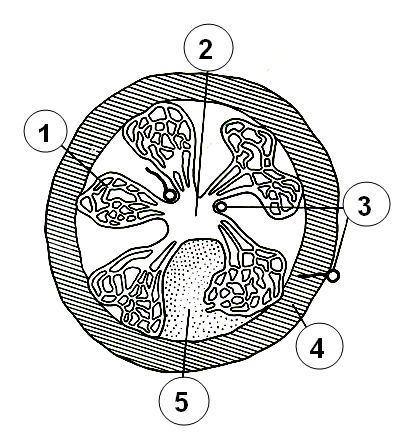
Рмс. 20. Схематическое изображение структурной организации костного мозга 1 – синусоиды; 2 – цен-
тральная вена; 3 - артерии; 4 – кость; 5 – гемопоэтическая ткань (по А.Я. Фриденштейну, Е.А. Лурия)
в истинные щелевидные поры. Базальная мембрана или отсутствует, или прерывистая. С эндотелием тесно связаны многочисленные макрофаги. Синусоиды продолжаются в венулы, те, в свою очередь, вливаются в централь-
ную вену безмышечного типа. Характерно наличие артериоло-венулярных анастомозов, по которым может сбрасываться из артериол и венулы, минуя синусоидные и истинные капилляры. Анастомозы являются важным фактором регуляции гемопоэза и гомеостаза кроветворной системы.
Афферентная иннервация красного костного мозга осуществляется миелиновыми нервными волокнами, образованными дендритами псевдоуниполярных нейронов спинальных ганглиев соответствующих сегментов, а также черепными нервами, за исключением 1, 2 и 8 пар.
325
Эфферентная иннервация обеспечивается симпатической нервной системой. Симпатические постганглионарные нервные волокна входят в костный мозг вместе с кровеносными сосудами, распределяясь в адвентиции артерий, артериол и в меньшей степени вен. Они также тесно связаны с истинными капиллярами и синусоидами. Факт непосредственного проникновения нервных волокон в ретикулярную ткань поддерживается не всеми исследователями, однако в последнее время показано наличие нервных волокон между гемопоэтическими клетками, с которыми они образуют так называемые “открытые синапсы”, когда нейромедиаторы из нервной терминали свободно выделяются в интерстиций, а затем, мигрируя к клеткам, оказывают на них регуляторное влияние. Большинство постганглионарных нервных волокон являются адренергическими, однако часть из них является холинергическими. Некоторые исследователи допускают возможность холинергической иннервации костного мозга за счет постганглионарных волокон, происходящих из параоссальных нервных ганглиев.
Прямая нервная регуляция кроветворения до сих пор ставится под сомнение, несмотря на обнаружение открытых синапсов. Поэтому считается, что нервная система оказывает трофические влияния на миелоидную и ретикулярную ткани, регулируя кровоснабжение костного мозга. Десимпатизация и смешанная денервация костного мозга ведет к деструкции сосудистой стенки и к нарушению гемопоэза. Стимуляция симпатического отдела ВНС приводит к усилению выброса из костного мозга в кровоток клеток крови.
ВЛИЯНИЕ НА КРОВЕТВОРЕНИЕ ЭКСТРЕМАЛЬНЫХ ФАКТОРОВ. РЕГЕНЕРАТОРНАЯ СПОСОБНОСТЬ И ТРАНСПЛАНТАЦИЯ
КОСТНОГО МОЗГА
Кроветворная система крайне чувствительна к действию вредных факторов и стресс-воздействиям. Особенно выраженное повреждающее действие на эту систему оказывают ионизирующая радиация, цитостатические препараты и гемотропные яды, опустошающие костный мозг из-за гибели пролиферирующих клеток, наиболее чувствительных к повреждающему действию. Стимулируют кроветворение гипоксия, физическая нагрузка.
В действии повреждающих факторов на кроветворение различают 3 стадии, совпадающие со стадиями стресс-реакции по Г. Селье.
1. Стадия напряжения. Характеризуется падением кроветворения сразу после включения повреждающего фактора.
2. Стадия резистентности. Характеризуется стабилизацией или даже суперкомпенсацией кроветворной функции.
3. Стадия истощения. Развивается при продолжающемся действии запредельного повреждающегося фактора и характеризуется резкой депрессией кроветворной системы.
Наряду с высокой чувствительностью к повреждающим факторам, компенсаторные и регенераторные возможности костного мозга очень высо-
326
кие, т.к. он образован камбиальными обновляющимися тканями. Регенерация костного мозга происходит за счет стволовых клеток крови и недифференцированных клеток ретикулярной ткани. Большое значение имеет также существование резерва в виде желтого костного мозга, быстро перестраивающегося и включающегося в кроветворение при кровопотерях. Все это позволяет кроветворной системе успешно противостоять (до определенного уровня) воздействию на организм многочисленных вредных факторов внешней среды. Вместе с тем, высокие регенераторные потенции костного мозга используются для трансплантации его при ряде заболеваний.
Трансплантация костного мозга. является одним из наиболее эффективных методов лечения острой лучевой болезни, а также злокачественных пролиферативных заболеваний системы кроветворения. Однако этот метод сопряжен с целым рядом трудностей, заключающихся в необходимости тщательного подбора донора, недостатке HLA-типированных доноров (доноров, соответствующих реципиенту по лейкоцитарным антигенам), возникновении целого ряда осложнений, в том числе реакции трансплантата против хозяина (РТПХ) и т.д. С целью подавления отторжения трансплантата используют и иммуносупрессию, т.е. подавление иммунной системы реципиента. В последнее время наряду с трансплантацией неочищенного костного мозга интенсивно разрабатываются методы трансплантации очищенного костного мозга, в том числе и высокоочищенных клетокпредшественников. Показано, что 1 млн высокоочищенных кроветворных клеток-предшественников эквивалентен одной дозе костного мозга, необходимого для одной трансплантации. Как установлено, стволовые гемопоэтические клетки можно успешно трансплантировать абсолютно нелеченному реципиенту, при этом вероятность восстановления гемопоэза достаточно высока. Однако встает вопрос выделения и очистки гемопоэтических клеток. В последнее время достаточно успешно разрабатываются новые методы клонирования гемопоэтических клеток. В частности, предлагают приме-
нять трансплантацию полустволовых клеток крови, так называемых CD34+ клеток периферической крови, которые предварительно выделяют и культивируют. Эти методы требуют серьезной теоретической и практической подготовки специалистовгемотрансфузиологов.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ И ЦИТОЛОГИЧЕСКИЕ МЕХАНИЗМЫ КРОВЕТВОРЕНИЯ. РЕГУЛЯЦИЯ КРОВЕТВОРЕНИЯ
Молекулярно-генетические механизмы кроветворения в принципе те же, что и для любой пролиферирующей системы. Их можно свести к следующим процессам.
1. Репликация ДНК; 2. Транскрипция; 3. Сплайсинг РНК (выреза-
ние из первоначальной молекулы РНК интронных участков и сшивка оставшихся частей); 4. Процессинг РНК с образованием специфических информационных РНК; 5. Трансляция - синтез специфических белков.
327
Цитологические механизмы кроветворения заключаются в процессах
деления клеток, их детерминации, дифференцировке, росте, запрограммированной гибели (апоптозе), межклеточных и межтканевых взаимодействиях с помощью молекул клеточной адгезии и др. Особенности не-
которых из этих процессов в ходе кроветворения были рассмотрены выше. Регуляторные механизмы кроветворения осуществляются на разных
уровнях.
1.Геномно-ядерный уровень. В ядре кроветворных клеток, в их геноме заложена программа развития, реализация которой приводит к образованию специфических клеток крови. К этому уровню в конечном итоге приложены все остальные регуляторные механизмы. Показано существование так называемых факторов транскрипции - связывающихся с ДНК белков различных семейств, функционирующих с ранних стадий развития и регулирующие экспрессию генов кроветворных клеток.
2.Внутриклеточный уровень сводится к выработке в цитоплазме кроветворных клеток специальных триггерных белков, влияющих на геном этих клеток.
3.Межклеточный уровень включает действие кейлонов, гемопоэти-
нов, интерлейкинов, вырабатываемых дифференцированными клетками крови или стромы микроокружения и влияющих на дифференцировку СКК.
4.Организменный уровень заключается в регуляции кроветворения интегрирующими системами организма: нервной (см. выше), эндокринной, иммунной и циркуляторной. Следует подчеркнуть взаимодействие этих систем при осуществлении своего регулирующего влияния на кроветворение. Эндокринная регуляция заключается в стимулирующем влиянии на гемопоэз анаболических гормонов (соматотропин, андрогены, инсулин, другие ростовые факторы). С другой стороны, глюкокортикоиды в больших дозах могут подавлять кроветворение, что используется в лечении злокачественных поражений кроветворной системы. Иммунная регуляция кроветворения тесно переплетается с межклеточным уровнем. Заключается в выработке клетками иммунной системы (макрофагами, моноцитами, гранулоцитами, лимфоцитами и другими клетками) медиаторов, гормонов иммунной системы, интерлейкинов и т.д., контролирующих процессы пролиферации, дифференцировки и апоптоза кроветворных клеток.
Наряду с регуляторными факторами, вырабатывающихся в самом организме, на гемопоэз оказывают стимулирующее влияние целый ряд экзогенных факторов, поступающих с пищей. Такими факторами, прежде всего, являются витамины, в первую очередь, витамин В12, фолиевая кислота, оротат калия, участвующие в процессах биосинтеза белка, в том числе и в кроветворных клетках.
328
ГЛАВА 21
ЛИМФОИДНАЯ СИСТЕМА КЛЕТОЧНЫЕ ОСНОВЫ ИММУННЫХ РЕАКЦИЙ. ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ ПЕРВИЧНЫХ И ВТОРИЧ-
НЫХ ОРГАНОВ ЛИМФОИДНОЙ СИСТЕМЫ
ОПРЕДЕЛЕНИЕ ИММУНИТЕТА. Слово “иммунитет” происходит от латинского слова “immunitas”, что означает “освобождение от чего-либо”.
Иммунитет - защитная реакция организма, направленная против всего генетически чужеродного: микроорганизмов, естественных и синтетических биополимеров, чужеродных или измененных собственных клеток и тканей.
Иммунитет обеспечивается неспецифическими и специфическими защитными механизмами организма. Неспецифические защитные меха-
низмы иначе называют врожденными. Они представляют собой комплекс морфофункциональных факторов, при помощи которых попадание в организм чужеродных агентов либо предотвращается, либо уже проникшие чужеродные агенты разрушаются в результате воздействия этих факторов. В любом случае отсутствует специфичность по отношению к чужеродному агенту. Неспецифическая защита организма обеспечивается следующими основными механизмами.
1.Механические факторы. К ним относятся, прежде всего, эпителиальные барьеры (эпидермис кожи, эпителий слизистых оболочек внутренних органов). Особенно выраженными барьерно-защитными свойствами обладают эпидермис и слизистая оболочка кожного типа с многослойным эпителием. Механическое удаление микроорганизмов с эпителия происходит при слущивании поверхностных слоев клеток многослойных эпителиев, а также
врезультате смывания их различными жидкостями: потом, мочой, слюной, слезой, слизью и др. В воздухоносных путях удалению болезнетворных агентов способствует направленное движение ресничек, транспортирующих по направлению к ротовой полости комочки слизи с адсорбированными микроорганизмами (так называемый мукоцилиарный транспорт). Удалению инородных веществ из воздухоносных путей способствуют кашель и чихание, из желудочно-кишечного тракта - рвота и понос.
2.Химические факторы. К ним относятся, прежде всего, низкие значения рН большинства секретов организма. Поверхность кожи в норме имеет рН 5,5 (так называемая кислотная мантия Маркионини, препятствующая размножению патогенных бактерий). Моча в норме также имеет кислую среду. Наиболее низкое значение рН, равное 2, имеет желудочный сок. Антибактериальным действием обладает фермент мурамидаза (лизоцим), вы-
329
деляемый на поверхность кожи и слизистых оболочек всех внутренних органов. Этот фермент разрушает пептидогликаны, основной компонент бактериальной стенки, в результате чего бактерии погибают от осмотического шока. К химическим факторам защиты относятся также лактоферрин (его действие основано на связывании железа, необходимого для жизни бакте-
рий), системы комплемента и пропердина (от лат. Properdere - защи-
щать), простагландины, интерфероны и ряд других химических агентов.
3. Клеточные факторы: гранулоциты (нейтрофилы, эозинофилы, базофилы), тканевые базофилы, моноциты, макрофаги. О роли этих кле-
ток в защитных реакциях будет сказано ниже. Они способны элиминировать чужеродные агенты как путем фагоцитоза, так и путем секреции ряда антибактериальных факторов (нефагоцитарные механизмы). Первые два механизма защиты называются неиммунной резистентностью, тогда как тре-
тий часто определяют как неспецифические факторы истинного иммуни-
тета.
Специфические защитные механизмы (приобретенные, приобретен-
ный иммунитет) возникают в результате первичного контакта с чужеродным агентом, в ответ на который в организме вырабатываются специфические к агенту средства защиты. Они заключаются либо в выработке антител (гу-
моральный иммунитет), либо в образовании эффекторных иммунокомпетентных клеток (клеточный иммунитет). И в том, и в другом случае про-
исходит элиминация чужеродного агента. Основными клетками специфических защитных механизмов являются Т-, В-лимфоциты и натуральные
киллеры (NK-клетки).
Иммунитет по механизму развития может быть активным и пассивным. Активный иммунитет - такой иммунитет, который возникает в результате активной выработки организмом средств защиты в ответ на проникновение антигена. Это происходит либо после перенесенной инфекцион-
ной болезни (естественный активный иммунитет), либо после введения в
организм вакцин, содержащих микроорганизмы (искусственный активный иммунитет). При пассивном иммунитете организм сам не вырабатывает средств защиты от антигена. Он получает в готовом виде антитела, цитокины, лимфоциты и другие факторы защиты или через плаценту, или с моло-
ком матери (естественный пассивный иммунитет), а также при введении готовых иммунных клеток, сыворотки, содержащей антитела (искусствен-
ный пассивный иммунитет).
Изучением механизмов иммунитета занимается ИММУНОЛОГИЯ -
наука о механизмах поддержания антигенного (иммунного) гомеостаза организма, защитных реакциях организма и невосприимчивости человека и животных к инфекционным болезням. Ее раздел, изучающий строение и функции иммунокомпетентных клеток, тканей и органов, а
330
