
2 курс / Гистология / Быков общий
.pdfлокна входят в состав базальных мембран (образуя их ретикулярную пластинку), располагаются между эпителиальными структурами в печени и почке, окружают капилляры и нервные волокна.
Клетки, обладающие способностью к выработке ретикулярных волокон, помимо фибробластов включают ретикулярные и жировые клетки, гладкие миоциты, кардиомиоциты, нейролеммоциты (клетки, образующие оболочку нервных волокон в периферической нервной системе). Эта способность характерна и для симпластических образований - волокон скелетной мышечной ткани.
Эластические волокна
Эластические волокна в соединительной ткани обычно содержатся в значительно меньшем количестве, чем коллагеновые, за исключением участков, обладающих подвижностью. На светооптическом уровне они выявляются при использовании избирательных методов окраски (чаще всего - орсеина). Эластические волокна варьируют по толщине в пределах 0.2-10 мкм, ветвятся и анастомозируют друг с другом, формируя трехмерные сети (см. рис. 10-1); в отличие от коллагеновых волокон, они обычно не образуют пучки.
Функции эластических волокон:
(1)определение архитектоники ткани;
(2)обеспечение способности ткани к обратимой деформации (к
возвращению к исходной форме после ее временного изменения).
Эластин - главный белковый компонент эластических волокон. Он составляет более 90% их массы и представлен гликопротеиновыми молекулами, имеющими в состоянии покоя форму скрученных нитей. При растяжении они распрямляются, а после прекращения действия нагрузки - вновь закручиваются. Молекулы эластина ковалентно "сшиты" друг с другом в комплексы, формирующие эластические волокна и пластинки (мембраны).
Структурные компоненты эластических волокон выявляются на электронно-микроскопическом уровне. Каждое волокно содержит: (а) центральный светлый (аморфный) компонент, образованный эластином, (б) периферический (микрофибриллярный) компонент, состоящий из волоконец толщиной 10-12 нм, образованных гликопрогеином фибриллином. Элементы микрофибриллярного компонента частично погружены в аморфный компонент
(рис. 10-8).
- 311 -
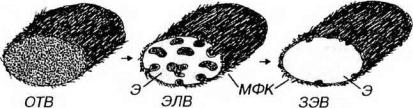
Рис. 10-8. Ультраструктурная организация волокон эластической системы. Эластическую систему образуют окситалановые волокна (ОТВ), которые в ходе эластогенеза постепенно превращаются в элауниновые волокна (ЭЛВ), а в дальнейшем - в зрелые эластические волокна (ЗЭВ). Фибробласты первоначально синтезируют микрофибриллы толщиной 10-12 нм, образованные гликопротеином фибриллином, которые связываются друг с другом, формируя ОТВ. Микрофибриллы служат структурной основой для последующего отложения эластина (Э). В ЭЛВ Э постепенно накапливается в центральной части, а микрофибриллы, образующие микрофибриллярный компонент (МФК), оттесняются к периферии и частично разрушаются. Зрелое эластическое волокно (ЗЭВ) содержит два компонента: центральный, аморфный, образованный Э, и периферический, МФК, частично погруженный в аморфный компонент.
Эластическая система - совокупность волокон, обладающих эластическими свойствами. Помимо собственно эластических волокон, являющихся ее основным и наиболее зрелым элементом, к ней относят также окситалановые и элауниновые волокна. Первые образованы микрофибриллами толщиной 10-12 нм, сходными с теми, которые окружают центральный аморфный компонент эластических волокон, вторые по строению занимают промежуточное положение между типичными эластическими и окситалановыми (см. рис. 10-8).
Синтез и взаимосвязь элементов эластической системы.
Микрофибриллярный компонент, первоначально синтезируемый фибробластами, как предполагают, служит структурной основой, на которую далее эти клетки откладывают эластин. Поэтому, по мере созревания эластического волокна, эластин постепенно накапливается в его центральной части, а микрофибриллярный компонент оттесняется к периферии волокна и в конечном итоге почти полностью разрушается. Таким образом, формирование эластического волокна (эластогенез) описывается последовательностью:
окситалановое волокно -> элауниновое волокно -> эластическое волокно
(см. рис. 10-8).
В соответствии с этой схемой окситалановые и элауниновые волокна можно рассматривать как незрелые эластические.
- 312 -
Клетки, вырабатывающие эластические волокна (помимо фибробластов) включают: гладкие миоциты, хондробласты и хондроциты. Микрофибриллы входят в состав межклеточного вещества мезангия в почечном клубочке, образуют волокна ресничного пояска (цинновой связки), удерживающие хрусталик.
Структурные изменения эластических волокон, обусловливающие нарушение их функциональных свойств, выявлены при ряде заболеваний, связанных с мутациями генов, кодирующих синтез соответствующих белков. У таких больных выявляется ненормальная растяжимость кожи, повышенная подвижность суставов, аномалии сердца и сосудов. При синдроме Марфана выявлено нарушение синтеза фибриллина (микрофибриллярного компонента эластических волокон). Такие больные погибают в возрасте до 35 лет (при неонатальной форме - в раннем детстве) преимущественно вследствие аномалий органов сердечно-сосудистой системы, неспособных выдерживать нормальные функциональные нагрузки (наиболее часто - вследствие разрыва аорты). Для этого синдрома характерны также изменения кожи, суставов, скелета, смещение хрусталика.
ОСНОВНОЕ АМОРФНОЕ ВЕЩЕСТВО РЫХЛОЙ ВОЛОКНИСТОЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Основное аморфное вещество заполняет промежутки между волокнистыми компонентами межклеточного вещества и окружает клетки. При изучении под светооптическим и электронным микроскопами оно имеет аморфное строение, прозрачно, характеризуется базофилией и низкой электронной плотностью. На молекулярном уровне оно обладает сложной организацией и состоит из макромолекулярных гидратированных комплексов протеогликанов (см. рис. 12-3) и структурных гликопротеинов.
Протеогликаны состоят из пептидной цепи, связанной с гликозаминогликанами (ГАГ). Строение молекулы протеогликанов описано в главе 12.
Глнкозамнногликаны (ГАГ) - крупные неразветвленные отрицательно заряженные гидрофильные полисахаридные молекулы, образованные повторяющимися дисахаридными единицами. Основными ГАГ в организме человека являются: гиалуроновая кислота, хондроитинсульфат, дерматансульфат, гепарансульфат и гепарин, а также кератансульфат. За исключением гиалуроновой кислоты, ГАГ связываются
- 313 -
с белками, образуя протеогликаны. Присутствие определенных типов ГАГ в различных тканях определяет свойства их межклеточного вещества, в частности, его проницаемость и способность связывать другие молекулы.
Протеогликаны синтезируются в грЭПС и комплексе Гольджи фибробластов, после чего выделяются механизмом экзоцитоза в межклеточное пространство, где они, вероятно, объединяются в крупные протео-гликановые агрегаты. Обновление протеогликанов в тканях происходит более интенсивно, чем коллагена. Они разрушаются рядом лизосомальных ферментов клеток соединительной ткани; при дефектах или недостаточности этих ферментов развиваются заболевания, обусловленные накоплением в клетках частично переваренных протеогликанов - мукополисахаридозы.
Распределение гликозаминогликанов в организме человека
Гликозаминогликаны |
Органы и ткани |
|
|
Гиалуроновая кислота |
Хрящ, синовиальная жидкость, кожа, пуповина, |
|
стекловидное тело, аорта |
|
|
Хондроитинсульфат, |
Хрящ, кость, кожа, кровеносные сосуды, сердце |
дерматансульфат |
|
|
|
Гепарансулъфат, |
Базальные мембраны, аорта, артерии легкого |
гепарин |
легкое, печень, кожа, гранулы тучных клеток |
|
|
Кератансульфат |
Хрящ, роговица, межпозвонковый диск (студенистое |
|
ядро) |
|
|
- 314 -
Функции протеогликанов:
(1)взаимодействие с молекулами коллагена (связаны с ними с через каждые 60-65 нм) и влияние на образование коллагеновых волокон (способствуют правильной укладке молекул тропоколлагена в фибриллах и фибрилл в волокнах и ограничивают их рост в толщину);
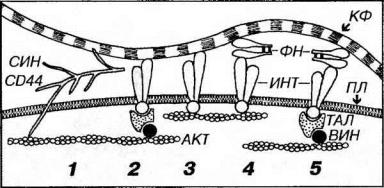
(2)обеспечение связи между поверхностью клеток и компонентами межклеточного вещества (фибронектином, ламинином и коллагеном). СD44 и синдекан пронизывают плазмолемму, прикрепляясь своим цитоплазматическим участком к элементам цитоскелета (актиновым микрофиламентам), а внеклеточным участком - к компонентам межклеточного вещества (рис. 10-9).
Аналогичную функцию выполняют интегрины (см. также главы 3 и 4) - адгезивные гликопротеины, которые через белки талин и винкулин связывают актиновые микрофиламенты цитоскелета с коллагеновыми волокнами - непосредственно или опосредованно - через молекулы фибронектина (см. рис.
10-9);
(3)играют важную роль в транспорте электролитов и воды благодаря связыванию большого количества молекул воды;
(5) связывают, накапливают и выделяют факторы роста (особенно активно эту функцию осуществляют гепарин и гепарансульфат);
Рис. 10-9. Различные механизмы связи клеток с компонентами межклеточного вещества. Актиновые микрофиламенты (АКТ) цитоскелета клеток взаимодействуют с коллагеновыми фибриллами (КФ) посредством ряда молекул - интегринов (ИНТ), синдекана (СИН), СD44, талина (ТАЛ), винкулина (ВИН) и фибронектина (ФН). Протеогликаны СИН и СD44 пронизывают плазмолемму (ПЛ), связывая АКТ и КФ (1) Адгезивные гликопротеины ИНТ связываются с АКТ прямо (3, 4) или с помощью белков ТАЛ и ВИН (2, 5). Взаимодействие ИНТ с КФ осуществляется непосредственно (2, 3) или опосредованно - через молекулы ФН (4, 5).
- 315 -
Наиболее важные протеогликаны рыхлой волокнистой соединительной ткани включают декорин (связывается с коллагеном и регулирует рост его фибрилл), верзикан (связывает поверхность клеток компонентами межклеточного вешества), перлекан, связывающийся с фибронектином и опосредующий прикрепление фибробласта к компонентам межклеточного вещества), синдекан (связывает поверхность клетки с фибронектином), СD44 (связывает поверхность клетки с фибронектином, ламинином и коллагеном).
Структурные гликопротеины представляют собой нефибриллярные белки, которые способствуют образованию базальных мембран, формированию фибрилл в межклеточном веществе, а также опосредуют взаимодействия между клетками и межклеточным веществом (благодаря присутствию соответствующих рецепторов на поверхности клеток). Они характеризуются разветвленной пептидной цепью, с которой связано небольшое количество простых гексоз. К наиболее важным структурным гликопротеинам относят фибронектин, ламинин и энтактин/нидо-ген.
Фибронектин - гликопротеин, синтезируемый фибробластами и другими клетками мезенхимного происхождения, а также эпителиоцитами. Он обеспечивает организацию компонентов межклеточного вещества: взаимодействует с ГАГ, связывается с коллагеном и опосредует прикрепление к нему тромбоцитов, фибробластов и других клеток, влияя на их различные функции (адгезию, подвижность, рост, синтетическую и секреторную активность).
Ламинин - гликопротеин, входящий в состав базальных мембран, связывается с молекулами коллагена IV типа и с рецепторами на поверхности клеток.
Энтактин/нидоген связывается с коллагеном IV типа и ламинином, входит в состав плотной пластинки базальной мембраны.
ВОСПАЛЕНИЕ
Координированное взаимодействие различных клеток рыхлой волокнистой соединительной ткани друг с другом и с элементами межклеточного вещества особенно отчетливо проявляется в таких важнейших взаимосвязанных процессах, как воспаление и регенерация.
Воспаление - эволюционно сформировавшаяся стереотипная защитноприспособительная реакция на местное повреждение, которая может быть вызвана действием различных факторов - экзогенных (инфекция, травма, ожог, гипоксия и др.) или эндогенных (очаг некроза, гемостаза, отложения солей, иммунных комплексов). Биологический
- 316 -
смысл воспаления состоит в ликвидации (или отграничении от здоровой ткани) очага повреждения и вызвавших его патогенных агентов, максимальное анатомическое восстановление ткани с минимальными функциональными нарушениями.
Острое воспаление продолжается от нескольких часов до нескольких суток и характеризуется преимущественным накоплением нейтрофильных гранулоцитов и белкового экссудата в участке повреждения ткани. Хроническое воспаление развивается в том случае, если острая реакция не обеспечила устранения повреждающего агента. При этом происходит инфильтрация ткани моноцитами, макрофагами и лимфоцитами, пролиферация фибробластов и рост мелких кровеносных сосудов. Процесс регенерации тесно связан с воспалением и обычно начинается сразу же после нейтрализации повреждающего агента.
Клиническими признаками воспаления (в особенности, острого), согласно классическим описаниям, являются: покраснение ткани (rubor), ее припухлость (tumor), повышение температуры (calor), боль (dolor) и нарушение функции (functio laesa). Хотя воспаление по своей сути служит защитной реакцией, в некоторых случаях его проявления не адекватны выраженности действия патогенного фактора и сами способны вызвать тяжелые повреждения тканей.
Фазы воспаления
В развитии воспалительной реакции традиционно выделяют три взаимосвязанные и частично перекрывающиеся фазы: (1) фазу альтерации, (2) фазу экссудации и (3) фазу пролиферации.
1. Фаза альтерации (от лат. alieratio - изменение, нарушение) характеризуется повреждением тканей и выделением медиаторов воспаления - комплекса биологически активных веществ, отвечающих за возникновение и поддержание воспалительных явлений. Компоненты поврежденных тканей выделяют хемотаксические факторы, в частности, деполимеризованные белково-гликозаминогликановые комплексы, свободные аминокислоты, полипептиды.
Медиаторы воспаления включают: (а) гуморальные медиаторы, поступающие из плазмы крови (кинины, факторы свертывания, производные комплемента) и (б) клеточные медиаторы, содержащиеся в цитоплазме или вырабатываемые в ответ на стимуляцию моноцитами, макрофагами, тучными клетками, гранулоцитами, тромбоцитами, лимфоцитами и др. клетками (биогенные амины, производные арахидоновой кис-
- 317 -
лоты - эйкозаноиды, лизосомалъные ферменты, активные метаболиты кислорода и др.). Характер и количество выделяемых медиаторов воспаления совместно с природой, выраженностью и распространённостью действия повреждающего фактора, определяют всю последующую картину воспалительной реакции.
2. Фаза экссудации (от лат. exudatio - выпотевание) включает: (1) изменения микроциркуляторного русла, (2) формирование жидкого (бесклеточного) экссудата (3) формирование клеточного экссудата (эмиграцию лейкоцитов),
(1)Изменения микроциркуляторного русла. Реакция сосудов в очаге воспаления начинается с кратковременного (длительностью от нескольких секунд до нескольких минут) спазма мелких артерий и артериол, который сменяется их расширением (позднее - также капилляров и венул. Возникает артериальная, а затем и венозная гиперемия (продолжается от нескольких часов
-до нескольких суток), которая проявляется типичными местными признаками воспаления - покраснением ткани и повышением ее температуры. Механизм гиперемии связан с выделением вазоактивных веществ - медиаторов воспаления (гистамина, кининов, серотонина, ФАТ, лейкотриенов и др.) макрофагами, тучными клетками, базофилами, эндотелиальными клетками и тромбоцитами.
(2)Формирование жидкого (бесклеточного) экссудата. Факторами,
обеспечивающими усиленную экссудацию жидкой части крови в ткани служат: (а) Резкое увеличение проницаемости стенок микрососудов (наиболее
выраженное в венулах) в очаге воспаления под действием указанных медиаторов, а также микробных ферментов. Происходит в результате усиления везикулярного транспорта, а также сокращения эндотелиальных клеток с появлением щелей между ними.
(б) Повышение гидростатического давления в сосудах вследствие гиперемии ткани.
(в) Увеличение осмотического и онкотического давления в очаге воспаления (в результате альтерации тканей с расщеплением макромолекул).
Отек ткани возникает вследствие усиленной экссудации жидкой части крови в участок воспаления при снижении активности венозного оттока и лимфооттока и клинически проявляется возникновением припухлости. Выделение кининов и повышенное гидростатическое давление обусловливают боль в области очага воспаления и нарушение функции органа.
- 318 -
Экссудация способствует притоку в очаг альтерации: (а) бактерицидных факторов сыворотки (антител, компонентов комплемента); (б) ИФНу - неспецифического противовирусного агента; (в) фибриногена, превращающегося в фибрин (который играет роль цементирующего вещества, связывающего различные ткани, является барьером, препятствующим распространению микроорганизмов, и фактором, усиливающим их поглощение фагоцитами); (г) фибронектина, оказывающего на лейкоциты хемоаттрактантное и адгезивное действие.
Замедление кровотока в расширенных сосудах усугубляется нарушениями реологических свойств крови в результате ее сгущения и изменения состава (изза усиленной экссудации), что способствует маргинации (краевому стоянию), адгезии и последующей эмиграции (выселению) лейкоцитов. При резком повреждении эндотелия проницаемость его пласта может увеличиваться столь значительно, что будет происходить выход (диапедез) эритроцитов за пределы сосудистого русла.
(3) Формирование клеточного экссудата (эмиграция лейкоцитов). По мере замедления кровотока активируются адгезивные взаимодействия лейкоцитов с эндотелиальными клетками (преимущественно посткапиллярных венул): сначала усиливается их качение по поверхности эндотелия, в дальнейшем оно сменяется прочным прикреплением лейкоцитов к эндотелию и их распластыванием по его поверхности. Эти процессы обусловливаются изменением экспрессии адгезивных молекул на поверхности как эндотелия сосудов, так и лейкоцитов, вызванным локальным действием цитокинов и медиаторов воспалительных реакций (см. главу 7).
После прикрепления к стенке микрососудов лейкоцита мигрируют через межклеточные промежутки в эндотелиальной выстилке и базальную мембрану за пределы сосуда. Этот процесс обычно занимает от 3 до 30 мин. (интервалы очень вариабельны). Далее они перемещаются по межклеточному веществу в очаг повреждения тканей под действием хемотаксических факторов.
Клеточный состав экссудата на разных сроках после альтерации определяется закономерной избирательностью и последовательностью эмиграции отдельных видов лейкоцитов в участок повреждения тканей. Он обусловлен (а) природой повреждающего агента (например, характером продуктов жизнедеятельности микроорганизмов и веществ, образующихся в тканях под влиянием микробных ферментов); (б) особенностями медиаторов воспаления, выделяющихся в ответ на повреждение; (в) дифференциальной (меняющейся во времени) экспрессией ад-
- 319 -
гезивных молекул на эндотелии и лейкоцитах при их стимуляции (в значительной мере связанной с действием медиаторов воспаления). Последовательное выселение в очаг клеток различных типов соответствует тем задачам, которые каждый из них способен выполнить исходя из своих функциональных особенностей.
Нейтрофильные гранулоциты, как правило, наиболее активно выселяются в ткань на начальных этапах острого воспаления (первые 6-24 ч). Они появляются в очаге уже через 10 мин., а через 4-6 ч их содержание в нем обычно достигает пика (составляя более 90% всех клеток). Нейтрофильные гранулоциты в очаге воспаления благодаря наличию мощных антимикробных систем (см. главу 7) выполняют фагоцитарную и микробицидную функции, блокируя проникновение микроорганизмов в окружающие ткани внутренней среды. Продукты их распада, а также вещества, выделяющиеся из полностью или частично разрушенных микробных клеток, вызывают приток новых нейтрофилов, а позднее - моноцитов и макрофагов.
Моноциты преобладают в экссудате через 16-24 ч, их содержание в очаге максимально обычно на третьи сутки. Одновременно с ними или несколько позднее эмигрируют лимфоциты. Моноциты крови, которые интенсивно выселяются в очаг воспаления, последовательно превращаются в незрелые, а в дальнейшем - в зрелые макрофаги (см. главу 7). Макрофаги сначала концентрируются по периферии зоны повреждения, содержащей живые и погибшие нейтрофильные гранулоциты, затем проникают вглубь нее. Они активируются под действием цитокинов и микробных продуктов и фагоцитируют погибшие нейтрофилы, клеточный детрит и микроорганизмы, формируя второй отграничивающий (антимикробный) барьер. Однако роль макрофагов, очевидно, не сводится к фагоцитозу и уничтожению патогенного агента, а включает выявление его антигенных детерминант и инициацию иммунной реакции (антиген-представляющая функция).
Хроническое воспаление. Описанные защитные гуморальные и клеточные механизмы, участвующие в острой воспалительной реакции обычно устраняют патогенный фактор в течение 4-6 нед. (в большинстве случаев - за 1.5-2 нед.). Если этого не происходит в указанные сроки, то говорят о том, что воспалительный процесс приобретает хроническое течение. По мнению ряда авторов, в некоторых случаях воспаление изначально может развиваться как хроническое. При хроническом воспалении в очаге численно преобладают макрофаги и лимфоциты, которые часто образуют компактные скопления - гранулемы. Макрофаги в очаге хронического воспаления способны преобразовываться:
- 320 -
