
6 курс / Гастроэнтерология / Хронический_билиарнозависимый_панкреатит_Казюлин_А_Н_,_Кучерявый
.pdfдругих органов желудочно-кишечного тракта,
-предотвратить развитие жировой инфильтрации печени,
-уменьшить рефлекторную возбудимость желчного пузыря.
При наличии у больного белково-энергетической недостаточности назначают анаболические гормоны с мультивитаминоминеральными комплексами. При упорной полифекалии и стеатореи показано увеличение дозы полиферментных препаратов (до 150000 ЕД FIP) и дополнительным введением нутриционной поддержки.
Нутритивная поддержка – процесс обеспечения полноценного питания с помощью ряда методов, отличных от обычного приема пищи, включающий в себя дополнительное оральное питание, энтеральное зондовое питание, частичное или полное парентеральное питание.
Основные цели нутритивной поддержки:
1.Обеспечение организма субстратами донаторами энергии (углеводы и липиды) и пластического материала (аминокислоты).
2.Поддержание активной белковой массы.
3.Восстановление имеющихся потерь.
4.Коррекция гиперметаболических (катаболических) расстройств.
Основные принципы проведения нутритивной поддержки включают своевременное начало (первые 24-48 часов), оптимальность срока проведения (до нормализации нутритивного статуса) и адекватность (сбалансированность) по составу питательных веществ.
Нутритивная коррекция у больных с обострением ХП имеет несомненную актуальность. В случае тяжелого течения ХП больные не в состоянии адекватно потребностям принимать пищу в течение 3-6 недель, что, по данным большинства современных публикаций, требует проведения дополнительного парентерального питания. В то же время, отсутствие полноценного поступления питательных веществ естественным путем в течение такого длительного срока, приводит к бактериальной контаминации тонкой кишки с избыточным бактериальным ростом, что ухудшает не только общее состояние больных и прогноз заболевания, но и угрожает серьезными осложнениями. Длительное ограничение энтерального питания приводит к атрофии слизистой кишечника и значительным иммунным сдвигам, что увеличивает сроки госпитализации и удлиняет реабилитационный период. Учитывая длительное ограничение энтерального питания, нарушение биоценоза кишечника и невозможность обеспечить при парентеральном введении адекватного поступления витаминов и минералов, больные с тяжелым течением ХП часто страдают от витаминно-минеральной недостаточности; кроме того, отмечается ограничение поступления жиров, необходимых для усвоения жирорастворимых витаминов. Эти механизмы приводят к значительному снижению поступления в организм важнейших компонентов витаминоминерального антиоксидантного комплекса (вит. А, Е, К, С, каротиноиды, флавоноиды; Zn, Se). Ограничение поступления белков затрудняет осуществление ряда биохимических процессов в организме, в том числе репарационных. При рецидивирующем течении ХП в большинстве случаев развивается экзокринная недостаточность ПЖ, проявляющаяся синдромом мальабсорбции, что приводит к усугублению имеющихся нарушений.
До недавнего времени проблема искусственного питания пациентов с отечным панкреатитом решалась исключительно парентеральным путем. Рекомендовались ежедневные внутривенные инфузии аминокислотных растворов
в объеме до 1,0 л в сутки; концентрированные растворы глюкозы с инсулином и электролитами от 1,5 до 2,0 л в сутки; жировые эмульсии от 0,5 до 1,0 л в сутки. Однако путем назначения только парентерального питания добиться компенсации катаболических потерь организма полностью не удается. В последние годы в специальной литературе все более широко обсуждается возможность проведения раннего энтерального питания больных с ОП и обострением ХП. Это связано также и с тем, что у больных тяжелым панкреатитом при длительном полном парентеральном питании отмечается бактериальная транслокация через атрофированную стенку тонкой кишки, угрожая тяжелыми гнойными и септическими осложнениями. Энтеральное зондовое питание более физиологично, способствует нормальному функционированию тонкой кишки, предотвращает атрофию ворсинок тонкокишечного эпителия, увеличивает кровообращение в мезентеральных сосудах и создает функциональный покой для ПЖ. Существуют указания, что при использовании методики энтерального зондового питания отмечается более быстрая редукция клинико-лабораторных маркеров обострения ХП с сокращением средних сроков стационарного лечения и реже возникает необходимость в оперативных вмешательствах при некротических формах панкреатитов, чем при применении полного парентерального питания. Кроме того, энтеральное зондовое питание менее дорогостоящее, чем парентеральное.
Как было описано выше, существует три основные фазы экзокринной стимуляции ПЖ: церебральная, желудочная и кишечная. При энтеральном питании через назоеюнальный зонд, установленном на 30-40 см дистальнее связки Трейца, все три фазы экзокринной стимуляции ПЖ исключаются. Отсутствие дуоденального пассажа питательных веществ снижает энтеропанкреатическую стимуляцию, выброс антрального гастрина, секрецию соляной кислоты и, следовательно, секретина, который усиливает гидрокинетическую функцию ПЖ и желчеобразование.
Противопоказаниями к энтеральному зондовому питанию являются: парез кишечника; полная тонкоили толстокишечная непроходимость (например, механическая); неукротимая рвота; высокая кишечная фистула; ишемия кишечника; несостоятельность межкишечного анастомоза.
Применение энтеральных смесей имеет ряд преимуществ по сравнению с традиционной диетой:
•Точно известный химический состав и питательная ценность;
•Содержание необходимых для организма веществ в сбалансированных соотношениях;
•Наличие в составе этих смесей белков с высокой биологической ценностью (полный набор аминокислот в оптимальных количествах);
•Отсутствие холестерина, лактозы, сахарозы, глютена;
•Возможность изменять состав применяемой смеси за счет введения различных модулей, а также менять непосредственно смеси, различающиеся как по составу, так и по осмолярности, органолептическим свойствам и т.д.
Осложнения энтерального зондового питания:
1.Механические (скручивание зонда, обструкция просвета зонда);
2.Осложнения со стороны пищевода – осаднение слизистой пищевода при установке зонда, эзофагит, эрозии, язвы и стриктуры пищевода;
3.Осложнения со стороны носоглотки – эрозии слизистой оболочки носа, некроз хрящей носа, окклюзия устьев придаточных пазух носа и евстахиевой трубы со стороны установки зонда – развитие синуситов и/или среднего отита;
4.Трахеопищеводный свищ (при одновременном введении назотрахеальной или трахеостомической трубок);
5.Легочная аспирация желудочного содержимого;
6.Желудочно-кишечные осложнения (тошнота, рвота, запор, диарея) чаще всего связаны со смещением зонда. Так, при смещении зонда в дистальном направлении (более 40 см от связки Трейтца) нередко развивается диарея, а смещение в проксимальном направлении способствует возникновению тошноты и рвоты, появлению болей в эпигастральной области, ведет к повышению температуры тела и уровня амилазы крови.
7.Метаболические осложнения (гипо- и гипернатриемия, гиперкальциемия, азотемия, гипергликемия, гиперосмолярный и метаболический алкалоз).
Имеет смысл добавлять в смеси полиферментные препараты, которые не только облегчают усвоение нутриентов (при приеме полуэлементных и негидролизованных смесей), но и тормозят выработку панкреатических ферментов по принципу обратной связи. Завершение энтерального искусственного питания и переход на пероральное питание следует осуществлять только после ликвидации воспалительных явлений в ПЖ, восстановления аппетита и способности пациента поддерживать свои потребности естественным путем. При наличии анорексии, неадекватности белково-энергетического обеспечения сочетают пероральное питание с дополнительным оральным приемом питательных смесей, энтеральным зондовым или парентеральным. При тяжелых панкреатитах применяется смешанное (энтеральное зондовое + парентеральное) питание.
При проведении занятий школы на основании приведенных данных необходимо указать, что на данный момент больным ХП необходимо назначать традиционную диету с дополнительным введением энтерального питания для повышения общего калоража, восполнения дефицита эссенциальных факторов питания и уменьшения стимуляции внешнесекреторной функции ПЖ (последнее относится к обострению ХП). Кроме того, научно обоснованным является изолированное пероральное питание смесями для энтерального питания (преимущественно гидролизованными) в ранние сроки от начала обострения ХП.
7.3. Фармакотерапия билиарнозависимого ХП
Главной целью консервативной терапии ХП является уменьшение или купирование болевого абдоминального синдрома, редукция отечно – интерстициальных изменений ПЖ и предотвращение или компенсация функциональной панкреатической недостаточности. При рецидиве болевого абдоминального синдрома у больного ХП в первую очередь необходимо оценить «свежие» структурные изменения ПЖ (отек, псевдокиста, папиллит, стриктура или камень ГПП или холедоха, объемное образование), что в целом и будет определять дальнейшую тактику ведения больного – продолжение и/или модификация фармакотерапии, эндоскопическое или хирургическое лечение.
I. Купирование боли.
Купирование болей является наиболее важной задачей в лечении ХП и опирается на следующие основополагающие мероприятия: исключение алкоголя и табакокурения, лечебное питание и фармакотерапия.
Ненаркотические и наркотические анальгетики. До сих пор применение анальгетиков остается одним из главных методов купирования боли у больных
ХП. При обострении ХП, анальгетики вводятся парентерально, начиная с парацетамола и нестероидных противовоспалительных средств. У многих больных ХП без отечных изменений со стороны ПЖ, явлений панкреатической обструкции и осложнений панкреатита (крупные псевдокисты, свищи, дуоденальная непроходимость и др.) нередко сохраняются выраженные абдоминальные боли, обусловленные ишемией и прогрессирующим фиброзом в зонах прохождения сенсорных нервов, что требует и амбулаторной терапии пероральными анальгетиками. В этом случае препаратами первого выбора являются салицилаты или ацетоминофен, которые необходимо принимать до еды для предотвращения постпрандиального усиления боли. Ввиду того, что минимально негативным воздействием на слизистую оболочку желудка обладает парацетамол, показавший хороший эффект для купирования боли у пациентов с ХП, именно этот препарат в последние годы считается наиболее предпочтительным.
Дозы анальгетиков подбираются индивидуально, причем должна использоваться самая низкая эффективная доза. При неэффективности ненаркотических анальгетиков, возможно их применение в максимально допустимых суточных терапевтических дозах, изменение режима приема и пути введения или попытка замены препарата на другой препарат этой группы. В частности имеются данные, что при ХП эффективны лишь высокие дозы анальгетиков, так, трамадол эффективнее в суточной дозе 800 мг, что в 2 раза превышает максимально рекомендуемую дозу.
Другим путем повышения эффективности обезболивающей терапии является дополнительное включение в схему психотропных препаратов (нейролептики, антидепрессанты, транквилизаторы), оказывающих как прямое аналгезирующее, так и потенцирующее действие в отношении ненаркотических анальгетиков. Кроме того, важны и собственные эффекты этих препаратов, поскольку у многих больных наблюдаются пограничные расстройства психики, тревожнодепрессивные и другие невротические расстройства. В случаях резистентности к ненаркотическим анальгетикам могут быть применены опиаты и их синтетические аналоги. Основным ограничением к широкому применению наркотических анальгетиков является развитие лекарственной зависимости.
Панкреатические ферменты в купировании боли. Начиная с 70-х годов прошлого века, было проведено несколько экспериментальных исследований, предполагающих, что внутрипросветное действие панкреатических протеаз играет важную роль в регулировании панкреатической секреции. Было показано, что эвакуация панкреатического секрета из ДПК стимулирует экспрессию холецистокинина (ХК) и секрецию панкреатических ферментов.
С другой стороны, внутридуоденальное введение трипсина или химотрипсина ингибируют экспрессию ХК и панкреатическую секрецию ферментов. Позже было доказано, что увеличение уровня в плазме крови ХК и усиление панкреатической секреции после удаления панкреатического сока из ДПК, обусловлено трипсинчувствительным субстратом, секретируемым проксимальными отделами кишечника и названным впоследствии ХК-рилизинг фактор. В присутствии трипсина ХК-рилизинг фактор, являясь пептидом, разрушается и, таким образом, инактивируется. Белок пищи в тонком кишечнике связывает трипсин, условно конкурируя с ХК-рилизинг фактором за фермент, и только излишек трипсина может инактивировать ХК-рилизинг фактор. Увеличение концентрации ХКрилизинг фактора в просвете тонкой кишки вызывает экспрессию ХК,
стимулирующего, в свою очередь, панкреатическую секрецию.
Аналогичный механизм обратной связи у человека был впервые описан в 1977 году. В дальнейшем, несколько групп исследователей подтвердили, что внутрикишечное введение трипсина или химотрипсина ингибируют секрецию ферментов ПЖ. Таким образом, представляется логичным, что у пациентов с ХП, сниженная секреция панкреатических ферментов при внешнесекреторной недостаточности может приводить к гиперстимуляции ПЖ высокими уровнями ХК в плазме крови, и, следовательно, к болевому абдоминальному синдрому. Эти факты позволили G.Isakson и I.Thse еще в начале 80-х годов по данным проведенных контролируемых исследований обосновать применение полиферментных препаратов с высокой протеолитической активностью для уменьшения боли при ХП посредством дуоденопанкреатического механизма обратной связи. Эффективность терапии в отношении снижения выраженности болевого абдоминального синдрома достигла 30%, в то время как урежение приступов отмечено у 78% больных.
Соматостатин и октреотид. Соматостатин – природный гормон, эффекты которого включают ингибирование секреции ПЖ и цитопротективное действие, что теоретически может быть полезно в лечении ХП. Кроме того, клинические исследования показали, что соматостатин имеет антиноцицептивную активность у человека и у животных.
Октреотид – синтетический пролонгированный аналог соматостатина, в ряде исследований показал хороший ингибирующий эффект в отношении экспрессии ХК, базальной и стимулированной панкреатической секреции. Длительность действия октреотида проявляется при подкожном введении, что представляется хорошей практической альтернативой для лечения ХП по сравнению с коротко действующим нативным соматостатином. К сожалению, широкомасштабных контролируемых испытаний, в которых бы оценивался эффект октреотида при болевых формах ХП до сих пор не проведено.
Антисекреторные препараты. Снижение экзокринной функции ПЖ можно достичь не только прямым подавлением панкреатической секреции, но и опосредованно через ингибирование синтеза соляной кислоты, которое приводило бы к уменьшению образования секретина и, в определенной мере, ХК. С этой целью в последние годы все чаще применяют комбинацию ферментных препаратов и блокаторов Н2-рецепторов гистамина и ингибиторов протонной помпы (ИПП). В целом, при сравнении эффективности разных групп антисекреторных препаратов, было выявлено, что ИПП более эффективны при купировании боли у больных ХП, чем блокаторы Н2-рецепторов гистамина. Это объясняется механизмом действия ИПП, которые подавляют работу системы, непосредственно обеспечивающей секрецию соляной кислоты.
Таким образом, антисекреторные препараты необходимо вводить в схему комплексного лечения обострения ХП, эффективное лечение ХП возможно лишь при довольно длительном снижении кислотности желудочного сока.
Другие подходы к купированию боли при ХП. При отработке тактики лечении болевого абдоминального синдрома у больных ХП необходимо учитывать наличие нарушений моторики желчного пузыря, модификация которой обеспечит нормальный пассаж секрета ПЖ. Немаловажную роль в генезе болевого синдрома играет дуоденальная гипертензия, которая, по данным разных авторов может встречаться в 40% случаев ХП.
Гипермоторные нарушения требуют назначения спазмолитиков, а при гипомоторных нарушениях применяют прокинетики в терапевтических дозах.
Отток желчи и панкреатического секрета может быть затруднен вследствие воспаления БДС, что требует назначения антибактериальной терапии – полусинтетических пенициллинов, препаратов тетрациклинового ряда, цефалоспоринов, макролидов, выделяющихся в достаточных концентрациях с желчью.
При дисфункции сфинктера Одди и дискинетических расстройствах кишечника, играющих как известно немалую роль в генезе болевого абдоминального синдрома у больных ХП, хороший эффект показал селективный миотропный спазмолитик мебеверин (Дюспаталин). Препарат обладает двойным механизмом действия – блокирует натриевые каналы клеточной мембраны и поступление натрия и кальция в клетку, а также блокирует депо кальция, ограничивая выход калия из клетки, что препятствует развитию гипотонии (Рисунок 22). По сути, препарат является нормализатором моторики ЖКТ, сочетая в себе спазмолитический и прокинетический эффекты.
Таким образом, терапевтические дозы мебеверина гидрохлорида (400 мг в сутки) обеспечивают эффективное спазмолитическое действие на желудочно-кишечный и билиарный тракт. Высокая селективность в отношении гладкомышечной клетки желудочно-кишечного тракта и отсутствие системных побочных эффектов позволяют использовать дюспаталин у самого широкого круга пациентов, в том числе и при лечении больных, имеющих сопутствующие заболевания сердечнососудистой системы, глаукому, аденому предстательной железы. По экспериментальным и клиническим данным мебеверин в короткий срок нормализует моторную функцию билиарного тракта, моторику сфинктеров и сократительную способность желчного пузыря, уменьшает дуоденальную гипертензию и дуодено-гастральный рефлюкс, способствует снижению литогенных свойств желчи и улучшению ее коллоидной стабильности. Соответственно, отмечен хороший эффект мебеверина в лечении функциональных расстройств и боли у пациентов ЖКБ и после холецистэктомии, при остром холецистите, холедохолитиазе и ОП, что в целом открывает новые возможности применения дюспаталина в панкреатологии, особенно у больных с билиарнозависимыми формами ХП.
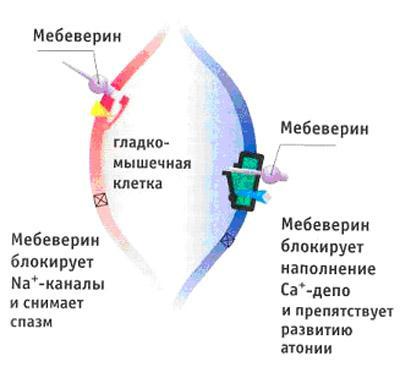
Рис. 22. Механизм действия дюспаталина.
Алгоритмы купирования боли при ХП. В работе практического врача Достаточно сложно разобраться в огромном перечне различных препаратов, применяемых для купирования боли у больных ХП. Поэтому мы сочли актуальным привести наиболее известные и адекватные на наш взгляд алгоритмы, упрощающие и стандартизирующие работу практикующих врачей в условиях страховой медицины. В первую очередь необходимо привести алгоритм, рекомендованный ВОЗ для лечения боли в панкреатологии. Правда, этот алгоритм к настоящему моменту можно считать не совсем полным и несколько устаревшим, поскольку он разрабатывался на основе имеющихся 15 лет назад данных о патофизиологии боли и эффективности различных препаратов с позиций медицины, основанных на доказательствах.
Ступень 1: этиотропная терапия, включая лечение алкоголизма, диета. Ступень 2а: периферические анальгетики (парацетамол)
Ступень 2б: периферические + слабодействующие центральные анальгетики (трамал, стадол)
Ступень 2в: ступень 2а + нейролептик или антидепрессант Ступень 3: опиоиды, факультативно ограниченные ступенью 2а.
В 1998 году Американская гастроэнтерологическая ассоциация предложила алгоритм лечения ХП с болевым синдромом, ориентируя врача на выбор оперативной или консервативной коррекции заболевания по результатам диагностических тестов (Рисунок 23).
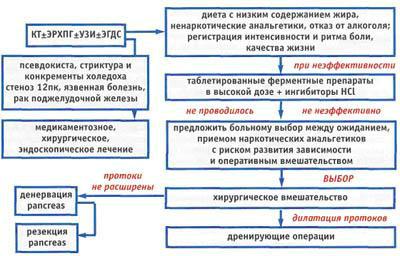
Рис. 23. Алгоритм лечения больного хроническим панкреатитом с болевым синдромом (рекомендации Американской гастоэнтерологической ассоциации, 1998 г.) .
Для купирования боли рекомендуется прием высокой дозы традиционных полиферментных препаратов в сочетании со средствами, ингибирующими желудочную секрецию. При неэффективности вышеуказанных мероприятий проводится выбор между продолжительным приемом наркотических анальгетиков и инвазивным лечением. Согласно классическим представлениям для купирования болевого синдрома следует применять полиферментные препараты в сочетании с антисекреторными средствами как для защиты ферментов от разрушения под действием желудочного сока, так и для создания физиологического «покоя» ПЖ.
При проведении занятий школы на основании приведенных данных необходимо указать, что купирование боли у больных ХП остается сложной задачей, требует комплексного подхода. В раде случаев целесообразными являются консультации психоневролога для коррекции пограничных расстройств, закономерно развивающиеся у пациентов с длительно существующим болевым абдоминальным синдромом.
II. Консервативная терапия отечной формы ХП.
Больные с отечным (интерстициальным) панкреатитом должны лечиться в хирургическом отделении, однако в клинической практике бывает трудно выявить отечные изменения ПЖ, особенно при отсутствии панкреатической гиперферментемии и больные нередко оказываются в терапевтических и гастроэнтерологических отделениях стационаров. В целом, консервативная терапия отечно-интерстициальной формы ХП (можно рассматривать как эквивалент обострения ХП) должна обеспечивать решение следующих основополагающих задачах:
1.Создание функционального покоя ПЖ и блокирование экзокринной функции ПЖ с последующей постепенной подготовкой органа к функциональным нагрузкам;
2.Купирование болевого статуса и предотвращение прогрессирования отечноинтерстициальной стадии панкреатита во избежание развития деструктивного панкреатита и хирургических осложнений;
3.Дезинтоксикационная терапия;
4.Коррекция катаболических процессов;
5.Профилактика инфекционных осложнений
6.Коррекция эндокринной недостаточности ПЖ.
Поскольку решение вышеуказанных задач – удел врачей стационаров, а их подробное описание дано во всех руководствах по хирургии и неотложной терапии, мы позволили себе не останавливаться на данном разделе подробно.
III. Заместительная полиферментная терапия.
Показаниями для проведения заместительной ферментной терапии при ХП с внешнесекреторной недостаточностью являются:
-стеаторея при условии потери с калом более 15 г жира в сутки;
-прогрессирующая трофологическая недостаточность при адекватности калоража ежедневного рациона;
-стойкий диарейный синдром и диспептические жалобы.
В соответствии с указанным выше, основная цель заместительной терапии панкреатическими ферментами заключается в обеспечении достаточной активности липазы в ДПК. Известно, что воздействие соляной кислоты на панкреатические ферменты приводит к разрушению до 90% их количества, поэтому путем преодоления кислотного желудочного барьера явилось создание полиферментных препаратов в кислотоустойчивой оболочке. Если постпрандиальный рН в желудке зависит как от индивидуальных особенностей секреции, так и от количества пищи и времени ее нахождения в желудке, то интрадуоденальный рН зависит от остаточной секреции бикарбонатов ПЖ, секреции бикарбонатов тонкой кишкой, от разведения объемом, а также от количества соляной и желчных кислот. Использование кислотоустойчивых форм панкреатических ферментов ставит два существенных условия:
1.Интрагастральные значения рН не должны превышать 5, так как в этом случае ферменты будут освобождаться от энтеросолюбильной оболочки уже в желудке. В этом случае часть ферментов будет необратимо разрушена при реацидификации (у пациентов с нарушенной моторной функцией). С другой стороны внутрижелудочное высвобождение панкреатических ферментов может сдвигать баланс защиты слизистой оболочки желудка в сторону усиления факторов агрессии, провоцируя эрозивно-язвенные поражения. Этот механизм часто реализуется у пациентов с дуоденогастральным рефлюксом, являющимся самостоятельным агрессивным фактором за счет негативного влияния желчных кислот, лизолицетина и фосфолипаз на слизистую оболочку желудка.
2.Интрадуоденальные значения рН должны быть не ниже 5,5 для адекватного высвобождения ферментов в ДПК.
Важнейшими факторами, затрудняющими проведение эффективной заместительной ферментной терапии, являются: асинхронный гастродуоденальный транспорт ферментных препаратов и пищевого комка, что наблюдается при нарушениях пассажа (сахарный диабет, стеноз привратника, состояние после ваготомии и т.д.), а также при применении ферментных препаратов сравнительно большого размера.
Большинство ферментных препаратов выпускается в виде драже или таблеток в кишечно-растворимых оболочках, размер большинства таблеток или драже составляет 5 мм и более. Тем не менее, известно, что из желудка одновременно с пищей могут эвакуироваться твердые частицы, диаметр которых составляет не более 2 мм при оптимальном размере 1,4 мм. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в
межпищеварительный период, когда пищевой химус отсутствует в ДПК. В результате препараты не смешиваются с пищей и недостаточно активно участвуют в процессах пищеварения. В то же время, если таблетка или драже длительное время находятся в желудке, энтеросолюбильная оболочка разрушается, а находящиеся внутри ферменты инактивируются.
Одним из вариантов возможного решения этой задачи явилось появление на фармакологическом рынке препаратов, содержащих кислотоустойчивые ферменты растительного и грибкового происхождения, не нуждающихся в кислотозащитной оболочке. Однако, эффективность применения кислотоустойчивый липазы грибкового происхождения значительно уступает препаратам панкреатина, в экспериментах на собаках бактериальная липаза оказалась в 75 раз менее эффективной, чем свиная.
Поскольку максимальное физиологическое постпрандиальное поступление панкреатической липазы составляет приблизительно 140000 ЕД/час в течение 4 часов после еды, то для эффективной терапии необходимо подбирать адекватные дозы ферментного препарата. Поскольку в настоящее время имеется большое количество различных полиферментных препаратов, содержание липазы в которых достаточно сильно варьирует (в пределах 0-25000), для коррекции стеатореи необходимо использовать только препараты с высоким содержанием липазы. Однако на практике наиболее часто применяемыми оказываются коммерчески доступные препараты с содержанием липазы в одной таблетке (драже) в пределах 3500-6000 ЕД. Соответственно, минимально эффективной разовой дозой для коррекции стеатореи будет прием по крайней мере 5-8 драже или таблеток. Однако, данные относительные расчеты, несмотря на свою показательность, не учитывают того факта, что большая часть применяемой липазы может быть инактивирована либо не активирована у больных с преимущественно вторичным механизмом панкреатической недостаточности. В этом случае следует говорить не о 5-8, а скорее - о 20-30 таблетках на прием пищи, что невозможно по психологическим причинам. Таким образом, становится понятно, почему традиционно используемое меньшее количество экзогенно принимаемых ферментов уменьшает стеаторею, но не ликвидирует ее.
При проведении занятий школы на основании приведенных данных необходимо указать, что применение энтеросолюбильных таблетированных полиферментных препаратов панкреатина, особенно в традиционных дозах, и ферментных препаратов растительного происхождения для лечения экзокринной недостаточности ПЖ практически бесполезно.
К настоящему моменту исследована роль протеолитических ферментов в инактивации липазы, однако клиническое значение этого механизма до сих пор не доказано. В экспериментах in vitro было показано, что быстрая инактивация липазы различными панкреатическими препаратами обратно коррелировала с активацией трипсина, а блокирование эффектов трипсина его ингибитором значительно увеличивало время функционирования липазы. Предположительно протеолитическая инактивация липазы может быть предотвращена при увеличении соотношения липаза/трипсин относительно физиологического уровня и улучшением смешивания панкреатина с белком, содержащимся в пище, связывающим трипсин, как в качестве субстрата, так и за счет природных ингибиторов трипсина, в обилии содержащихся в пище, особенно растительной. У пациентов с алкогольным ХП, соотношение активности протеаз к липазе в дуоденальном соке высокое ввиду значительного превалирования трипсина и химотрипсина в панкреатическом секрете. Протеолитическая инактивация липазы
