
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (39)
.pdf
6, 2006 |
Национальная школа гастроэнтерологов, гепатологов |
|
|
УДК 616.-008.939.22-07
Гастроэнтерологические аспекты обмена холестерина: гепатоцитарные и каналикулярные компартменты обмена холестерина и их клиникопатофизиологическое значение
Ю.Х. Мараховский1, К.Ю. Мараховский2
(1Кафедра гастроэнтерологии и нутрициологии, Белорусская медицинская академия последипломного образования, 2Республиканский научно-практический центр «Мать и дитя», Минск, Республика Беларусь)
Систематизированы данные по метаболизации холестерина с акцентом на печень как основной орган, обеспечивающий поддержание холестеринового гомеостаза в организме человека. Рассмотрены вопросы поглощения холестерина гепатоцитом из циркулирующего в крови пула (фонда), образование и катаболизм холестерина в гепатоците и механизмы его каналикулярной экскреции. Представлены достижения в области регуляции обмена холестерина в гепатоците при участии нуклеарных рецепторов. Определены клинические эквиваленты расстройств обмена холестерина в печени и предполагаемые перспективы воздействия на различные звенья печеночного обмена.
Ключевые слова: гепатоцит, холестерин, холаты, липопротеины, нуклеарные рецепторы.
Введение |
|
|
[56]. Оценка пищевого поступ- |
растительных стеролов – 2–5% |
|||||||||
|
|
|
ления |
растительных |
стеролов |
[6, 55, 67]. |
|
|
|
||||
организме человека и жи- |
была |
проведена в |
нескольких |
Значительно |
большая |
вели- |
|||||||
вотных |
имеется несколь |
исследованиях: средняя величи- |
чина холестерина по сравне- |
||||||||||
Вко источников, формиру- |
на составила 160–400 мг/сут [3, |
нию с пищевой синтезируется в |
|||||||||||
ющих общий фонд холестерина. |
10, 17, 29, 54, 59]. Определение |
организме de novo – от 0,8 до |
|||||||||||
Во-первых, это всасывание в |
абсорбции |
холестерина |
путем |
1,0 г/сут [2]. Практически все |
|||||||||
кишечнике из продуктов пита- |
введения |
в продукты |
питания |
клетки способны синтезировать |
|||||||||
ния. Во-вторых, собственный |
меченого |
холестерина |
показа- |
холестерин, но наиболее важ- |
|||||||||
биосинтез из |
|
активированной |
ло, что равновесное состояние |
ным для поддержания его рав- |
|||||||||
формы уксусной кислоты – аце- |
наступает при его содержании в |
новесия в организме |
является |
||||||||||
тил-КоА. |
|
|
пище в количестве 500 мг, при |
синтез в печени. Считается, что |
|||||||||
Ежедневное |
поступление |
этом абсорбируется 300 мг. При |
на долю холестерина, синтези- |
||||||||||
холестерина с пищей может коле |
высоком |
содержании |
в |
пище |
руемого в печени, приходится |
||||||||
баться от 0 до 1,2 г, у жите- |
(1,5–2,0 г) величина абсорби- |
до 80% его синтеза de novo. |
|||||||||||
лей европейских стран среднего |
руемого холестерина достигает |
Используя методологию изо- |
|||||||||||
возраста оно |
составляет около |
1,0 г. Эти данные доказывают |
топной кинетики с моделирова- |
||||||||||
0,5 г [57]. Следует отметить, что |
наличие нутритивного порога у |
нием по двух- и многокомпонент |
|||||||||||
наряду с холестерином (холесте- |
холестерина пищи, составляю- |
ным |
моделям |
распределения |
|||||||||
ролом) с пищей в полость кишки |
щего 50–60% [1]. В более позд |
холестерина, было |
показано |
||||||||||
попадает значительное количес- |
них исследованиях было обна- |
следующее [1]. |
|
|
|
||||||||
тво растительных стеролов (сте- |
ружено, что нутритивный порог |
1. Кинетика |
распределе- |
||||||||||
ринов), наиболее часто ситосте- |
(биодоступность) |
холестерина |
ния |
холестерина в |
организме |
||||||||
рол, кампестерол и стигмастерол |
пищи составляет в среднем 60%, |
отличается длительным |
пери- |
||||||||||
41

Национальная школа гастроэнтерологов, гепатологов |
6, 2006 |
одом, достигающим нескольких недель, при этом одной из наиболее быстрых характеристик является кинетика обмена между плазмой крови и печенью, составляющая 3 ч.
2.У человека общая масса холестерина, обменивающаяся с холестерином тканей в течение 10 нед, составляет около 65 г, примерно 1 г на 1 кг массы тела.
3.Отмечена конкуренция во взаимоотношениях между про-
цессами поступления с пищей и образования холестерина в организме.
Таким образом, становится очевидным существенное значение именно печени в метаболизме холестерина.
Общие принципы функционирования транспортных форм в гепатоците
Учитывая низкую растворимость в воде и перемещение холестерина в организме серией транспортных форм, обсуждение вопроса о его обмене в печени логично начать с оценки общих принципов построения транспортных устройств в данном органе.
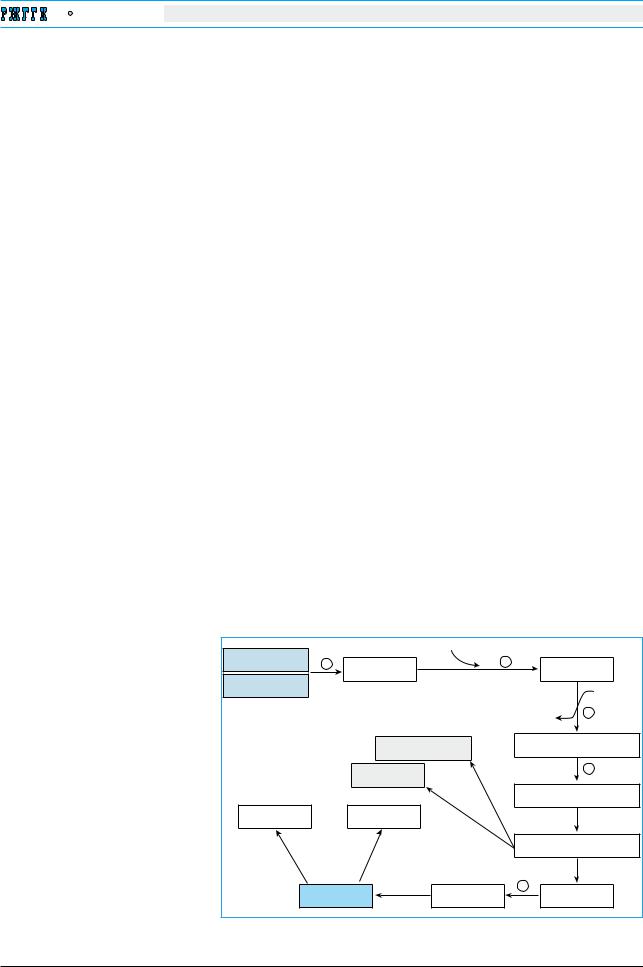
Обеспечение базолатерального мембранного транспорта (рис. 1) осуществляется прежде всего натриевым насосом – Na+/ K+-ATФазой, которая создает энергию для поддержания градиента ионов через базолатеральную мембрану. Она удаляет три иона натрия на каждые два иона калия, которые перемещаются в клетку и приводят к избытку натрия снаружи клетки
икалия внутри. Этот градиент концентрации производит отрицательный внутриклеточный потенциал приблизительно в 35 мВ. Такие химические градиенты и электрические потенциалы поддерживают внутриклеточный гомеостаз ионов, pН
иобъем. При этом протон (H+) вытесняется через Na+/H+-ионо- обменник, и бикарбонат (HCO3-)
Таурохолаты |
HCO3 |
НТП |
|
Холаты |
Cl/HCO3 ионо |
НЭЖК |
обменник |
|
|
Фосфолипиды |
Сl – |
НЭФЛ |
|
Холестерин |
|
Белки ABCG5/G8 |
|
БМР |
|
БМЛУ |
Канал Сl – |
|
ТОА |
Рис. 1. Схема общих принципов транспорта веществ в гепатоците НТП – натрий-таурохолатный переносчик; НЭЖК – насос экспорта
желчных кислот; НЭФЛ – насос экспорта фосфолипидов; БМР – белок множественной резистентности к лекарственным препаратам; БМЛУ – белок множественной лекарственной устойчивости; ТОА – транспортеры органических анионов
продвигается через Na+/HCO3- симпорт. Ионообменник выгоняет один ион наружу взамен на вход внутрь другого, симпорт обеспечивает однонаправленное движение обоих ионов; в данном случае натрий (Na+) и бикарбонат (HCO3-) совместно входят в клетку.
Натрий-таурохолатный переносчик является симпортом, который ответственен за одновременное поступление в гепатоцит натрия и желчных кислот, преимущественно их тауропроизводных (таурохолатов).
Система натрийнезависимых транспортеров обеспечивает поступление неконъюгированных холатов наряду с большим числом различных органических ионов – гормонов, медиаторов воспаления, ксенобиотиков. Это семейство транспортеров известно как транспортеры органических анионов, обычно обменивающие их (анионы) на такие органические ионы, как глютатион. Внутриклеточный транспорт вовлекает диффузию холатов через гепатоцит к каналикулярной мембране с участием одного или нескольких белков.
Каналикулярная секреция желчи является лимитирующим этапом ее формирования. За этот процесс ответственны две транспортные системы. Главная
из них состоит из «экспортных» насосов, которые нуждаются в энергии, что и обеспечивается гидролизом ATФ. Это ATФзависимые транспортные белки, которые являются компонентами ATФ-зависимых кассетных (ABC) транспортных белков. Другая транспортная система обеспечивается ATФ-независи- мыми электрогенными транспортерами, ассоциированными с изменением мембранного потенциала и локализованными в субканаликулярной микросомальной части.
Для каждого из главных элементов желчи идентифицированы транспортеры, расположенные в каналикулярной мембране.
1.Насос экспорта желчных кислот (BSEP) ответственен за секрецию холатов в канальцы (каналикулы). Мутация этого транспортера, приводящая к заметному уменьшению секреции холатов, отмечена при наследственной форме внутрипеченочного холестаза – прогрессирующий семейный внутрипеченочный холестаз (PFIC-2) с низким уровнем γ-глутамилтранспепти- дазы (γ-ГТП).
2.Насос экспорта фосфолипидов (МDR3) функционирует как флипаза. Используя особенности расположения в мембране, этот транспортер порционно
42
|
|
|
|
|
|
6, |
2006 |
|
|
|
|
Национальная школа гастроэнтерологов, гепатологов |
|||||||||||||||||
(щелчками) перемещает фосфо- |
Белок MRP2, |
расположенный |
си-3-метилглютарил-коэнзима А |
||||||||||||||||||||||||||
липиды (лецитин) от внутрен- |
в |
каналикулярной |
мембране, |
редуктазы. |
|
|
|
|
|
||||||||||||||||||||
него к внешнему слою канали- |
является |
экспортным |
насосом |
|
Биосинтез холестерина вклю |
||||||||||||||||||||||||
кулярной мембраны. При этом |
для конъюгированных |
органи- |
чает |
пять |
основных |
этапов |
|||||||||||||||||||||||
на |
|
завершающем |
этапе |
соли |
ческих ионов, главным образом |
(рис. 2). |
|
|
|
|
|
||||||||||||||||||
желчных |
кислот |
заканчивают |
конъюгированных |
с |
глутатио- |
|
1. Ацетил-КоА конвертиру- |
||||||||||||||||||||||
извлечение лецитина в канали- |
ном (например, билирубин, эст- |
ется в 3-гидрокси-3-метилглюта- |
|||||||||||||||||||||||||||
кулярную мембрану. В пределах |
роген, лейкотриены) и сульфа- |
рил-КоА (ГМГ-КоА или ОМГ- |
|||||||||||||||||||||||||||
полости |
каналикулы |
лецитин |
том. MRP2 функционирует как |
КоА). |
|
|
|
|
|
||||||||||||||||||||
формирует |
|
моноламеллярные |
множественный |
транспортер |
|
2. ОМГ-КоА превращается в |
|||||||||||||||||||||||
пузырьки с холестерином и сме- |
органических |
ионов. |
|
Мутация |
мевалонат. |
|
|
|
|
|
|||||||||||||||||||
шанные мицеллы с солями жел- |
гена этого транспортера при- |
|
3. Мевалонат трансформиру- |
||||||||||||||||||||||||||
чных |
кислот |
и холестерином. |
водит к расстройствам выде- |
ется в изопрен, в частности в |
|||||||||||||||||||||||||
Мутации |
гена, |
|
ответственного |
ления конъюгатов |
билирубина |
изопентенил |
пирофосфат с по- |
||||||||||||||||||||||
за |
|
транспортер |
фосфолипидов |
(синдром Дабина–Джонсона). |
терей CO2. |
|
|
|
|
|
|||||||||||||||||||
(МDR3), могут быть причи- |
Каналикулярная мембрана гепа- |
|
4. |
Изопентенил пирофосфат |
|||||||||||||||||||||||||
ной |
другой |
формы семейного |
тоцита содержит также транс- |
конвертируется в сквален. |
|
||||||||||||||||||||||||
холестаза |
с высоким |
уровнем |
портеры, которые не нуждаются |
|
5. Сквален |
полностью пре- |
|||||||||||||||||||||||
γ-ГТП (PFIC-3). Гетерогенные |
в АТФ – ATФ-независимые |
вращается в холестерин. |
|
||||||||||||||||||||||||||
дефекты этого вида транспорте- |
транспортеры, например ионо- |
|
Следует |
обратить |
внимание |
||||||||||||||||||||||||
ров приводят к холестазу бере- |
обменник |
|
хлора/бикарбоната |
на участие в синтезе холестери- |
|||||||||||||||||||||||||
менных |
и |
|
являются |
наиболее |
(белок AE2), который выделяет |
на долихола и его производных |
|||||||||||||||||||||||
подозрительными |
в отношении |
бикарбонат |
и |
усиливает поток |
фармезила и геранила. Реакции |
||||||||||||||||||||||||
формирования |
|
холестериновых |
желчи. |
|
|
|
|
|
|
фосфорилирования |
являются |
||||||||||||||||||
желчных камней. |
|
|
|
|
|
|
|
|
|
|
|
|
необходимым |
компонентом |
в |
||||||||||||||
|
3. Белокмножественнойрези |
|
Гепатоцитарные |
синтезе холестерина и приводят |
|||||||||||||||||||||||||
стентности |
|
к |
|
лекарственным |
|
к |
повышению |
растворимости |
|||||||||||||||||||||
|
|
|
компартменты |
|
|
||||||||||||||||||||||||
препаратам |
|
(MDR1) |
является |
|
|
|
изопреноидных промежуточных |
||||||||||||||||||||||
|
|
(отделы) обмена |
|
||||||||||||||||||||||||||
транспортером |
|
липофильных |
|
холестерина |
|
|
|
компонентов. Далее необходимо |
|||||||||||||||||||||
катионов, включая лекарствен- |
|
|
|
|
|
|
|
|
участие долихола в синтезе пре- |
||||||||||||||||||||
ные препараты. Этот транспор- |
|
Синтез холестерина |
ниловых производных. |
Печень |
|||||||||||||||||||||||||
тер |
защищает |
печень |
от |
экзо- |
|
– |
основной |
источник |
долихо- |
||||||||||||||||||||
|
в гепатоците |
|
|
|
|||||||||||||||||||||||||
и |
эндотоксинов, |
выделяя |
их |
|
|
|
|
ла в крови и его выделение |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
в желчь. |
|
|
|
|
|
|
|
|
|
|
В гепатоците осуществляет- |
обеспечивается |
через |
|
билиар- |
||||||||||||||
|
4. Белки ABCG5 и ABCG8, |
ся синтез собственного холес- |
ную экскрецию, что объединяет |
||||||||||||||||||||||||||
по-видимому, вместе действу- |
терина. Основным лимитирую- |
долихол и холестерин. Более |
|||||||||||||||||||||||||||
ют как функциональный насос |
щим моментом синтеза является |
того, обнаружена положитель- |
|||||||||||||||||||||||||||
стеролов, экспортируя холес- |
активность |
фермента |
3-гидрок- |
ная |
корреляция между уров- |
||||||||||||||||||||||||
терин |
и |
растительные |
стерины |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
(ситостерин). Эти транспортеры |
|
Ацетил KoA |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
порционно продвигают холесте- |
|
|
1 |
|
ГМГ КоА |
|
|
2 |
|
Мевалонат |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
рин |
от внутреннего к |
внешне- |
|
|
|
|
|
|
|
ГМГ КоА |
|
|
|||||||||||||||||
Ацетоацетил KoA |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
му слою мембраны гепатоцита. |
|
|
|
|
|
редуктаза |
|
|
|
АТФ |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Экспрессия |
|
генов |
транспорте- |
|
|
|
|
|
|
|
|
|
|
|
СО2 |
3 |
|
|
|||||||||||
ров ABCG5/G8 сопровождается |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
усилением потока холестерина и |
|
|
|
|
|
|
|
Пренилированные |
Изопентенил пирофосфат |
||||||||||||||||||||
растительных стеринов в желчь |
|
|
|
|
|
|
|
белки |
|
|
|
|
|
|
|
|
|||||||||||||
и формированием желчных кам- |
|
|
|
|
|
|
|
Убхинон |
|
|
|
|
|
4 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
ней. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Геранил пирофосфат |
|
||||||
|
5. Белки |
|
|
множественной |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
Желчные |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
лекарственной |
|
устойчивости |
|
|
|
|
Стероиды |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
(MRP) – подгруппа АВС – |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
состоят из шести компонентов. |
|
Печень |
|
|
|
|
|
Эндокринные |
|
|
|
Фарнезил пирофосфат |
|
||||||||||||||||
Эти транспортеры ATФ-зависи- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
железы |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
мы; |
локализация |
на |
базолате- |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
||||||||||
ральной мембране обеспечивает |
|
|
|
Холестерин |
|
Ланостерил |
Сквален |
|
|||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||
выделение органических ионов в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
системную циркуляцию, на кана- |
Рис. 2. Схема лимитирующего этапа синтеза холестерина (по King M.W., |
||||||||||||||||||||||||||||
ликулярной мембране – в желчь. |
|||||||||||||||||||||||||||||
1996) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
43

Национальная школа гастроэнтерологов, гепатологов |
6, 2006 |
нем долихола и содержанием в крови липопротеинов высокой плотности (ЛПВП) [31].
У некоторых видов животных активность ОМГ-КоА в пе чени находится под обратным воздействием продукта реакции. Поэтому при накоплении холестерина активность ОМГ-КоА в печени снижается и уменьшается синтез самого холестерина. У человека не удается точно доказать наличие такого механизма обратной связи. Однако синтез холестерина в клетках кишечника (второго основного источника холестерина крови) регулируется через тот же ключевой фермент ОМГ-КоА, но не холестерином, а желчными кислотами. Активность ОМГКоА в гепатоците находится под воздействием цАМФ-зависимой протеинкиназы. Через этот путь осуществляется воздействие на ОМГ-КоА различных эндогенных молекул, например инсулина и эпинефрина. В целях долгосрочного контроля ОМГ-КоА
изучаются изменения |
синтеза |
(транскрипционный |
уровень) |
и протеолитической |
деграда- |
ции фермента. Так, установлено, что при повышении уровня синтеза выраженность экспрессии гена ОМГ-КоА уменьшается. Разрушение ОМГ-КоА обеспечивается протеолитическим путем. При этом увеличение потока синтеза холестерина сопровождается усиленной деградацией ОМГ-КоА: когда поток уменьшается, уменьшается и деактивация самого фермента. Это явление легко определяется на фоне использования статинов (ингибиторов ОМГ-КоА). Протеолитическая деградация фермента осуществляется в протеосомах.
AMФ (аденозинмонофосфат)
– активируемая (индуцируемая) протеинкиназа (AMФK) была вначале описана как ингибитор ацетил-КоА карбоксилазы (AцК) и 3-гидрокси-3-метилглю- тарил-КоА редуктазы (редуктаза ГМГ-КоА). AMФK вызывает каскад реакций в клетке в ответ
на изменения в энергетическом потреблении. Роль AMФK в регулировании клеточного уровня энергии помещает этот фермент в центр энергетического гомеостаза клетки. Было показано, что активность AMФK может также регулироваться физиологическими стимулами (включая гормоны и пищевые вещества), независимыми от энергетических компонентов клетки.
После активирования AMФK индуцирует фосфорилирование, переключая клетку от активного потребления ATФ (например, синтез жирных кислот или холестерина) к активному производству ATФ (например, из жирных кислот или глюкозы). Это краткосрочные процессы, связанные с АМФК. Активация последней проявляет также долгосрочные эффекты на уровне и генной экспрессии, и синтеза белка. Еще одно важное дей ствие, относящееся к AMФK,
– регулирование синтеза и секреции инсулина в панкреатических β-клетках и модуляция гипоталамических функций, вовлеченных в регулирование насыщения. AMФK оказывает воздействие на экспрессию многих генов, ответственных за гликолиз и липолиз в печени. Включены в этот список генов в печени изоформы пируваткиназы, синтетазы жирных кислот. Активация AMФK приводит к снижению уровня СРЭСБ (стеролрегулируемый элемент связывающего белка) – фактора транскрипции, являющегося ключевым регулятором многочисленных липолитических ферментов. Другой фактор транскрипции, который уменьшается в ответ на активацию AMФK,
– ядерный фактор гепатоци тов 4α (ЯФГ4α). ЯФГ4α, являющийся членом гормонального стероид/тиреоидного суперсемейства, регулирует экспрессию нескольких генов типа GLUT2, L-PK. Клиническим эквивалентом важности этого нуклеарного фактора является указание
на наличие его мутации при ювенильной форме сахарного диабета. Недавние данные свидетельствуют о том, что обнаруженный белок – элемент-свя- зывающий белок ответа на углеводы (ЭСБУ) является целью для AMФK в печени. С другой стороны, именно ЭСБУ вовлечен в транскрипционное регулирование L-PK.
Использование изотопных аналогов ацетата совместно
смевалонатом и последующим определением сквалена показало, что уже через 2 ч происходит максимальное накопление последнего. При оценке синтеза холестерина изотопно-кинети- ческими методами с множественными метками предшественников холестерина выявлена существенная вариабельность его синтеза у человека – от 7 до 21 мг/кг/сут. Результаты сравнения кинетики холестерина на основе изотопно-кинетического исследования позволили установить. что скорость и интенсивность его поступления в печень у группы пациентов с гиперхолестеринемией по сравнению
сгруппой без гиперхолестерин емии были повышены [1].
Захват гепатоцитом холестерина крови
Помимо синтеза холестерин попадает в гепатоцит из крови (рис. 3). Как синтезированный, так и захваченный из крови
холестерин имеет |
в |
гепатоците |
четыре варианта |
метаболизма: |
|
эстерифицируется |
и |
хранится |
в гепатоците, упаковывается в частицы ЛПОНП (липопротеины очень низкой плотности) и секретируется в кровь, секретируется непосредственно в желчь и конвертируется в холаты,
которые |
затем |
секретируются |
в желчь. |
|
|
Холестерин пищи и тригли- |
||
цериды |
упаковываются аполи- |
|
попротеинами в |
энтероците и |
|
секретируются в лимфатические капилляры в виде хиломикронов (ХМ). В процессе цирку-
44

6, 2006 |
Национальная школа гастроэнтерологов, гепатологов |
|
|
Стеролы пищи
|
|
|
|
Клетка перифе |
|
|
|
|
|
ABСG5 |
рических тканей |
Рецептор ЛПНП |
|
|
|
|
|
|
||
|
|
Стеролы ABCG8 |
|
|
||
|
|
|
|
|
||
Стеролы |
желчи |
|
|
|
|
|
|
|
Холестерин |
|
|
||
|
|
|
|
|
ЛПНП |
|
|
|
|
|
|
|
|
|
|
|
ХМо |
ЛПОНП |
|
ЛПОНПо |
|
|
|
|
о |
||
|
|
|
|
|
|
|
Стеролы |
|
|
АроВ |
|
ЛПНП |
|
|
|
|
|
|||
|
|
|
СЖК |
|
|
|
|
|
ХМ |
|
|
|
|
|
|
|
|
|
ЛПОНП |
|
|
|
|
|
ЛПОНП |
|
|
|
|
АроЕ |
|
|
|
|
Жир
Мышечная СЖК ткань
Тонкая кишка
Рис. 3. Схема захвата холестерина крови гепатоцитом (по Rader D.J. и соавт. [68])
ляции хиломикронов в их ядре триглицериды гидролизуются липопротеинлипазой и формируются остаточные хиломикроны (ХМо). Именно эти частицы захватываются печенью.
Частицы ЛПОНП выделяются в кровь в виде ремнатных (остаточных) форм. Около 50% остаточных форм ЛПОНП вновь захватываются специальными рецепторами в печени, остальная часть превращается в зрелые (полные формы) ЛПНП (липопротеины низкой плотности), которые и являются основными формами транспорта холестерина в крови. Примерно 70% циркулирующих в крови ЛПНП захватываются рецепторами ЛПНП в печени.
Расположенные в гепатоците транспортеры семейства G-про- теинов ABCG5 и ABCG8 участвуют в поступлении стеролов
вжелчь. Мутации этих транспортеров сопровождаются усиленным поступлением стеролов
впечень (они локализованы также на энтероците) и увеличением их поступления в желчь.
Непрерывное изменение внутриклеточного содержания стеролов происходит как через регулирование ключевого фермента синтеза, так и через уровень захвата носителей холестерина гепатоцитом – рецепторы ЛПНП. Активация транскрипционного контроля происходит через мембраносвязанный ключевой транскрипционный фактор СРЭСБ.
Контроль транскрипции синтеза стеролов затрагивает более 30 генов, вовлеченных в биосинтез холестерина, триацилглицеринов, фосфолипидов и жирных кислот. Транскрипционный контроль нуждается в присутствии октамерной последовательности в гене, названном сте- рин-регулирующим элементом (СРЭ-1). Показано, что СРЭСБ
– фактор транскрипции, который связывает с элементами СРЭ-1. Оказывается, что есть два отличительных гена СРЭСБ: СРЭСБ-1 и СРЭСБ-2. Кроме
того, |
ген СРЭСБ-1 коди |
рует |
два белка: СРЭСБ-1a |
и СРЭСБ-1c.
Следует отметить, что свободные жирные кислоты (СЖК) окисляются в митохондриях для синтеза АТФ и, кроме того, используются при эстерификации холестерина и формировании ЛПОНП. В печени при гиперинсулинемии индуцируется экспрессия всех липогенных генов.
Гепатоцит ответственен не только за захват частиц крови, содержащих холестерин, но именно в гепатоците происходит синтез таких частиц. Характеристика основных транспортных форм холестерина крови представлена в табл. 1.
Обратный транспорт холестерина в гепатоцит включает достаточно долгий путь транспорта свободного (неэстерифи-
|
|
|
|
|
|
|
Таблица 1 |
||
Характеристика основных транспортных форм холестерина крови |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Липопротеины |
Источник |
Плотность, |
|
|
Доля, % |
|
|
|
|
г/мл |
белка |
ТГ |
ФЛ |
ХЭ |
Х |
СЖК |
|
||
|
|
|
|||||||
Хиломикроны |
Кишечник |
Менее 0,95 |
1–2 |
85–88 |
8 |
3 |
1 |
0 |
|
ЛПОНП |
Печень |
0,95–1,006 |
7–10 |
50–55 |
18–20 |
12–15 |
8–10 |
1 |
|
ЛППП |
ЛПОНП |
1,006–1,019 |
10–12 |
25–30 |
25–27 |
32–35 |
8–10 |
1 |
|
ЛПНП |
ЛПОНП |
1,019–1,063 |
20–22 |
10–15 |
20–28 |
37–48 |
8–10 |
1 |
|
ЛПВП2* |
Кишечник, печень |
|
|
|
|
|
|
|
|
|
(хиломикроны и ЛПОНП) |
1,063–1,125 |
33–35 |
5–15 |
32–43 |
20–30 |
5–10 |
0 |
|
ЛПВП3* |
Кишечник, печень |
|
|
|
|
|
|
|
|
|
(хиломикроны и ЛПОНП) |
1,125–1,21 |
55–57 |
3–13 |
26–46 |
15–30 |
2–6 |
6 |
|
Альбумин – СЖК |
Жировая ткань |
Более 1,281 |
99 |
0 |
0 |
0 |
0 |
100 |
|
|
|
|
|
|
|
|
|
|
|
Примечание: ТГ – тиреоидный гормон, ФЛ – фосфолипиды, ХЭ – холестерина эфиры, Х – холестерин, * ЛПВП2 и ЛПВП3 – производные от насцентных ЛПВП как результат включения эфиров холестерина.
45

Национальная школа гастроэнтерологов, гепатологов |
|
6, |
2006 |
||||
Периферические |
|
Печень |
|
Кишечник |
|
||
клетки |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Пища |
Желчь |
|
Фиброцит |
ГМГ КоА редуктаза |
|
|
|
|
||
|
|
|
|
|
|
||
ABC A1 |
|
|
Синтез |
Холестерин |
|
|
|
|
|
|
|
|
|
||
ЛПВП |
ЛХАТ |
SR B1 |
АСАТ |
7αгидроксилаза |
Абсорбция |
|
|
|
|
|
|||||
ТГ |
ХЭ |
рецептор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХЭ |
|
|
|
|
БПХ |
|
МТР |
|
|
|
|
|
|
|
АроВ |
|
|
|
|
|
|
|
|
Желчные кислоты |
|
|
|
|
|
ХЭ |
|
|
|
|
|
|
ЛПОНП |
|
ТГ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реабсорбция |
|
|
ЛПНП |
|
Рецептор |
Желчь |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
ЛПНП |
|
|
|
|
|
Плазма |
|
|
Кишка |
|
|
Кал |
|
|
|
|
|
|
|
||
Рис. 4. Схема преобразований холестерина липопротеинов при участии гепатоцита (по Gilbert R. Thompson [24]) |
|||||||
цированного) холестерина от периферических клеток, включая макрофаги в эндотелии сосудов (рис. 4), до ЛПВП и захвата в гепатоците. Образование липопротеинов относится к одной из важнейших составляющих синтетической функции печени. Нарушения биосинтеза белковых компонентов липопротеинов – апопротеинов сопровождается целым спектром расстройств обмена липидов в организме человека. Этот захват связан с ATФзависимым транспортером кассетных белков ABC (ABC A1). Затем может происходить эстерификация холестерина через фермент лецитин/холестерин ацил-трансферазу (ЛХАТ). Белок переносчик холестерина (БПХ) обеспечивает передачу
эстерифицированного |
холес- |
|||
терина от |
ЛПВП к |
ЛПОНП |
||
и ЛПНП |
для |
последующе- |
||
го |
захвата |
рецептором ЛПНП |
||
и |
триглицеридов |
в обратном |
||
направлении в плазму крови. Нехватка БПХ вызывает накопление эстерифицированного холестерина в ЛПВП и таким образом увеличивает концент-
рацию холестерина ЛПВП в плазме.
Клиническое значение описанного захвата холестерина гепатоцитом имеет прямое отношение к регулированию соотношения атерогенных (ЛПОНП и ЛПНП) и антиатерогенных (ЛПВП) липопротеинов.
Обширные популяционные исследования в разных странах показали, что повышенная концентрация ЛПВП ассоциирована с уменьшением риска коронарной патологии и прогрессирования атеросклероза и его осложнений [74, 75].
В контексте обсуждаемого значения печени в обмене холестерина яркой демонстрацией является одна из работ известных специалистов по атеросклерозу [27]. В ней приводится формула атеросклероза: накопление липопротеинов в сосудистой стенке = поступление липопротеинов – выход в кровь
(lipoprotein in – lipoprotein out. L-A avw = L-in – L- out). В пояснении указывается, что накопление липопротеинов (L-in) равняется сумме липо протеинов из желудочно-кишеч-
ного тракта и синтезируемого в печени; выход липопротеинов строго связан с захватом холестерина печенью и выбросом его с желчью. Тем самым подчеркивается, что проблема атеросклероза прежде всего связана с органами пищеварения, а сосудистая патология является лишь следствием. При этом низкий уровень ЛПВП в крови рассматривается как независимый и существенный фактор риска повышения смертности при сердечно-сосудистых заболеваниях (ССЗ) [27]. Особое значение этот фактор имеет для мужчин. Установлено, что концентрация ЛПВП в крови ниже 0,9 ммоль/л (36 мг/мл) значительно увеличивает риск смерти
умужчин от ССЗ [25]. Высказывается точка зрения
о том, что данный феномен (высокая концентрация ЛПВП) является в целом благоприятным фактором, положительно влияющим на уменьшение общей смертности и/или заболеваемости [75]. Однако существуют исследования, противоречащие такой положительной оценке повышенной концентрации
46

6, 2006 |
Национальная школа гастроэнтерологов, гепатологов |
|
|
Таблица 2
Общая характеристика апопротеинов (по Kingsbury K.J. и соавт. [39])
Апопротеин, мол. вес (Da) |
Основной липопротеин |
Основная функция |
|
|
|
ApoA-I, 29 016 |
Хиломикроны, ЛПВП |
Основной белок ЛПВП, активирует ЛХАТ |
ApoA-II, 17 400 |
Хиломикроны, ЛПВП |
Преимущественно в ЛПВП, усиливает |
|
|
активность печеночной липазы |
ApoA-IV, 46 000 |
Хиломикроны и ЛПВП |
Присутствует в липопротеинах, богатых |
|
|
триглицеридами |
ApoB-48, 241 000 |
Хиломикроны |
Исключительно в хиломикронах, производ- |
|
|
ный от ApoB-100 гена в энтероците; рецеп- |
|
|
торный домен для рецептора ApoB-100 |
ApoB-100, 513 000 |
ЛПОНП, ЛППП и ЛПНП |
Основной белок ЛПНП, связывается |
|
|
с ЛПНП рецептором |
ApoC-I, 7600 |
Хиломикроны, ЛПОНП, |
Может активировать ЛХАТ |
|
ЛППП и ЛПВП |
|
ApoC-II, 8916 |
Хиломикроны, ЛПОНП, |
Активатор липопротеин липазы |
|
ЛППП и ЛПВП |
|
ApoC-III, 8750 |
Хиломикроны, ЛПОНП, |
Ингибитор липопротеин липазы |
|
ЛППП и ЛПВП |
|
ApoD, 33 000 |
ЛПВП |
Тесно взаимодействует с ЛХАТ |
Транспортный белок эфиров |
ЛПВП |
Исключительно с ЛПВП, переносит эфиры |
холестерина, CETP |
|
холестерина |
ApoE, 34 000 (не менее 3 ал- |
Хиломикроны остаточные, |
Связывается с ЛПНП рецептором, |
лелей [E2, E3, E4], каждый |
ЛПОНП, ЛППП и ЛПВП |
аллель ApoE4 ассоциирован с болезнью |
имеет множество изоформ) |
|
Альцгеймера |
ApoH, 50 000 (известен как |
Хиломикроны |
Метаболизм триацилглицеридов |
b-2-гликопротеин I) |
|
|
Apo (a) – не менее 19 разных |
ЛПНП |
Диффузно связывается с ApoB-100, фор- |
аллелей; белок с варьировани- |
|
мирует комплексы с ЛПНП и иденти- |
ем размеров 300 000–800 000 |
|
фицирован как липопротеин (a), Lp (a); |
|
|
избирательно активирует плазминоген, |
|
|
может поставлять холестерин в сосудистую |
|
|
стенку, имеет высокий ассоциативный риск |
|
|
с инфарктами и инсультами |
|
|
|
ЛПВП в крови [66]. Это доста- |
(ацил-коэнзим А-холестерол |
С другой стороны, описана гене- |
||||||||||
точно убедительно подтвержде- |
ацил-трасфераза – АСАТ) и |
тическая мутация IBAT у людей, |
||||||||||
но в одной из последних публи- |
совместно с фосфолипидами и |
при этом у таких пациентов отме- |
||||||||||
каций на эту тему [73]. В ней |
аполипопротеином В-48 фор- |
чено снижение абсорбции хола- |
||||||||||
показано, что высокие концент- |
мируют |
хиломикроны. Однако |
тов |
в |
кишечнике в сочетании |
|||||||
рации ЛПВП сыворотки теряют |
мутация АСАТ может приво- |
с низким уровнем ЛПНП [48]. |
||||||||||
свой защитный эффект против |
дить либо к редукции, либо к |
Апопротеин A-I (ApoA-I) |
||||||||||
ишемической болезни |
сердца |
усилению абсорбции холестери- |
определяет характерные |
свой- |
||||||||
у мужчин при наличии повы- |
на. В настоящее время имеются |
ства ЛПВП, кодируется локу- |
||||||||||
шенного |
содержания |
в крови |
данные |
о редукции |
абсорбции |
сом в 11q23 [7]. ApoA-I – |
||||||
печеночных ферментов – транс |
холестерина [8]. У мышей с |
кофактор для ЛХАТ, кото- |
||||||||||
аминазы и γ-ГТП. Этот эффект |
потерей |
локуса |
по |
изоформе |
рый |
является |
ответственным |
|||||
сохранялся не только для сер- |
АСАТ-2 [9] отмечается резис- |
за |
формирование большинства |
|||||||||
дечно-сосудистой патологии в |
тентность как к развитию гипер- |
эфиров холестерина в плазме. |
||||||||||
целом, но и для общей смерт- |
холестеринемии, так и форми- |
Он является также промото- |
||||||||||
ности. Таким образом, высокие |
рованию желчных камней. |
ром потока холестерина из клет- |
||||||||||
концентрации ЛПВП не всегда |
На уровне энтероцитов опре- |
ки. |
Печень |
и |
тонкая |
кишка |
||||||
благо, особенно при сочетании |
делено |
наличие |
интестиналь- |
– |
основные |
участки синтеза |
||||||
с повреждением печени, сопро- |
ного холатсвязывающего белка |
ApoA-I. Посттранскрипционные |
||||||||||
вождающимся цитолизом. |
(I-BABP) с высоким сродством |
изменения ApoA-I приводят к |
||||||||||
Напомним, что после абсор- |
к желчным кислотам, ассоци- |
формированию |
изоформ |
белка |
||||||||
бции холестерин и |
жирные |
ированного с холатным транс- |
в плазме крови [16] с образо- |
|||||||||
кислоты |
реэстерифицируются |
портером (IBAT, или SLC10A2). |
ванием гомологов A-I, A-II, C-I |
|||||||||
47

Национальная школа гастроэнтерологов, гепатологов |
6, 2006 |
и C-III. Общая характеристи- |
выражения гепатоцита и глав- |
не идентифицированы. PPAR и |
|||||||||||||||||||||||||||||
ка апопротеинов |
представлена |
ный активатор ЯФГ1α (TCF1), |
LXR относятся ко 2-й группе. |
||||||||||||||||||||||||||||
в табл. 2. |
|
|
|
|
|
|
который, в свою очередь, опре- |
|
Семейство |
PPAR |
|
состо- |
|||||||||||||||||||
Достаточно давно [93] было |
деляет |
экспрессию |
большого |
ит из PPAR-α, PPAR-γ и |
|||||||||||||||||||||||||||
обнаружено, что ApoA-I иден- |
количества генов в гепатоците, |
PPAR-σ (также известного как |
|||||||||||||||||||||||||||||
тичен по своему действию про- |
включая гены, |
обеспечивающие |
β). К этим нуклеарным рецеп- |
||||||||||||||||||||||||||||
стациклину (PGI-2) и способен |
метаболизацию глюкозы, холес- |
торам |
был |
проявлен |
инте- |
||||||||||||||||||||||||||
функционировать как |
вазоди- |
терина и жирных кислот [41, |
рес после описания того, что |
||||||||||||||||||||||||||||
лататор и ингибитор накопле- |
46]. Еще в 1996 г. было пока- |
PPAR-α и PPAR-γ являются |
|||||||||||||||||||||||||||||
ния холестерина |
в |
сосудистой |
зано значение мутации в ЯФГ4 |
главными |
участками |
|
действия |
||||||||||||||||||||||||
стенке. Благоприятные воздей |
в |
развитии |
семейной |
формы |
лекарственных |
|
препаратов, |
||||||||||||||||||||||||
ствия ЛПВП в предотвращении |
ювенильного сахарного диабета |
используемых |
для |
|
коррек- |
||||||||||||||||||||||||||
прогрессирования |
поражения |
[92]. |
Именно |
через |
факторы |
ции обмена липидов и углево- |
|||||||||||||||||||||||||
коронарных сосудов связывают |
транскрипции |
можно |
|
логично |
дов [58]. Так, для фибратов |
||||||||||||||||||||||||||
именно с этим апопротеином. |
|
объяснить многие звенья патоге- |
мишенью оказался PPAR-α, |
||||||||||||||||||||||||||||
Описаны состояния с дефи- |
неза, общие для атеросклероза, |
для |
глитазонов |
|
– |
|
PPAR-γ. |
||||||||||||||||||||||||
цитом ЛПВП, индуцирован- |
сахарного диабета, |
алкогольной |
Серия исследований за послед- |
||||||||||||||||||||||||||||
ным |
генетическими |
|
дефектами |
и неалкогольной болезней пече- |
ние |
5 лет |
продемонстрировала |
||||||||||||||||||||||||
синтеза |
Apo-I, |
А-I |
|
(Milano), |
ни [12, 13]. |
|
|
|
|
|
|
|
дополнительные свойства PPAR |
||||||||||||||||||
А-I (Marburg), болезнь «рыбь- |
|
Ядерные(нуклеарные)рецеп- |
в |
разнообразном |
диапазоне |
||||||||||||||||||||||||||
их глаз» и классическая форма |
торы – это прежде всего фак- |
физиологических |
и |
патофизи- |
|||||||||||||||||||||||||||
– болезнь Танжье. При болезни |
торы транскрипции. Семейство |
ологических |
реакций, |
включая |
|||||||||||||||||||||||||||
Танжье |
обнаруживается мута- |
ядерных |
рецепторов |
|
состоит |
воспаление, биологию сосудис- |
|||||||||||||||||||||||||
ция в кассетных транспортерах |
из 48 факторов транскрипции, |
той стенки, атеросклероз, пла- |
|||||||||||||||||||||||||||||
АВС (АВС-I) и более часто – |
обнаруженных |
у |
млекопитаю- |
центарную физиологию, мета- |
|||||||||||||||||||||||||||
генетический дефект |
в |
синтезе |
щих. Эти рецепторы обеспечи- |
болические поражения костей и |
|||||||||||||||||||||||||||
Apo-I с низким уровнем ЛПВП |
вают |
регулирование |
огромного |
рак [12, 13, 15]. |
|
|
|
|
|
|
|||||||||||||||||||||
в крови [76]. Более того, эпи- |
числа |
метаболических |
|
реакций |
|
Особенно значимыми в кон- |
|||||||||||||||||||||||||
демиологические близнецовые и |
– от роста до воспаления [94]. |
тексте обсуждаемой темы явля- |
|||||||||||||||||||||||||||||
семейные |
исследования |
позво- |
|
Два |
подкласса |
|
пероксисо- |
ются |
публикации, |
касающиеся |
|||||||||||||||||||||
ляют предполагать, что прибли- |
мальных активаторов пролифе- |
регулирования |
холестерина и |
||||||||||||||||||||||||||||
зительно 50% расстройств в об- |
рации |
(PPAR) |
и |
печеночных |
триглицеридов семейством ядер- |
||||||||||||||||||||||||||
мене ЛПВП (ЛПВП-С) имеют |
Х рецепторов (LXR) являются |
ных рецепторов – LXR (оксис- |
|||||||||||||||||||||||||||||
генетическую природу [22, 32]. |
критическими факторами мета- |
терол активирующийся Х рецеп- |
|||||||||||||||||||||||||||||
Специфика клетки основана |
болизма липидов и глюкозы. |
тор) [94].Эти рецепторы состоят |
|||||||||||||||||||||||||||||
на отличительном генном выра- |
При этом ожирение и сахарный |
из LXR-α и LXR-β. LXR акти- |
|||||||||||||||||||||||||||||
жении |
ее |
фенотипа, |
который, |
диабет находятся в центре вни- |
вируются |
метаболитами |
холес- |
||||||||||||||||||||||||
в свою очередь, определяется, |
мания по потенциально терапев- |
терина и обеспечивают регули- |
|||||||||||||||||||||||||||||
по крайней мере частично, спе- |
тическим эффектам названными |
рование его уровня в клетке. |
|||||||||||||||||||||||||||||
цифическим набором факторов |
нуклеарными рецепторами. Эти |
LXR все чаще признают одним |
|||||||||||||||||||||||||||||
транскрипции, |
проявляющих |
указанные |
выше |
проблемы |
и |
из основных участников пато- |
|||||||||||||||||||||||||
разную |
активность |
|
в |
разные |
явились |
краеугольным |
камнем |
генеза |
атеросклероза |
|
[35, |
36]. |
|||||||||||||||||||
периоды. |
Особое |
|
значение |
обсуждений на одном из послед- |
В |
гепатоците |
главный |
эффект |
|||||||||||||||||||||||
факторы |
транскрипции |
имеют |
них международных симпозиу- |
PPAR-σ, по-видимому, связан с |
|||||||||||||||||||||||||||
в периоды |
дифференциации |
и |
мов по нуклеарным рецепторам |
участием в гликолизе, уменьше- |
|||||||||||||||||||||||||||
метаболического |
напряжения. |
(NR), |
состоявшемся |
|
в |
апреле |
нии продукции глюкозы в гепа- |
||||||||||||||||||||||||
В гепатоците как в одной из |
2005 г. в Канаде [45]. |
|
|
|
тоците |
и |
поддержании |
уровня |
|||||||||||||||||||||||
самых метаболически активных |
|
NRs |
могут |
быть |
разделены |
глюкозы крови [12, 38, 79]. |
|
||||||||||||||||||||||||
клеток |
обнаружено |
большое |
на три группы: 1-я – классичес- |
|
Исследователи из Универси |
||||||||||||||||||||||||||
число |
факторов |
транскрипции |
кие рецепторы для стероидов и |
тета |
штата Пенсильвания [68], |
||||||||||||||||||||||||||
[37]. Активация многих функ- |
гормонов щитовидной |
|
железы, |
используя |
методику |
|
оценки |
||||||||||||||||||||||||
ций гепатоцита и их реэкспрес- |
т. е. глюкокортикоидные рецеп- |
метаболизма |
холестерина |
на |
|||||||||||||||||||||||||||
сия |
напрямую |
зависимы |
от |
торы (GR), 2-я – рецепторы, |
основе |
введения |
в |
|
кровоток |
||||||||||||||||||||||
одного |
из |
основных |
факторов |
для которых были установле- |
меченных холестерином макро- |
||||||||||||||||||||||||||
транскрипции в |
гепатоците |
– |
ны |
неклассические |
|
лиганды, |
фагов, пришли к выводу, что |
||||||||||||||||||||||||
ЯФГ4 [28]. |
|
|
|
|
|
и 3-я – рецепторы «сироты» |
обратный |
транспорт |
|
холесте- |
|||||||||||||||||||||
ЯФГ4 играет ведущую роль |
(«orphan»), |
для |
которых |
ни |
рина из сосудистой стенки в |
||||||||||||||||||||||||||
в транскрипционной |
|
иерархии. |
эндогенные, |
ни синтетические |
печень |
заметно |
|
активируется |
|||||||||||||||||||||||
Это ключевой регулятор генного |
лиганды до настоящего времени |
LXR, при этом между обратным |
|||||||||||||||||||||||||||||
48

6, 2006 |
Национальная школа гастроэнтерологов, гепатологов |
|
|
потоком холестерина и уровнем ЛПВП четкой взаимосвязи не установлено.
Оценка взаимодействия LXR и FXR (фармезил X рецептор) у экспериментальных животных в поддержании обмена холестерина и холатов в гепатоците позволила уточнить существенное значение FXR в билиарной экскреции холестерина и холатов [35]. Синтетический аналог LXR предотвратил развитие атеросклероза на модели у мышей. Показано воздействие LXR-аго- нистов на уровень триглицеридов крови и ЛПОНП. Наряду с этим подчеркивается необходимость поиска более селективных агонистов, сохраняющих антиатерогенное действие, но не индуцирующих гипертриглицеридемию.
В комментариях к упомянутому симпозиуму по нуклеарным рецепторам [45] говорится следующее: «PPAR и LXR являются явными, одними из главных регуляторов метаболизма и многообещающими кандидатами для фармакологической основы по воздействию на самые распространенные заболевания XXI столетия – ожирение, сахарный диабет и атеросклероз».
Конвертация холестерина в холаты
Пул холатов у человека обеспечивается рециркуляцией по 6–10 раз в сутки. Суточная величина пула составляет 20– 40 г, потеря с фекалиями – около 0,5 г. Синтез новых холатов от общего пула достигает 3–5%. Таким образом, на синтез холатов в гепатоците расходуется около 1,5 г холестерина в сутки.
Клиренс ЛПВП холестерина в печени зависит от экпрессии рецептора очищения (мусорщика) типа B класса I (SR-BI). Мыши, лишенные этого рецепто-
ра (SR-BI knockout mice), имеют высокий уровень в крови ЛПВП с редуцированным клиренсом и уменьшением секреции желчных
кислот [85]. Наоборот, экспрессия SR-BI в печени сопровождается уменьшением содержания в крови ЛПВП, увеличением его клиренса и более интенсивным выделением холестерина в желчь. Многочисленные исследования in vitro и in vivo показали особое значение нуклеарных рецепторов в регулировании экспрессии SR-BI в гепатоците. Активация FXR, LXR, LRH-1 и PPAR-γ сопро-
вождается повышением экспрессии SR-BI в гепатоците [40, 50, 51, 78]. Однако фибраты, активируя PPAR-α подавляют уровень SR-BI белка, но не его мРНК [52].
В печени холестерин из ЛПВП служит предшественником для синтеза желчных кислот как одного из важнейших путей метаболизма холестерина. Желчные кислоты синтезируются через «классические» или «альтернативные» пути [72]. В классическом пути синтеза холатов начало связано с 7-гидроксилазами холестерина (CYP7A1), которые катализируют лимитирующий этап биосинтеза. Экспрессия 7-гид- роксилаз холестерина положительно регулируется оксистеролом при активации LXR-α [65]. Совместно с этим процессом у некоторых животных обнаружено накопление холестерина в печени, например у мышей с LXR-/-α, но не в диком типе, или у мышей с LXR-/-β [4, 70]. Синтез холатов также регулируется через отрицательный механизм обратной связи, опосредованный каскадом участия нуклеарных рецепторов – FXR- SHP-1-LRH-1. Накопление хола тов стимулирует подавление 7-гидроксилаз α-холестерина и 12-гидроксилаз α-стерина (CYP8B1), ключевых участников синтеза желчных кислот, через FXR.
Первым шагом в альтернативном пути синтеза холатов является фермент стерол-27 гидроксилаза (CYP27A1), который преобразовывает холестерин в
27-гидроксихолестерин. Этот метаболит стерина обнаруживается в периферийных тканях (макрофаги) и является самым обильным поставщиком оксистерола в плазму крови [19]. Он образуется в печени через митохондриальное окисление. В печени 27-гидроксихолесте- рин и периферический оксистерол типа 24-гидроксихолестерин и 25-гидроксихолестерин катализируются в холаты ферментом оксистерол-7 α-гидрокси- лаза (CYP7B1) с образованием в качестве промежуточных продуктов холаттиолов, которые,
вконечном счете, преобразуются в хенодезоксихолевую кислоту [72]. В отличие от ключевых ферментов в классическом пути синтеза желчных кислот этот путь, по-видимому, не регули-
ровался FXR [80].
Оксистерол, образованный в печени, и оксистерол, захваченный из крови, являются параллельными путями реверсионного транспорта холестерина ЛПВП и служат для возврата стеринов
впечень, при этом рассматриваются в качестве одного из основных блоков в поддержании липидного гомеостаза в целом [49, 71]. У людей описан генетический дефект CYP27A1, который имеет своеобразное фенотипическое проявление в виде церебрального ксантоматоза с развитием раннего атеросклероза [5].
Среди факторов, регулирующих образование желчи, указывается на существенное значение воздействия холатов на транскрипцию многих печеночно-спе- цифических генов. На транскрипционном уровне следует отметить влияние холатов на ген Cyp7a1 (семейство цитохро- ма-450), который обеспечивает кодирование холестерин-7 α-гидроксилазы, т. е. энзима критического этапа синтеза классических нейтральных холатов [20]. Экспрессия Cyp7a1 возникает в условиях in vitro – при
культивировании гепатоцитов в присутствии желчных кислот
49

Национальная школа гастроэнтерологов, гепатологов |
6, 2006 |
и in vivo – при избыточном уровне холатов в крови [18].
Транскрипционный уровень влияния холатов на собственный синтез объясняют лигандным взаимодействием с ядерным рецептором желчных кислот их тауро- и гликоконъюгатов – FXR [89]. Напомним, что данный рецептор относится к семейству ядерных рецепторов, насчитывающему в настоящее время около 50 вариантов [60].
Преобразование холестерина в холаты обеспечивается учас-
тием CYP7A1 и CYP8B1. Этот фермент стимулируется печеночным LXR. Отметим, что холаты подавляют нуклеарный рецептор ретиноидных кислот (RХR) – гена натрий таурохолатного транспортера.
Весьма важной является работа авторов из США [21]. В их исследовании использовались трансгенные мыши с включением искусственной бактериальной хромосомы – bacterial artificial chromosome (BAC) с ге-
ном холелитиаза (C57BL/6J) и транстиретин Abcb11 транс-
генные мыши (TTR-Abcb11).
У TTR-Abcb11 мышей отмечена редукция активности Cyp7a, но экспрессия Cyp27A1, сопровождающаяся повышением содержания гидрофобных желчных кислот (тауродезоксихолевой) и увеличением их общей гидрофобности в сочетании с повышением потока выделения холатов, фосфолипидов и холестерина. Эта линия трансгенных мышей в отличие от дикого варианта на фоне литогенной диеты характеризовалась увеличением размеров печени и отсутствием признаков стеатоза, причем у всех мышей были обнаружены камни в желчном пузыре. При этом у ВАС трансгенных мышей, как и у дикой линии, развивался стеатоз печени. Оба типа трансгенных мышей имели индукцию экспрессии гена Abcb11 через лигандное воздействие на FXR (нуклеарный регулятор гена) с изменениями активности транспортеров желч
ных кислот в каналикулярной мембране гепатоцитов и энтероцитов.
Введение синтетического FXR-агониста (стимулятора GW4064) уменьшает биохими ческие и гистологические проявления холестаза у экспериментальных животных как при лигировании желчного протока, так и в модели с α- naphthylisocyanate [47]. Этот эффект сопровождается уменьшением экспрессии гена биосинтеза холатов и увеличением экспрессии гена фосфолипидного транспортера MDR2 (Abcb4), в меньшей степени – холатного транспортера НЭЖК
(Abcb11).
Экспрессия FXR-зависимого Bsep защищает мышей от желчных инфарктов при экспериментальной билиарной обструкции, но вызывает некроз гепатоцитов
[61, 88].
Каналикулярный компартмент обмена холестерина
Билиарная (желчная) экскреция холестерина является важной составляющей его общего пула в организме и имеет прямое отношение к каналикулярному компартменту обмена холестерина.
Напомним, что каналикулярная мембрана располагает кассетными белками-траспорте- рами большого семейства АТФсвязанными кассетными с подсемействами АВС (см. рис. 1). Эти АТФазные серверы вариа бельны по функциональному предназначению: одни выполняют роль транспортеров органических анионов, другие
– органических катионов, третьи специфичны в отношении транспорта холатов или фосфолипидов.
Выяснено, что в абсорбции холестерина и нехолестериновых стеролов (ситостерина) принимают участие специфические белки-транспортеры
ABCG5- и ABCG8-стеролины.
Генетический дефект таких белков описан при ситостеролемии. Эти белки картированы геном в хромосоме 2p21 у человека [63]. Более того, оба стеролина экспрессированы только в гепатоцитах и энтероцитах [44]. Накопление холестерина при ситостеролемии связывают с генетическими дефектами этих белков [43].
Моновалентные холаты выделяются в каналикулу через холатную помпу (НЭЖК), увлекая за собой и холестерин. У человека этот транспортер при клонировании определен как близкородственный к Р-гли- копротеиновым транспортерам (SPGP), имеющий гомологичность по отношению к транспортерам MDR [23]. НЭЖК
– один из участков, обеспечивающих солюбилизацию холестерина. Белки этого насоса являются семейством Р-гликопроте- инов (SPGP). Прежде всего это multidrug resistance-associated protein 2 (MRP2) и multidrug resistance 3 (MDR3). Гены этого семейства и относят сегодня к литогенным генам. Мутации по MDR2 (официально PGY2) у мышей (гомолог у человека
MDR3 или ABCB4) сопровож-
даются расстройством секреции фосфолипидов и холестерина в желчь [87].
Плотность апикальных транспортеров и их активность регулируются экзоцитозными выростами на мембране, которые представляют прообраз везикул (подапикальные везикулы) и сами содержат транспортеры. Процесс образования везикул стимулируется набуханием, цАМФ (активация протеинкиназы), самими моноанионными холатами (ТС) и протеинкиназой, активирующейся митогенами (МАРК). При этом необходимоучастиефосфатидил инозитол-3-киназы и системы микротрубочек и холестерина. Интенсивность потока холатов и холестерина зависит от липотропности самой кислоты и способности формировать мицеллы;
50
