
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (9)
.pdf
Таблица 2. Частота выявления сывороточных антител к антигенам H. pylori в зависимости
от степени атрофии слизистой оболочки желудка, %
Степень |
Отдел |
CagA, |
VacA, |
Жгутиковый |
UreH, |
UreA, |
UreE, |
атрофии |
желудка |
116 кДа |
89 кДа |
антиген, 35 кДа |
30 кДа |
26,5 кДа |
19,5 кДа |
|
|
|
|
|
|
|
|
Слабая |
Тело |
80,0 |
60,0 |
40,0 |
80,0 |
80,0 |
20,0 |
|
Антрум |
85,7 |
71,4 |
42,9 |
85,7 |
71,4 |
57,1 |
Умеренная |
Тело |
80,0 |
60,0 |
80,0 |
80,0 |
60,0 |
20,0 |
|
Антрум |
80,0 |
60,0 |
80,0 |
80,0 |
80,0 |
0 |
Таблица 3. Степень выраженности атрофии слизистой оболочки желудка у пациентов с хро&
ническим гастритом, инфицированных различными серотипами H. pylori, %
Степень атрофии |
Отдел желудка |
|
Серотип H. pylori |
|
||
I |
Iа |
Ib |
II |
|||
|
|
|||||
Слабая |
Тело |
40,0 |
40,0 |
0 |
20,0 |
|
|
Антрум |
71,4 |
14,3 |
0 |
14,3 |
|
Умеренная |
Тело |
40,0 |
40,0 |
20,0 |
0 |
|
|
Антрум |
40,0 |
40,0 |
20,0 |
0 |
|
ским гастритом, инфицированных различными серотипами H. pylori, приведены в табл. 3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Несмотря на большое число исследований H. pylori и ассоциированной патологии, остается без ответа главный вопрос – способен ли возникающий в результате инфицирования иммунный ответ предотвратить развитие тяжелых повреждений слизистой оболочки желудка и двенадцатиперстной кишки, обеспечить элиминацию возбудителя и предотвращение повторного заражения после эрадикационной терапии?
Вторая сторона этого вопроса – возможность профилактики H. pylori-ассоциированных заболеваний иммунизацией с использованием в составе вакцины наиболее иммуногенных компонентов
H. pylori.
Скорее всего естественное инфицирование организма хозяина не приводит к индукции ответной реакции, способной предотвратить развитие разнообразных последствий воздействия бактериальных факторов. Тем не менее на мышиных моделях геликобактерной инфекции удалось добиться с помощью оральной иммунизации лизатами или очищенными рекомбинантными антигенами H. pylori протективного иммунологического эффекта [15]. Кроме того, продемонстрирована возможность иммунизации мышей с хронической инфекцией H. felis, элиминации возбудителя и защиты от последующего инфицирования [2].
Сходные результаты продемонстрированы у хорьков, инфицированных H. mustelae [6]. Природа протективного иммунного ответа на инфицирование H. pylori до конца не раскрыта. Пока-
зано, что возникновение иммунологической защиты после иммунизации уреазой H. pylori коррелирует с увеличением уровня желудочных уреазоспецифических IgA [10].
Сдругой стороны, не отмечено различий чувствительности к инфицированию или характера выраженности возникающей патологии между обычными и IgA-дефицитными пациентами, инфицированными H. pylori [1]. Кроме того, у IgA-дефицитных мышей после иммунизации антигенами H. pylori наблюдалась индукция протективного иммунного ответа [13]. Ключ к пониманию индукции иммунологической защиты против H. pylori может дать изучение попыток иммунизации с использованием мощных адъювантов. Все успешные попытки иммунизации против H. pylori связаны с использованием холерного токсина или термолабильного токсина энтеропатогенной E. coli в качестве адъюванта. Указанные субстраты, как показали McGhee и соавт. [12, 17], индуцируют Th2-опосредованные иммунные реакции.
Соткрытием островка патогенности в геноме штаммов H. pylori I серотипа и установлением функциональной характеристики генов, входящих в его состав, появился новый взгляд на механизмы взаимодействия H. pylori с организмом хозяина [3]. Контактируя с эпителиоцитами, штаммы H. pylori I серотипа, содержащие островок патогенности, индуцируют выработку IL-8, мощного хемоаттрактанта для нейтрофильных лейкоцитов. Кроме этого, контакт с эпителиоцитами способствует высвобождению бактериальных факторов. Одним из них является цитотоксин VacA, обеспечивающий вакуолизацию эпителиальных клеток, ведущую к их гибели и к изъязвлению слизистой оболочки.
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
6/2001 |
51 |

Биологически активный VacA экспрессируется только штаммами H. pylori I серотипа. Антигены H. pylori, преодолевающие эпителиальный барьер желудка, активируют макрофаги, тем самым индуцируя последующую выработку ряда провоспалительных цитокинов – IL-8, IL-6, IL-1, IL-12 [20].
IL-12 способствует индукции Th1 – иммунного ответа. Причем большинство клонов Th1-лимфо- цитов, изолированных от пациентов с пептической язвой, являются антигеноспецифичными в отношении CagA, который также экспрессируется только штаммами H. pylori I типа [7].
Th1-лимфоциты вырабатывают такие провоспалительные цитокины, как TNF-α и IFN-γ, способствующие развитию гастрита. Подобные эффекты могут объяснить более высокую патогенность штаммов H. pylori I серотипа.
Результаты нашего исследования касались некоторых сторон гуморального иммунного ответа на инфицирование H. pylori, прежде всего образования сывороточных IgG против ряда антигенов H. pylori. По нашим данным, развитие более тяжелых атрофических изменений слизистой оболочки желудка у H. pylori-инфицированных пациентов сочеталось с обнаружением в сыворотке крови антител класса IgG к цитотоксину VacA и цитотоксинассоциированному протеину CagA, что соответствовало инфицированию H. pylori серотипов I, Iа и Ib.
Кроме того, полученные нами данные свидетельствуют также о возникновении иммунного ответа на уреазоассоциированные и жгутиковые антигены H. pylori у данных пациентов. Наличие в сыворотке крови антител к жгутиковому антигену и уреазоассоциированным антигенам urease Н и А сочеталось с высокой частотой развития атрофии слизистой оболочки желудка. Этого не наблюдалось в отношении уреазоассоциированного антигена urease Е. Не исключено, однако, что последний антиген H. pylori обладает низкой иммуногенностью, вследствие чего специфические антитела к данному антигену не обнаруживались с высокой частотой.
Дальнейшие исследования особенностей иммунологического ответа у пациентов с H. pylori-ас- социированными заболеваниями будут способствовать оптимизации диагностики, лечения, а также, возможно, и профилактики этой серьезной патологии.
ВЫВОДЫ
1.У больных хроническим H. pylori-ассоции- рованным гастритом наиболее постоянно атрофия слизистой оболочки развивается при инфицировании H. pylori I и Iа серотипов. Наибольшая степень выраженности атрофических изменений отмечается при инфицировании H. pylori I, Iа и Ib серотипов, что отражает высокую патогенность микроорганизмов, способных к выработке антигенов VacA и CagA.
2.Чаще атрофия слизистой оболочки желудка при H. pylori-позитивном хроническом гастрите наблюдается при наличии сывороточных антител
кбактериальному цитотоксинассоциированному антигену CagA, жгутиковому антигену и уреазоассоциированным антигенам urease Н и А, что может отражать патогенетическую роль перечисленных бактериальных антигенов в прогрессировании гастрита.
3.Реже атрофия слизистой оболочки желудка при H. pylori-позитивном хроническом гастрите возникает при наличии антител к бактериальному уреазоассоциированному антигену urease Е, что свидетельствует против участия данного бактериального антигена в развитии воспалительного повреждения слизистой оболочки.
4.Антигены H. pylori обладают неодинаковой иммуногенностью. Это обстоятельство необходимо учитывать при разработке диагностических тест-систем для иммунологической диагностики H. pylori-инфекции и при создании иммунологических препаратов для лечения и профилактики ассоциированной патологии.
Список литературы
1.Bogstedt A.K., Nava S., Wadstrom T., Hammarstrom L. Helicobacter pylori infections in IgA deficiency: lack of role for the secretory immune system // Clin. exp. Immunol. – 1996. – Vol. 105. – P. 202–204.
2.Corthesy-Theulaz I., Porta N., Glauser M. et al. Oral immunization with Helicobacter pylori urease B subunit as a treatment against Helicobacter infection in mice // Gastroenterology. – 1995. – Vol. 109. – P. 115–121.
3.Covacci A., Falkow S., Berg D.E., Rappuoli R.
Did the inheritance of a pathogenicity island modify the virulence of Helicobacter pylori? // Trends Microbiol. – 1997. – Vol. 5. – P. 205–208.
4.Cover T.L., Glupczynski Y., Lage A.P. et al. Serologic detection of infection with cagA+ Helicobacter pylori strains // J. clin. Microbiol.
– 1995. – Vol. 33. – P. 1496–500.
5.Cover T.L., Reddy L.Y., Blaser M.J. Effects of ATPase inhibitors on the response of HeLa cells to Helicobacter pylori vacuolating toxin // Infect. Immun. – 1993. – Vol. 61. – P. 1427–1431.
6.Cuenca R., Blanchard T.G., Czinn S.J. et al. Therapeutic immunization against Helicobacter mustelae in naturally infected ferrets // Gastroenterology. – 1996. – Vol. 110. – P. 1770–1775.
Российский журнал
52 |
6/2001 |
гастроэнтерологии, гепатологии, колопроктологии |

7.D’Elios M.M., Manghetti M., DeCarli M. et al. T helper 1 effector cells specific for Helicobacter pylori in the gastric antrum of patients with peptic ulcer disease // J. Immunol. – 1997. – Vol. 158. – P. 962–967.
8.Graham D., Yamaoka Y. Disease-specific Helicobacter pylori virulence factors: the unfulfilled promise // Helicobacter. – 2000. – Vol. 5, suppl. 1. – P. S3–S9.
9.Howden C.W. Clinical Expressions of Helicobacter pylori Infection // Amer. J. Med. – 1996. – Vol. 100. – P. 27S–34S.
10.Lee C.K., Weltzin R., Thomas W.D. et al. Oral immunization with recombinant Helicobacter pylori urease induces secretory IgA antibodies and protects mice from challenge with Helicobacter felis // J. infect. Dis. – 1995. – Vol. 172. – P. 161–172.
11.Leying H., Suerbaum S., Geis G., Haas R.
Cloning and the genetic characterization of a Helicobacter pylori flagellin gene // Molec. Microbiol. – 1992. – Vol. 6. – P. 2863–2874.
12.Marinaro M., Staats H.F., Hiroi T. et al. Mucosal adjuvant effect of cholera toxin in mice results from induction of T helper 2 (Th2) cells and IL-4 // J. Immunol. – 1995. – Vol. 155. – P. 4621–4629.
13.Nedrud T., Blanchard S., Czinn G.R., Harriman G.R. Orally immunized IgA-deficient mice are protected against H. felis infection (abstract) // Gut. – 1996. – Vol. 39, suppl. 2. – A45.
14.Peek R.M., Thompson S.A., Donahue J.P. et al. Adherence to gastric epithelial cells induces expression of a Helicobacter pylori gene, iceA, that is associated with clinical outcome // Proc. Assoc. Amer. Phys. – 1998. – Vol. 110. –
P.531–544.
15.Radcliff F.J., Chen M.H., Lee A. Protective immunization against Helicobacter stimulates long term immunity // Vaccine. – 1996. – Vol. 14. –
P.780–784.
16.Suzuki J., Muraoka H., Ohnishi H. et al. Evidence of colonization of urease negative variants of Helicobacter pylori in Mongolian gerbils // Gastroenterology. – 1999. – Vol. 116. – A324.
17.Takahashi I., Marinaro M., Kiyono H. et al. Mechanisms for mucosal immunogenicity and adjuvancy of Escherichia coli labile toxin // J. infect. Dis. – 1996. – Vol. 173. – P. 627–635.
18.Van Doorn L.J., Figueriedo C., Sanna R. et al. Clinical relevance of the cagA, vacA and iceA status of Helicobacter pylori // Gastroenterology. – 1998. – Vol. 115. – P. 58–66.
19.Yamaoka Y., Kodama T., Gutierrez O. et al. Relationship between Helicobacter pylori iceA, cagA and vacA status and clinical outcome: studies in four different countries // J. clin. Microbiol. – 1999. – Vol. 37. – P. 2274–2279.
20.Yamaoka Y., Kodama T., Kita M. et al. Relations between clinical presentation, Helicobacter pylori density, interleukin-1β and -8 production and cagA-status // Gut. – 1999. – Vol. 45. – P. 804–811.
FEATURES OF THE IMMUNE RESPONSE FOR HELICOBACTER PYLORI-INFECTED PATIENTS WITH CHRONIC GASTRITIS
S.Z. Chukov, V.D. Pasechnikov
In 18 patients with H. pylori-associated gastritis, proved histologically, by a western blotting method in a blood serum the presence of specific IgG to 6 protein antigens of H. pylori was assessed. Then, the histological and serological data were compared. The results of investigation allow to determine differences in immunologic response, accompanying the development of stomach mucosal inflammatory damage at different degree of severity, at infection with defined serotypes H. pylori.
Key words: Helicobacter pylori, serotype, Western blot analysis, stomach mucosal atrophy, contamination.
* * *
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
6/2001 |
53 |

УДК616.37-002.2-085.245
ЭФФЕКТИВНОСТЬ ИНГИБИТОРА ПРОТОННОЙ ПОМПЫ ОМЕПРАЗОЛА (ЛОСЕКА МАПС) ПРИ ХРОНИЧЕСКОМ ПАНКРЕАТИТЕ В СТАДИИ ОБОСТРЕНИЯ
И.В. Маев, Е.С. Вьючнова, Д.Т. Дичева, Е.В. Овсянникова
(Кафедра пропедевтики внутренних болезней с курсом гастроэнтерологии Московского государственного медико-стоматологического университета)
Исследование проводилось с целью определения эффективности ингибитора протонной помпы омепразола (лосека МАПС) в терапии хронического панкреатита. 56 пациентам была назначена комплексная терапия с включением лосека МАПС. Контролем служили 23 пациента, получавшие стандартную терапию. При приеме лосека МАПС максимальный эффект купирования болевого синдрома достигался на первой неделе. Он также позволял уменьшить дозу и кратность приема анальгетиков. Полученные результаты свидетельствуют о необходимости включения ингибитора протонной помпы омепразола (лосека МАПС) в комплекс лечения хронического панкреатита.
Ключевые слова: ингибитор протонной помпы, омепразол, панкреатит.
Хронический панкреатит (ХП) является гетерогенным заболеванием, характеризующимся структурными и функциональными изменениями ткани поджелудочной железы (ПЖ), которые сохраняются, несмотря на прекращение воздействия этиоло- г и ч е - ского фактора, и приводят к экзо- и эндокринной
недостаточности [1].
В последние время отмечается рост заболеваемости ХП. Так, в общей клинической практике пациенты с ХП составляют от 0,2 до 0,6%, а среди больных гастроэнтерологического профиля – от 5,1 до 9%. В среднем в год регистрируются 8,5–10 новых случаев этого заболевания на 100 000 населения [6].
В клинической картине ХП преобладает болевой синдром, разнообразный по интенсивности и характеру, связанный в большинстве случаев с нарушением оттока панкреатического сока и с увеличением объема секреции ПЖ. Это в свою очередь вызывает повышение внутрипротокового и тканевого давления, отек ПЖ, что приводит к болевому приступу [7].
Основное направление в лечении ХП – уменьшение секреции и внутрипротокового давления ПЖ для создания условий функционального покоя органа и купирования болевого синдрома. Медикаментозные средства, воздействующие на секрецию ПЖ, разнообразны по механизму действия, и их спектр постоянно увеличивается.
Одним из механизмов стимуляции панкреатической секреции считается повышение кислотообразования в желудке и, как следствие, ацидификация двенадцатиперстной кишки, что ведет к по-
вышению синтеза холецистокинина и секретина [4, 5, 8]. Но до сих пор нет однозначного подхода к назначению антисекреторных препаратов, блокирующих внутрижелудочную секрецию у больных с ХП в стадии обострения [3].
Цель нашего исследования – изучение клинической эффективности перорального применения лосека МАПС у больных ХП в стадии обострения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Под наблюдением находились 79 больных (38 мужчин и 42 женщин в возрасте от 25 до 52 лет, средний – 36,2±2,5 года) ХП неосложненных форм в стадии обострения. Продолжительность анамнеза в среднем составила 10,7±3,1 года. Возникновение данной патологии у 38 больных связано с приемом алкоголя (16 женщин и 22 мужчин), билиарная форма панкреатита выявлена у 32 пациентов (19 женщин и 13 мужчин), идиопатический панкреатит – у 9 (6 женщин и 3 мужчин).
Всем пациентам проведено предварительное общетерапевтическое обследование. Диагноз верифицировали клинически с помощью физикального обследования с учетом интенсивности болевого синдрома, наличия диспептических явлений и характера фекалий. Болевой синдром оценивали ежедневно сам больной (субъективно) и врач по десятибалльной шкале для объективизации его выраженности [2].
В динамике анализировали результаты биохимического исследования крови, копрограмму и
Российский журнал
54 |
6/2001 |
гастроэнтерологии, гепатологии, колопроктологии |

активность амилазы мочи. Ультразвуковое исследование органов брюшной полости осуществляли с помощью аппарата «Hewlett Packard HX»,
эзофагогастродуоденоскопию (ЭГДС) – с использованием гибкого фиброскопа «Olympus» gif xQ30.
Всем больным проводили суточное мониторирование внутрижелудочной кислотности до и после лечения с помощью портативного ацидогастрометра «Гастроскан-24» («Исток-Система», Россия), который автоматически фиксирует рН в течение суток. Для исследования использовали рНметрический зонд с 3 сурьмяными кольцевыми электродами, которые располагались в кардии, теле и антральном отделе желудка, и хлорсеребряным накожным электродом сравнения.
После трансназального введения зонда пациентам проводили рентгеноскопию желудка для контроля за положением зонда. Для оценки полученных результатов исследования рассматривали следующие параметры: средний min рН, суммарную продолжительность времени с рН>4 и рН<2 за сутки для тела желудка и его антрального отдела. Внутрижелудочную кислотность с рН в интервале от 0 до 1,5 оценивали как гиперацидность, от 1,5 до 2,5 – как нормацидность, от 2,5 до 4,0 – как гипоацидность.
Всех больных разделили на две группы: 1-я группа – 56 больных (27 мужчин и 29 женщин), 2-я – 23 больных (10 мужчин и 13 женщин). Обе группы были сопоставимы по возрасту, полу, длительности анамнеза ХП, этиологическим факторам и выраженности болевого синдрома.
Пациентам 1-й группы назначали ингибиторы протонной помпы омепразол (лосек МАПС фирмы «AstraZeneca», Швеция–Англия) в дозе 20 мг 2 раза в день per os в 8 и 20 ч в течение 14 дней, 5 мл баралгина внутримышечно и инфузионную терапию. Доза и длительность препаратов определялись интенсивностью болевого синдрома. Пациенты, у которых при рН-метрии с фармакологической пробой на лосек МАПС отсутствовал антисекреторный эффект, в 1-ю группу не вошли.
Больные 2-й группы получали аналогичную комплексную терапию, не включавшую антисекреторные препараты.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Интенсивность болевого синдрома до лечения
Оценка болевого синдрома по 10-балльной шкале |
составляла 7,3±2,1 балла у больных 1-й группы, 7,6±1,9 балла – у больных 2-й группы (р>0,05). К концу 1-й недели (8-й день) от начала терапии интенсивность болевого синдрома составила 2,8±1,7 балла в 1-й группе и 5,7±1,2 балла – во 2-й группе. К концу 2-й недели (15-й день) от начала терапии интенсивность болевого синдрома составила 0,8±0,3 и 1,2±0,2 балла соответственно (см. рисунок).
Интенсивность боли к концу 1-й недели уменьшилась у 50,0% больных 1-й группы и у 52,2% – 2-й. Боли купированы у 35,7% больных 1-й группы и у 13,0% – 2-й. Болевой синдром оставался прежним у 14,3% пациентов 1-й группы и у 34,8%
– 2-й. К концу 2-й недели в 1-й группе интенсивность боли уменьшилась у 28,6% больных, купированы – у 71,4%, без эффекта – у 0%, во 2-й группе – у 39,1, 39,1 и 21,8% больных соответственно (табл. 1).
При более выраженном болевом синдроме (более 5 баллов) пациентам обеих групп назначали баралгин – 5 мл внутримышечно: 25 пациентам 1-й группы и 20 – 2-й. Кратность его введения и длительность применения определялись уровнем интенсивности болевого синдрома.
К концу 1-й недели необходимость в приеме баралгина сохранялась у 8 пациентов 1-й группы и у 12 – 2-й. К концу 2-й недели 7 пациентов 2-й группы и пациенты 1-й группы в назначении баралгина не нуждались. Из представленных данных следует, что длительность назначения анальгетиков и кратность их приема в 1-й группе
Таблица 1. Динамика интенсивности болевого синдрома при обострении хронического
панкреатита, %
|
Динамика болевого |
На 1 й неделе |
На 2 й неделе |
|
|||||
|
синдрома |
1 я группа |
2 я группа |
1 я группа |
2 я группа |
|
|||
|
Уменьшение |
50,0 |
52,2 |
28,6* |
39,1 |
|
|
|
|
|
Kупирование |
35,7 |
13,0 |
71,4* |
39,1 |
|
|
|
|
|
Без эффекта |
14,3 |
34,8 |
– |
21,8 |
|
|
|
|
|
* Достоверность разности показателей до и после лечения в 1-й группе (р<0,05). |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Российский журнал |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
гастроэнтерологии, гепатологии, колопроктологии |
6/2001 |
55 |

достоверно ниже, чем во 2-й.
При суточной интрагастральной рН-метрии до лечения средний рН составил 1,15±0,06 в 1-й группе и 1,18±0,05 – во 2-й (р>0,05). Гиперацидность наблюдалась у 69,7% больных 1-й группы и у 65,2% – 2-й, нормацидность – у 30,3% больных 1-й группы и у 34,8% – 2-й. Пациентов с гипоацидностью не выявлено.
При оценке уровня кислотообразования до лечения средняя продолжительность (за 24 ч исследования) с рН>4 составила 346,4±45,8 мин в 1-й группе и 363,2±50,4 мин – во 2-й. Продолжительность с рН<2 составила 808,5±32,1 и 789,0±46,7 мин соответственно. Значения внутрижелудочного рН, рассчитанные для тела и антрального отдела желудка, достоверно не отличались (р>0,05).
В силу того что таблетка лосека МАПС содержит микрогранулы омепразола, которые оказывают постепенное антисекреторное действие, контроль уровня кислотности желудка проводился спустя 2 нед от начала лечения. При оценке кислотообразования на 15-й день от начала лечения средний min рН составил 6,7±1,2 в 1-й группе и 2,2±0,8 – во 2-й. Средняя продолжительность (за 24 ч исследования) с рН>4 составила 1060,4±25,0 мин в 1-й группе и 480,2±105,4 мин
– во 2-й. Продолжительность с рН<2 составила во 2-й группе 860±115 мин. Значения рН<2 в 1-й группе не выявлено (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Важное значение в патогенезе ХП имеет дополнительная стимуляция экзокринной функции ПЖ. Она способствует снижению выработки воды и электролитов, преждевременной активации собственных ферментов, сопровождающейся гипертензией внутрипротоковой системы и нарушением оттока секрета. Эти явления обычно проявляются болевым синдромом с нарушением внешне- и внутрисекреторной функций ПЖ [1, 7].
На фоне часто встречающейся желудочной гиперсекреции у больных ХП происходят дополнительная стимуляция экзокринной функции ПЖ,
повышение внутрипротокового давления, что ведет к прогрессированию болевого синдрома и диспептических явлений. Под действием соляной кислоты инактивируются также ферментные препараты (как таблетированные, так и капсулированные формы). Поэтому для адекватного снижения кислотообразования в желудке в период обострения ХП и создания «функционального покоя» ПЖ патогенетически обоснованно применение современных антисекреторных средств.
Представленные данные позволяют констатировать, что включение в комплекс консервативных лечебных мероприятий ингибитора протонной помпы – омепразола (лосека МАПС) – при обострении ХП позволяет купировать боль и уменьшить ее интенсивность в более короткие сроки у большинства больных.
Таким образом, основным преимуществом терапии, включающей ингибиторы протонной помпы, является возможность уменьшить кратность и длительность обезболивающей терапии.
Полученные в ходе исследования результаты позволяют сделать заключение о том, что омепразол (лосек МАПС) усиливает действие комплексной терапии, достоверно уменьшая интенсивность болевого и диспептического синдромов при обострении неосложненных форм ХП. Уже к концу первой недели лечения отмечается максимальное различие характера болевого синдрома у пациентов 1-й и 2-й групп, которое на 2-й неделе лечения на фоне приема лосека МАПС приводит к купированию болевого синдрома у 71,4% пациентов и у 39,1% – во 2-й группе.
У обследованных больных вне зависимости от этиологии ХП в 70% случаев выявлена гиперацидность, что способствует сохранению активности патологического процесса в ПЖ. На рНграммах при билиарной форме отмечались большая продолжительность и частота дуоденогастральных рефлюксов.
Через 2 нед от начала приема лосека МАПС возрастали среднеминимальное значение рН до 6,7±1,2 и продолжительность рН>4 до 1060,4±25,0 мин. При этом рН<2 не регистрировался, что свидетельствует об эффективности исследуемого препарата в схемах лечения обост-
Таблица 2. Динамика уровня кислотообразования при обострении хронического
панкреатита, х±mх
|
|
|
Показатель |
До лечения |
|
Через 2 нед |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 я группа |
2 я группа |
|
1 я группа |
|
2 я группа |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
Суммарная продолжительность с рН>4, мин |
346,4±45,8 |
363,2±50,4** |
|
1060,4±25,0* |
480,2±105,4*** |
|
|||
|
Суммарная продолжительность с рН<2, мин |
808,5±32,1 |
798,0±46,7** |
|
– |
860,0±115,0*** |
|
|||
|
Средней min рН |
1,18±0,05 |
1,15±0,06** |
|
6,7±1,2 * |
2,2±0,8*** |
|
|||
|
* Достоверность разности показателей до и после лечения в 1-й группе (р<0,05). |
|
|
|
|
|||||
|
** Достоверность разности показателей до лечения в 1-й и 2-й группах (р<0,05). |
|
|
|
|
|||||
|
*** Достоверность разности показателей после лечения в 1-й и 2-й группах (р<0,05). |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Российский журнал |
|
|
|
|
|
|
|
|
|
|
||
56 |
6/2001 |
гастроэнтерологии, гепатологии, колопроктологии |

рения ХП.
Полученные нами результаты позволяют рекомендовать включение лосека МАПС в комплекс терапевтических мероприятий, назначаемых при обострении ХП.
ВЫВОДЫ
1. Повышенный уровень кислотообразования выявлен у большинства больных хроническим панкреатитом, что требует включения в ком-
кой терапии.
Список литературы
1. Белоусова Е.А., Златкина А.Р., Никулина И.В., Лобаков А.И. Квамател в лечении острого и хронического панкреатита // Клин. мед.
– 2000. – Т. 78, № 9. – С. 55–58.
2.Дичева Д.Т. Индивидуализация комплексной терапии язвенной болезни желудка и двенадцатиперстной кишки в зависимости от фазы, стадии заболевания и выраженности психовегетативных нарушений: Автореф. дис. … канд. мед. наук. М., 1999.
3.Кокуева О.В., Усова О.А., Новоселя Н.В. и др. Оценка эффективности антисекреторной терапии язвенной болезни двенадцатиперстной кишки, сочетанной с хроническим панкреатитом // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2000. – Т. 10, № 5, прил. № 11 – С. 68,
плексную терапию антисекреторных препаратов.
2.Для определения уровня и характера кислотообразования желудка и для оценки эффективности антисекреторного препарата у конкретного больного необходимо проведение суточной рНметрии.
3.Включение лосека МАПС в комплекс терапевтических мероприятий приводит к более быстрому и эффективному купированию болевого синдрома при хроническом панкреатите, позволяет уменьшить дозу и длительность анальгетичес-
№ 252.
4.Лопаткина Т.Н. Хронический панкреатит // Новый мед. журн. – 1997. – № 2. – С. 7–11.
5.Мараховский Ю.Х. Хронический панкреатит // Новые данные об этиологии и патогенезе. Современная классификация. Успехи в диагностике и лечении // Рус. мед. журн. – 1996. – Т. 4, № 3.
– С. 156–160.
6.Сакович М.Н. Диагностика и лечение хронических болезней поджелудочной железы. – Минск, 1999.
7.Pichumoni C.S. Chronic pancreatitis: pathogenesis and management of pain // J. сlin. Gastroenterol.
– 1998. – Vol. 27, N 2. – P. 101–107.
8.Steer M.L., Waxman I., Freedman S. Chronic pancreatitis // New Engl. J. Med. – 1995. – Vol. 332, N 22 .– P.1482–1490.
EFFICACY OF PROTON PUMP INHIBITOR – OMEPRAZOLE (LOSEC MUPS) IN RELAPSE OF CHRONIC PANCREATITIS
I.V. Mayev, Ye.S. V'yuchnova, D.T. Dicheva, Ye.V. Ovsyannikova
The research was designed to assess the efficacy of proton pump inhibitor omeprazole (Losec MUPS) in therapy of chronic pancreatitis. Combined therapy including Losec MUPS was prescribed for 56 patients. Control group has made 23 patients at standard therapy. Patients at Losec MUPS therapy developed maximum analgesic effect during the first week of treatment. This medication also provided reduction of dosage and frequency of analgetics drugs intake. Obtained results testify the usefulness of proton pump inhibitor omeprazole (Losec MUPS) in the complex of treatment of chronic pancreatitis.
Key words: proton pump inhibitor, omeprazole, pancreatitis.
* * *
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
6/2001 |
57 |

УДК [616.36-002.14:578.891]-06:616.394-07:616.153.96-074
ЦИТОКИНОВЫЙ ПРОФИЛЬ СЫВОРОТКИ КРОВИ БОЛЬНЫХ ХРОНИЧЕСКИМ ВИРУСНЫМ ГЕПАТИТОМ С, АССОЦИИРОВАННЫМ С 1–3-РОСТКОВОЙ ЦИТОПЕНИЕЙ В КРОВИ
Ю.О. Шульпекова, С.Н. Маммаев, Е.А. Лукина, Е.П. Сысоева, А.А. Левина, Ч.С. Павлов, В.Т. Ивашкин
(Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Московской медицинской академии им. И.М. Сеченова, Гематологический научный центр РАМН, Москва)
Проведен сравнительный анализ клинической картины, гистологических характеристик и сывороточной концентрации основных провоспалительных цитокинов (интерлейкинов 1β и 6, туморнекротизирующего фактора α) в подгруппах больных хроническим вирусным гепатитом С без гематологических нарушений (n=42) и больных хроническим вирусным гепатитом С, ассоциированным с 1–3-ростковой цитопенией в крови, развивающейся по механизму неэффективного гемопоэза (n=28). Установлены существенные различия, которые свидетельствуют в пользу того, что хронический вирусный гепатит С, ассоциированный с 1–3-ростковой цитопенией в крови, представляет собой вариант хронического гепатита С низкой активности с системными проявлениями, при котором кроветворная система служит мишенью вирусного и/или иммуноопосредованного поражения.
Ключевые слова: хронический вирусный гепатит С, цитокины.
Цитопении в крови являются следствием нарушения созревания клеток в костном мозге либо депонирования, либо ускоренной гибели зрелых форменных
элементов [7]. При болезнях печени развитие цитопении в большинстве случаев связано с гиперспленизмом и/или выработкой аутоантител к форменным элементам крови [3, 6, 7].
Гиперспленизм обусловлен активацией эндотелиальных и иммунных элементов селезенки, в частности макрофагов, что сопровождается повышенной элиминацией клеток крови из системной циркуляции. Как правило, он сочетается со значительной спленомегалией и повышенным депонированием форменных элементов крови, прежде всего тромбоцитов и лейкоцитов [7].
Помимо реакций с аутоантителами тромбоцитопения может быть связана с диссеминированным внутрисосудистым свертыванием крови и/или распространенным поражением эндотелия. В этих случаях она называется тромбоцитопенией потребления [3, 7]. При печеночной недостаточности тромбоцитопения может быть следствием снижения образования тромбопоэтина в печени [9].
В последние годы пристальное внимание исследователей привлекает роль цитокинов в развитии гематологических синдромов, особенно тех, при которых предполагается причинная связь с вирусными инфекциями [2–7]. По современным
представлениям, патогенетическая сущность данных синдромов заключается в характере взаимодействия вирусов с организмом хозяина. Персистенция вирусов в клетках кроветворной системы сопровождается дисфункцией стромальных элементов костного мозга, изменением продукции факторов, участвующих в регуляции пролиферации и созревания гемопоэтических клеток.
Важную роль в регуляции кроветворения играют цитокины, которые представляют собой низкомолекулярные белки (со средней молекулярной массой 15–60 кДа), продуцируемые клетками различных типов конститутивно или под влиянием активирующих воздействий. Цитокины регулируют рост и дифференцировку различных клеточных линий, их метаболическую и функциональную активность. Ряд белков этого класса опосредует процесс «программированной клеточной гибели» – апоптоза [1, 2, 10].
Цитокины TNF-α, TGF-β1, IL-10 подавляют пролиферацию, а INF-γ и TNF-α обладают способностью индуцировать апоптоз гемопоэтических клеток-предшественников.
Показана патогенетическая роль цитомегаловируса, вирусов Эпштейна–Барра и иммунодефицита человека в развитии апластического синдрома. Инфицирование вирусами стромальных макрофагов и эндотелиоцитов нарушает секрецию цитокинов, регулирующих гемопоэз: снижается продукция интерлейкина-1 (IL-1), гранулоци-
Российский журнал
58 |
6/2001 |
гастроэнтерологии, гепатологии, колопроктологии |

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МАТЕРИАЛ И МЕТОДЫ |
||||
|
|
|
|
|
|
|
|
|||||
|
Таблица 1. Основные показатели общего анализа крови у |
|
ИССЛЕДОВАНИЯ |
|
|
|||||||
|
|
больных ХВГ С, ассоциированным |
|
|
|
|
|
|
|
|
||
|
|
с 1–3&ростковой цитопенией в крови (n=28) |
|
В исследование были включены |
||||||||
|
|
|
|
|
|
|
|
70 больных ХВГ С. Диагноз ХВГ С |
||||
|
|
|
|
Число больных |
|
|||||||
|
Показатель общего анализа крови |
|
|
устанавливался на основании ком- |
||||||||
|
абс. |
% (p±mp) |
|
|
||||||||
|
|
|
|
|
|
плексного клинико-лабораторного |
||||||
|
Нормо или гипохромная анемия: |
|
|
|
|
обследования больных. Маркеры |
||||||
|
эритроциты <3,5×1012/л |
15 |
53,6±9,6 |
|
|
HBV-инфекции (HBsAg, HBsAb, |
||||||
|
гемоглобин <110 г/л* |
15 |
53,6±9,6 |
|
|
HbeAg, HBsAb, HbcorAb) отсутст- |
||||||
|
Лейкоциты <3,5×109/л |
17 |
60,7±9,4 |
|
|
вовали у всех обследованных. |
||||||
|
Тромбоциты <100×109/л |
17 |
60,7±9,4 |
|
|
Особенность клинической карти- |
||||||
|
*Для мужчин <120 г/л. |
|
|
|
|
ны у 28 (40%) из 70 больных было |
||||||
|
|
|
|
|
наличие сопутствующей 1–3-рост- |
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
ковой ЦтП в крови (табл. 1). |
||||
|
|
|
|
|
|
|
|
|||||
тарно-макрофагального колониестимулирую- |
|
|
|
Результаты исследований анти- |
||||||||
тел к тромбоцитам, лейкоцитам и эритроцитам у |
||||||||||||
щего фактора (GM-CSF), гранулоцитарного ко- |
всех пациентов с ЦтП оказались отрицательны- |
|||||||||||
лониестимулирующего фактора (G-CSF) и по- |
ми. Биохимические тесты на гемолиз у пациентов |
|||||||||||
вышаются |
уровни |
туморнекротизирующего |
с анемией также были отрицательными. |
|||||||||
фактора α (TNF-α), трансформирующего фак- |
По результатам |
исследования |
сывороточных |
|||||||||
тора роста β (TGF-β) и интерлейкина-10 |
показателей обмена железа у пациентов с анеми- |
|||||||||||
(IL-10). |
|
|
|
ей, данных за наличие истинного дефицита желе- |
||||||||
|
Входящие в состав стромы цитотоксические |
за не получено: содержание сывороточного желе- |
||||||||||
лимфоциты |
(CTL) |
вырабатывают повышенное |
за и сывороточного ферритина было нормальным |
|||||||||
количество интерферона γ (INF-γ) и TNF-α, об- |
или повышенным. |
|
|
|
||||||||
ладающих в больших концентрациях проапопто- |
У всех больных ХВГ С+ЦтП исследовали со- |
|||||||||||
тическим воздействием на гемопоэтические клет- |
стояние костномозгового кроветворения. Прово- |
|||||||||||
ки-предшественники [2, 3, 8]. В условиях вирус- |
дили стернальную пункцию и трепанобиопсию |
|||||||||||
ной инфекции повышенная экспрессия Fas-ли- |
подвздошной кости. При морфологическом ис- |
|||||||||||
ганда (FasL) клетками костномозгового микро- |
следовании во всех случаях выявлены нормаль- |
|||||||||||
окружения, очевидно, также повышает скорость |
ный клеточный состав костного мозга (отсутствие |
|||||||||||
апоптоза кроветворных элементов. |
|
опухолевых или атипичных элементов), нормаль- |
||||||||||
|
Предполагают, что гиперпродукция IL-6 стро- |
ное или повышенное содержание кариоцитов, по- |
||||||||||
мальными |
клетками способствует |
развитию |
вышенное содержание клеток-эффекторов им- |
|||||||||
В-клеточных лимфом при хронических инфекци- |
мунного ответа |
(лимфоцитов, |
плазматических |
|||||||||
ях, обусловленных вирусом Эпштейна–Барра и |
клеток, моноцитов/макрофагов), признаки акти- |
|||||||||||
ВИЧ [8]. |
|
|
|
вации эритропоэза и диспластические изменения |
||||||||
|
В последние годы активно изучается роль ин- |
эритрокариоцитов. |
|
|
|
|||||||
фекции вирусами гепатита В (HBV) и С |
Пречисленные |
морфологические |
признаки |
|||||||||
(HCV), обладающими тропизмом к клеткам кро- |
имели неспецифический характер и трактовались |
|||||||||||
ветворной системы, в развитии неэффективного |
как «реактивные изменения гемопоэза». Гемато- |
|||||||||||
гемопоэза, апластической анемии, лимфо- и мие- |
логический диагноз формулировался как «им- |
|||||||||||
лопролиферативных синдромов, В-клеточных |
мунная цитопения». |
|
|
|
||||||||
лимфом [3, 5, 6]. |
|
|
Степень выраженности симптомов ХВГ С ус- |
|||||||||
|
HBV и HCV не обладают непосредственным |
ловно оценивалась в баллах. |
|
|
||||||||
цитопатическим воздействием на инфицирован- |
Биопсия |
|
печени |
проведена |
44 |
пациентам: |
||||||
ные клетки. |
|
|
|
30 больным ХВГ С без гематологических наруше- |
||||||||
|
Хронические вирусные гепатиты В и С (ХВГ |
ний и 14 больным ХВГ С+ЦтП. Морфологичес- |
||||||||||
В, ХВГ С) относятся к разряду иммунопатологи- |
кую оценку проводили на основании индекса ги- |
|||||||||||
ческих болезней, основу клинических проявле- |
стологической активности (ИГА) R.G. Knodell |
|||||||||||
ний которых составляют иммунные механизмы. |
и индекса фиброза (ИФ) по V.J. Desmet. |
|||||||||||
Цитокиновый профиль сыворотки крови пред- |
Концентрацию цитокинов в сыворотке крови |
|||||||||||
ставляет собой одну из важных характеристик |
определяли методом иммуноферментного анализа |
|||||||||||
патофизиологических процессов, развивающихся |
(ELISA). Для исследования концентрации IL-1β |
|||||||||||
при болезнях иммунопатологической природы. |
и IL-6 использовали коммерческие тест-системы |
|||||||||||
|
Цель настоящего исследования – определе- |
фирмы «Immunotech» (Франция), для TNF-α – |
||||||||||
ние характеристики цитокинового профиля сыво- |
тест-системы «R&D Systems Europe» (США). |
|||||||||||
ротки крови больных ХВГ С, ассоциированным с |
Постановку всех реакций осуществляли в соот- |
|||||||||||
цитопенией (ЦтП) в крови. |
|
ветствии с инструкциями фирм-изготовителей. |
||||||||||
|
|
|
|
|
Взятие образцов крови проводили одномоментно |
|||||||
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
6/2001 |
59 |
|
|
|
|
|
|
|
нородного состояния и выравнивания ее |
||||||
|
|
|
|
|
|
|
температуры |
с |
температурой |
воздуха. |
|||
|
|
|
|
|
|
|
Повторно образцы не замораживали. |
||||||
|
|
|
|
|
|
|
Контрольную |
группу |
|
составили |
|||
|
|
|
|
|
|
|
20 практически здоровых лиц в возрасте |
||||||
|
|
|
|
|
|
|
от 22 до 50 лет (средний – 32,4±3,9 года). |
||||||
|
|
|
|
|
|
|
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ |
||||||
|
|
|
|
|
|
|
Средний возраст больных ХВГ С+ЦтП |
||||||
|
|
|
|
|
|
|
составил 43,8±6,4 года и был достоверно |
||||||
|
|
|
|
|
|
|
выше, чем у пациентов с ХВГ С без гема- |
||||||
|
|
|
|
|
|
|
тологических нарушений (32,7±3,9 года). |
||||||
|
|
|
|
|
|
|
Значимых различий по полу не было. |
||||||
|
|
|
|
|
|
|
У больных ХВГ С+ЦтП клиническая |
||||||
|
|
|
|
|
|
|
картина болезни существенно отлича- |
||||||
|
|
|
|
|
|
|
лась. Выраженность астенических явле- |
||||||
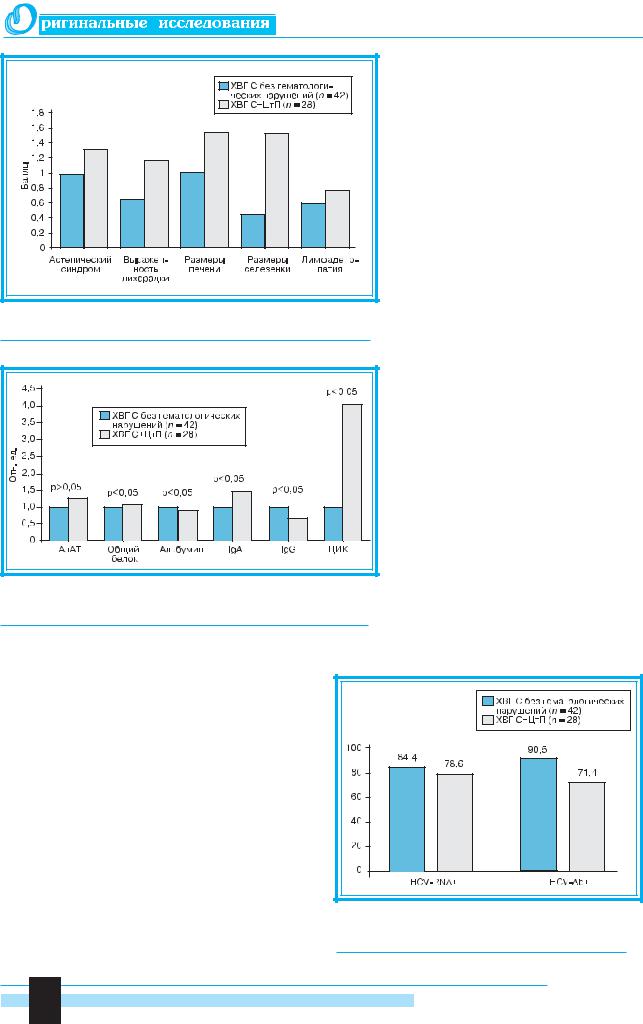
Рис. 1. Основная клиническая характеристика больных ХВГ С |
ний, лихорадки, степени увеличения пе- |
||||||||||||
без гематологических нарушений и ХВГ С+ЦтП |
|
чени и селезенки значительно превышала |
|||||||||||
|
|
|
|
|
|
|
соответствующие проявления у пациен- |
||||||
|
|
|
|
|
|
|
тов |
без |
гематологических |
нарушений |
|||
|
|
|
|
|
|
|
(p<0,05, рис. 1). У больных ХВГ С+ЦтП |
||||||
|
|
|
|
|
|
|
доля |
лихорадящих больных |
составила |
||||
|
|
|
|
|
|
|
25/28 (89%), у пациентов без гематоло- |
||||||
|
|
|
|
|
|
|
гических нарушений – 22/42 (52%). |
||||||
|
|
|
|
|
|
|
В общей группе больных ХВГ С актив- |
||||||
|
|
|
|
|
|
|
ность сывороточной АлАТ была практиче- |
||||||
|
|
|
|
|
|
|
ски нормальной (до 1,5 нормы) у 29 |
||||||
|
|
|
|
|
|
|
(41%), незначительно повышенной (от 1,5 |
||||||
|
|
|
|
|
|
|
до 3 норм) – у 24 (34%), умеренно повы- |
||||||
|
|
|
|
|
|
|
шенной (от 3 до 5 норм) – у 13 (19%), |
||||||
|
|
|
|
|
|
|
значительно повышенной (от 5 до 7 норм) |
||||||
|
|
|
|
|
|
|
– у 4 (6%). |
|
|
|
|
||
|
|
|
|
|
|
|
Достоверных различий в выраженнос- |
||||||
|
|
|
|
|
|
|
ти цитолитического синдрома между под- |
||||||
Рис. 2. Основные биохимические и иммунологические показате- |
группами больных ХВГ С без гематоло- |
||||||||||||
гических нарушений и больных ХВГ |
|||||||||||||
ли сыворотки крови больных ХВГ С без гематологических нару- |
С+ЦтП не отмечалось. У больных ХВГ |
||||||||||||
шений и ХВГ С+ЦтП |
|
|
|
|
|
С+ЦтП содержание общего белка, IgA и |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
циркулирующих иммунных комплексов |
||||||
для исследования концентрации цитокинов и для |
|
(ЦИК) в сыворотке крови было досто- |
|||||||||||
|
|
|
|
|
|
|
|
||||||
выполнения других лабораторных анализов, пре- |
|
|
|
|
|
|
|
|
|||||
дусмотренных планом обследования, и в преде- |
|
|
|
|
|
|
|
|
|||||
лах 7-дневного срока по отношению к биопсии |
|
|
|
|
|
|
|
|
|||||
печени. Пациентам, имевшим признаки внепече- |
|
|
|
|
|
|
|
|
|||||
ночных воспалительных |
процессов, |
содержание |
|
|
|
|
|
|
|
|
|||
цитокинов |
исследовали |
не |
ранее |
чем |
через |
|
|
|
|
|
|
|
|
14 дней после регресса воспаления. |
|
|
|
|
|
|
|
|
|
|
|||
Образцы крови получали с помощью апироген- |
|
|
|
|
|
|
|
|
|||||
ного материала во избежание механической трав- |
|
|
|
|
|
|
|
|
|||||
мы, активации клеток крови и искажения резуль- |
|
|
|
|
|
|
|
|
|||||
татов исследования. После образования сгустка |
|
|
|
|
|
|
|
|
|||||
кровь центрифугировали и осторожно отделяли |
|
|
|
|
|
|
|
|
|||||
сыворотку. При исследовании в течение 24 ч сы- |
|
|
|
|
|
|
|
|
|||||
воротку сохраняли в пластиковых пробирках при |
|
|
|
|
|
|
|
|
|||||
температуре +2–4°С, а при необходимости более |
|
|
|
|
|
|
|
|
|||||
длительного хранения – при минус 20°С (но не |
|
|
|
|
|
|
|
|
|||||
более 2 мес). |
|
|
|
|
Рис. 3. Частота выявления маркеров HCV-инфекции |
||||||||
Перед исследованием сыворотку разморажива- |
в сыворотке крови больных ХВГ С без гематологи- |
||||||||||||
ли при комнатной температуре до достижения од- |
че- |
|
|
|
|
|
|
|
|||||
60 |
|
|
|
|
|
|
|
|
|
|
|
Российский журнал |
|
|
|
|
|
|
6/2001 |
гастроэнтерологии, гепатологии, колопроктологии |
|||||||
