
6 курс / Гастроэнтерология / Багненко_С_С_Комплексное_магнитно_резонансное_исследование_в_выявлении
.pdf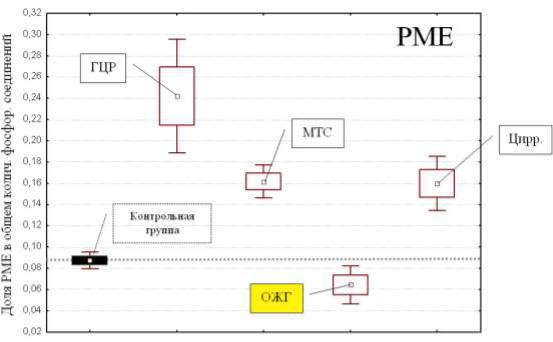
221
Рисунок 57. Содержание доли PME в общем количестве соединений фосфора в зависимости от этиологии очагового поражения печени. В
гепатокарциномах, метастазах и цирротических узлах значение показателя достоверно выше результатов контрольной группы, а в очагах жирового гепатоза
– ниже
Данные изменения можно было обнаружить при визуальной оценке спектров (резкий рост амплитуды и интегрального значения пика PME), а также при просмотре цветных карт метаболитов (Рисунки 56, 58). В то же время спектры, полученные в ОЖГ, на внешний вид, как правило, ничем не отличались от таковых в контрольной группе, и только последующий статистический анализ позволял предположить наличие у пациента патологии.
Повышение содержания PME при онкологических заболеваниях, на наш взгляд, можно объяснить развитием неопластических процессов,
сопровождающихся резким усилением синтеза фосфолипидных мембран. Данные изменения напоминали таковые при циррозе печени, однако носили более выраженный характер.

|
|
222 |
А |
Б |
В |
Г |
Воксель № 26 |
Рисунок 58. Больной Ф., 75 лет. Первичный рак печени – гепатоцеллюлярная карцинома квадратной доли (А – T2 Haste; Б – T1 Flash; В – карта распределения соотношения PME/PDE; Г – МР-спектр вокселя № 26, расположение которого отмечено синим прямоугольником на топограммах в правой половине рисунка). Образование (стрелки) характеризуется неправильной формой, нечеткими контурами, изо-гиперинтенсивным сигналом на Т2 ВИ и изо-
гипоинтенсивным (с участками гиперинтенсивного) на Т1 ВИ. Содержание PME в
опухоли и соотношение PME/PDE повышено
Следует отметить, что нередко повышение содержания фосфомоноэфиров определялось не только непосредственно в самом опухолевом узле, но и практически во всей ткани печени (хотя и менее выраженное, чем в основном очаге). Вероятно, данные изменения метаболизма связаны с тем, что при подобных заболеваниях происходит комплексная перестройка процессов энергетического
223
обмена. Одним из основных проявлений данной перестройки является распад белков и ускорение расходования глюкозы. В ответ на данные изменения организм отвечает усилением процессов глюконеогенеза (прежде всего в печени), что сопровождается увеличением содержания соответствующих промежуточных продуктов, таких как глюкозо-6-фосфат и т.п., которые участвуют в создании пика
PME на фосфорном МР-спектре.
Таким образом, проведенное нами исследование показало наличие ряда достоверно различающихся параметров биохимического состава очаговых поражений печени. МР-спектроскопия позволяет неинвазивно выявить эти изменения, а последующий статистический анализ их трактовать. Полученные в таком случае данные несут принципиально новые сведения по отношению к обычному томографическому сканированию, а потому представляют большой интерес и могут дать ценную дополнительную диагностическую информацию, в
том числе с точки зрения проведения дифференциальной диагностики обсуждаемых нозологических форм.
Однако в ходе работы мы столкнулись с рядом факторов, существенно осложнявших проведение фосфорной спектроскопии. Так, следует отметить, что сам характер очагового поражения требовал дополнительных усилий по локализации пациента и катушки, так как в этих случаях необходимо было добиться совпадения не только изоцентра магнита и зоны максимальной чувствительности катушки, но и области самого изучаемого очага. Подобные условия не всегда были достижимы. В нескольких случаях опухолевые узлы были множественными или располагались достаточно глубоко от поверхности тела, что при использовании поверхностной радиочастотной катушки оказывалось неприемлемым (слишком низкое соотношение сигнал/шум). Не удалось качественно провести обследование больных с образованиями, расположенными слишком поверхностно, так как сигнал от мышц передней брюшной стенки и диафрагмы критически искажал МР-спектр. Слишком мелкий размер патологических очагов, а иногда и их структура (кисты, гемангиомы) в ряде
224
случаев оказались непреодолимым препятствием, так как возможности пространственной локализации метода имеют свои ограничения.
Подводя итог вышесказанному, следует отметить, что изученная нами методика МР-спектроскопического обследования позволяет неинвазивно и прижизненно получить ценную дополнительную информацию о биохимических процессах, происходящих в печени на клеточном уровне. Эти данные имеют большое значение, в том числе для проведения дифференциальной диагностики очаговых поражений печени. Кроме того, они являются во многом операторонезависимыми, а потому обладают дополнительной ценностью. Однако существенные ограничения, не решенные на современном этапе технического развития аппаратной базы (низкое пространственное разрешение и соотношение сигнал/шум, ограниченная зона чувствительности поверхностной радиочастотной катушки, невысокое разрешение спектров, длительное время сканирования,
подвижность исследуемых структур и т.д.), серьезно ограничивают возможности практического применения фосфорной МР-спектроскопии в диагностике данной патологии.
225
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ И ЗАКЛЮЧЕНИЕ
Диагностика очаговых поражений печени является сложной и актуальной проблемой современной медицины. Это связано как с высокой распространенностью данной патологии, так и с отсутствием в настоящее время
«идеального» диагностического метода, позволяющего в ранние сроки неинвазивно выявить патологическое образование, дать всестороннюю характеристику (в том числе морфологическую), оценить распространенность и стадию процесса, а также определиться с прогнозом.
Методы лучевой диагностики занимают особое место в алгоритме обследования подобных больных, во многом служа основой постановки окончательного диагноза. Однако эффективность их применения зависит от целого ряда параметров, таких как характер патологии, возможности применяемого оборудования, состояние пациента, наличие определенных противопоказаний к процедуре и др.
За последние годы МРТ стала одним из ведущих методов диагностики заболеваний гепатобилиарной области, в значительной степени сместив рентгеновскую КТ. Неинвазивность и высокая тканевая контрастность предопределили данный процесс. Совершенствование программной и аппаратной базы, появление новых импульсных последовательностей и методик МР-
исследования, таких как МР-диффузия и МР-спектроскопия, а также ДКУ, в том числе с применением специфических контрастных препаратов, дали мощный импульс развитию метода, позволив заговорить не только о морфологической характеристике выявленного очага в печени, но и о функциональном состоянии гепатоцитов и органа в целом.
Вместе с тем следует признать, что устоявшегося мнения медицинского сообщества в отношении информативности применения этих методик пока нет.
Сохраняются вопросы технического и методологического характера к особенностям их выполнения. Частота упоминания в литературе весьма разнородна. Выводы различных исследовательских групп нередко расходятся.
226
Подавляющее большинство публикаций базируется на небольшом клиническом материале и не ставит перед собой задач комплексного подхода к решению рассматриваемых проблем.
Для изучения возможностей современных методик МРТ в выявлении и дифференциальной диагностике очаговых поражений печени, а также обоснования концепции комплексного МР-обследования подобных больных нами были обследованы 323 человека. В это число вошли 256 пациентов с теми или иными очаговыми образованиями печени, 30 условно здоровых добровольцев контрольной группы, а также 37 больных, которым была выполнена МР-
спектроскопия, однако очаговый характер поражения не подтвердился.
Углубленному качественному и количественному анализу были подвергнуты результаты сканирования 597 очаговых поражений органа.
Верификация выявленных изменений базировалась на результатах морфологических исследований, типичных клинико-лучевых симптомах и совокупности данных анамнеза, инструментальных и лабораторных тестов, а
также длительном динамическом наблюдении.
Всем пациентам было выполнено комплексное МР-исследование в том или ином объеме, зависящем от ряда факторов: состояния больного, его способности четко выполнять команды, наличия спонтанной двигательной активности,
локализации и распространенности патологических изменений, планируемого лечения, функционального состояния печени и признаков хронической почечной недостаточности, явлений портальной гипертензии и др.
Комплексное МР-исследование включало в себя выполнение традиционной МРТ живота, многофазного сканирования с применением ДКУ (в том числе с гепатотропным контрастным препаратом), получение ДВИ, а также проведение МР-спектроскопии по фосфору. Сканирование осуществляли на высокопольных МР-томографах Magnetom Symphony и Magnetom Sonata (напряженность магнитного поля 1,5 Тл). Всем пациентам рекомендовали воздержаться от приема пищи как минимум в течение четырех часов до исследования.
227
Применение традиционной МРТ предполагало получение Т1 и Т2 ВИ как с жироподавлением, так и без него, как минимум в трех взаимно перпендикулярных плоскостях, с использованием импульсных последовательностей Flash, Haste,
Trufi, Vibe а также бесконтрастной МРХПГ по двум методикам: толстого блока и тонких срезов (обе на задержке дыхания).
Контрастный препарат вводили внутривенно, преимущественно мануально со скоростью 1,5-2,5 мл/с. Постконтрастные томограммы получали на 20-25-й с,
60-70-й с, 120-180-й с и 7-10-й мин. после инъекции (артериальная, портальная-
венозная, равновесная и отсроченная фаза, соответственно). При использовании гепатотропного агента исследование на первом этапе полностью повторяло описанные выше действия, однако дополнительно предполагало сканирование в гепатобилиарные фазы (в нашей работе: 20, 60 и 90-я мин. после инъекции).
Для получения ДВИ применяли две импульсные последовательности со значениями фактора взвешенности b = 50, 300, 800 с/мм² и 300, 1200, 1500 с/мм²,
соответственно. Полученные данные обрабатывали с построением карт ИКД
(ADC-map). Результаты оценивали как качественно, так и количественно.
С целью оценки эффективности каждой из примененных импульсных последовательностей, а также поиска новых подходов в обработке полученных данных и дифференциальной диагностике очаговых поражений печени нами был проведен количественный анализ изменения интенсивности МР-сигнала в образованиях печени, других паренхиматозных органах и крупных сосудах живота, построены дискриминантные модели дифференциальной диагностики обсуждаемых нозологических групп.
Мелкие образования (диаметром менее 1 см) количественному анализу не подвергали. Все измерения проводили в пределах одного аксиального среза,
изучались как нативные, так и постконтрастные изображения. Для оценки ДКУ в подавляющем большинстве случаев применяли импульсную последовательность
Vibe. Поскольку интенсивность сигнала от каждой конкретной точки тела человека, находящегося в МР-томографе, зависит от множества параметров и часто изменяется нелинейно, исследовать ее абсолютное значение некорректно.
228
Поэтому мы преимущественно пользовались различными коэффициентами,
которые рассчитывали на основании соотношения измеренных величин в нескольких органах, в различных участках печени или в одной и той же области печени в разные фазы сканирования. В заключительный анализ вошли 252
коэффициента для каждого выявленного образования печени.
Магнитно-резонансную спектроскопию печени (1,5 Тл) по фосфору (31P)
осуществляли с применением поверхностной радиочастотной катушки для соответствующего типа исследования сердца и печени (Heart/Liver). Данные собирали с помощью двухмерной последовательности 2D-CSI-FID с применением ядерного эффекта Овергаузера (NOE) и широкополосной WALT-4 развязки, что позволяло снизить зависимость от точности установки частоты серии развязывающих импульсов. Постпроцессорную обработку данных проводили с помощью программного обеспечения производителя (Spectroscopy Application на базе оболочки Syngo 2002B – Siemens). Применяли стандартный протокол анализа информации liver_csi_noe. Оценивали только качественные МР-спектры, на которых отчетливо визуализировались пики следующих фосфорсодержащих метаболитов: фосфодиэфир (PDE), неорганический фосфат (Pi), фосфомоноэфир
(PME), креатинфосфат (PCr) и 3 пика соответствующих фосфатных групп аденозинтрифосфорной кислоты (α-, β-, γ-ATP). В анализе участвовали только относительные величины: доля каждого метаболита в общем количестве фосфорсодержащих соединений (методика вычислений предложена нами) и
соотношения абсолютных интегральных значений пиков между собой.
В ходе проведенной работы была обобщена и систематизирована МР-
семиотика основных очаговых образований печени. Подобные исследования публиковались другими авторами неоднократно, однако в данной работе мы не только дополнили представленные в литературе сведения, но и подтвердили выявленные закономерности при количественном анализе изменений интенсивности МР-сигнала, оценили эффективность различных методик,
построив соответствующие дискриминантные математические модели дифференциальной диагностики, сделали заключение о наиболее информативных
229
импульсных последовательностях для выявления конкретных очаговых поражений печени.
При анализе результатов комплексного МР-исследования пациентов с доброкачественными новообразованиями печени были получены следующие данные.
Гемангиомы отчетливо определяли на изображениях любых типов взвешенности. Незначительные затруднения были встречены лишь при размере очага до 1 см и его локализации в поддиафрагмальных отделах печени или в непосредственной близости от желчного пузыря. Наиболее информативны в отношении выявления подобных образований оказались любые Т2 ВИ (T2 Haste, Trufi) и ДВИ.
При традиционном МР-сканировании гемангиомы характеризовались преимущественно округлой или неправильно округлой формой (78%), достаточно четкими контурами (93%), гиперинтенсивным (25%) или изо-гиперинтенсивным
(75%) МР-сигналом на Т2 ВИ и гипоинтенсивным на Т1 ВИ (100%). При сравнении Т2 ВИ с жироподавлением и коротким TE с аналогичными изображениями, полученными при длинном TE, отмечалось сохранение высокой интенсивности сигнала от гемангиом на второй серии изображений на фоне подавления сигнала от остальных тканей. Контуры образований становились более четкими. При ДКУ в сосудистые фазы сканирования большинство узлов
(64,6%) демонстрировали лакунарное постепенное накопление контрастного препарата в направлении от периферии к центру, достигающее своего пика на отсроченных томограммах. Ряд очагов (23,2%) преимущественно небольшого размера однородно усиливался уже в артериальную фазу, однако также демонстрировал стойкое удержание контрастного вещества (более 10 минут). На ДВИ гемангиомы сохраняли высокую интенсивность сигнала при факторе взвешенности 800 с/мм² и более. Среднее значение ИКД для гемангиом составило
(158,2±44,3)· 10-5 мм²/с.
Очаговая узловая гиперплазия (ФНГ) плохо визуализировалась или вообще не определялась на нативных Т1 и Т2 ВИ, особенно при отсутствии центрального
230
«звездчатого рубца». Данное образование представлено гепатоцитами и имеет гиперваскулярное строение, поэтому ключевыми последовательностями для его выявления, на наш взгляд, следует признать прежде всего артериальную фазу сканирования, а также (в меньшей степени) гепатобилиарную фазу и ДВИ с фактором взвешенности 50-300 с/мм².
При традиционном МРТ ФНГ характеризовались изоинтенсивным (38,7%)
или незначительно повышенным (61,3%) МР-сигналом на Т2 ВИ. На Т1 ВИ очаги не определялись (35,5%) или были изо-гипоинтенсивными. Форма образований была преимущественно округлой с дольчатыми контурами (72%), границы очагов на нативных томограммах нечеткими. Нередко (45,2%) присутствовал центральный «звездчатый рубец», значительно упрощающий проведение дифференциальной диагностики. При ДКУ все узлы демонстрировали раннее и достаточно интенсивное накопление препарата с пиком в артериальную или
(реже) венозную фазу сканирования, за которым следовало быстрое вымывание контрастного вещества с выравниванием интенсивности сигнала в очаге и окружающей его паренхиме печени. Центральный «рубец» накапливал контрастный препарат на отсроченных томограммах (35,5%) или не усиливался вовсе. В гепатобилиарную фазу все ФНГ с разной интенсивностью контрастное вещество накапливали. На ДВИ ФНГ сохраняли незначительную гиперинтенсивность при факторе взвешенности 800 с/мм². Среднее значение ИКД для них составило (83,4±33,5)· 10-5 мм²/с.
В группе пациентов с доброкачественными опухолями печени нами была выделена подгруппа лиц с редко встречающимися новообразованиями органа.
Приведены клинические наблюдения с описанием МР-семиотики и результатов комплексного МР-обследования пациентов с гепатоцеллюлярной аденомой,
ангиомиолипомой и цистаденомой печени. Применение методик МРТ позволило уверено визуализировать области поражения, дать их детальную характеристику,
а в ряде случаев со значительной долей вероятности высказаться о природе выявленных изменений.
При анализе результатов комплексного МР-исследования пациентов с
