
Activators Transcription – сигналы трансдукции и активаторы транскрипции). JAK-киназа фосфорилирует эти белки. Фосфорилированные STAT-белки перемещаются в ядро, где связываются со специфическими участками ДНК и активируют транскрипцию. Усиление синтеза специфических белков (ферментов) лежит в основе изменения метаболизма клеткок-мишеней и биологического эффекта гормона.
Б. Рецепторы, сопряженные с G-белками (7ТМС-рецепторы).
Эти рецепторы связаны с двумя наиболее известными механизмами образования вторичных посредников – аденилатциклазным и Са2+/фосфатидилинозитоловым.
1.13. Аденилатциклазный механизм
1. Поверхностные рецепторы. Гормон связывается с рецептором на поверхности клеточной мембраны.
Ткани имеют несколько типов поверхностных белковых рецепторов, каждый из которых может быть связан с ферментом аденила т- циклаза (например, α2 и β-адренорецепторы катехоламинов, V2- рецепторы вазопрессина). Эти рецепторы имеют однотипное строение и представлены одной полипептидной цепью размером от 400 до 1000 аминокислотных остатков, которая семь раз пересекает мембрану. Учитывая последнюю особенность строения, эти рецепторы иногда обозначают как 7-ТМС-рецепторы, то есть рецепторы, имеющие семь трансмембранных сегментов. Внеклеточный гормоносвязывающий домен рецептора взаимодействует с гормоном, а внутриклеточный домен взаимодействует со специфическими мембранными G-белками.
Аденилатциклазный механизм
Гормон
Рецептор |
|
G-белок |
|
|
Аденилат- |
|
|||||
|
|
|
|
|
|
циклаза |
|
||||
фосфодиэстераза |
|||||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
АМФ |
|
цАМФ |
|
|
АТФ |
||||||
|
|
|
|||||||||
Активация протеинкиназы А
Фосфорилирование белков-ферментов
Изменение метаболизма → Биологический эффект
381
2. ГТФ-зависимые регуляторные белки (G-белки).
G-белки – это тримерные структуры, содержащие α, β и γ- субъединицы, кодируемые разными генами. Различия в структуре и функции G-белков обусловлены в основном гетерогенностью α- субъединицы.
Основываясь на гомологии первичной структуры α-субъединиц G-белки были классифицированы на 4 больших класса: Gs, Gi, Gq и G12. Каждый класс содержит разные α-субъединицы. G-белки, обозначенные так из-за способности связывать молекулы ГТФ или ГДФ, являются связующим звеном между рецептором и аденилатциклазой.
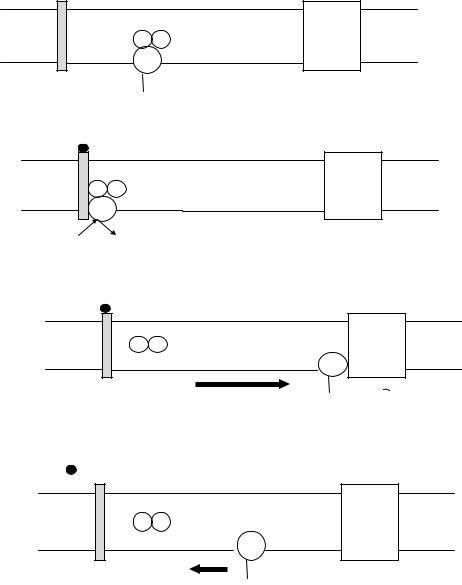
Активация аденилатциклазы
А. Исходное состояние.
β γ |
АЦ |
α |
|
R
ГДФ
Б. Связывание G-белка с активированным рецептором.
β γ |
АЦ |
α |
|
ГТФ ГДФ
В. Активация аденилатциклазы.
β γ |
АЦ |
α
ГТФ  АТФ цАМФ
АТФ цАМФ
Г. Дезактивация аденилатциклазы.
β γ |
АЦ |
α
ГДФ
382

Д. Исходное состояние.
β γ |
АЦ |
α |
|
ГДФ
В неактивной форме α-субъединица G-белков связана с молекулой ГДФ. Связывание гормона с рецептором вызывает обмен молекулы ГДФ на ГТФ, после чего тримерный G-белок диссоциирует на α- субъединицу и βγ-димер. ГТФ-связанная форма α-субъединицы движется от рецептора к аденилатциклазе, которая активируется или ингибируется, что зависит от типа G-белка: Gs – активирует аденилатциклазу, а Gi – ингибирует ее.
Действие комплекса α-субъединица-ГТФ на аденилатциклазу короткое, так как молекула ГТФ быстро гидролизуется до ГДФ за счет внутренней ГТФ-азной активности α-субъединицы; затем α- субъединица и βγ-димер реассоциируются в исходное состояние и G- белок вновь готов к активации.
3. Фермент аденилатциклаза. Этот мембрановстроенный фермент превращает АТФ во вторичный посредник – циклический 3′,5′- АМФ, или цАМФ. Одна молекула аденилатциклазы может синтезировать несколько сотен молекул цАМФ, то есть на данном этапе происходит усиление, или амплификация (от лат. amplification - усиление, расширение), входного сигнала.
5'
|
O |
|
ÑH2 |
O |
Аденин |
||||||
|
|
||||||||||
HO |
|
P O |
|
3' |
|
|
|
||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||
|
3′,5′-циклический АМФ |
||||||||||
|
|
|
|
||||||||
4.Протеинкиназы. Следующий этап аденилатциклазной системы
–это активация цАМФ-зависимых протеинкиназ (протеинкиназ А). цАМФ активирует эти тетрамерные белки посредством связывания с двумя регуляторными субъединицами, что сопровождается высвобождением двух каталитических субъединиц.
Эти каталитические субьединицы катализируют фосфорилирование специфических, как цитозольных, так и ядерных белков (в том числе и ферментов), изменяя их активность. Фосфорилированные
383
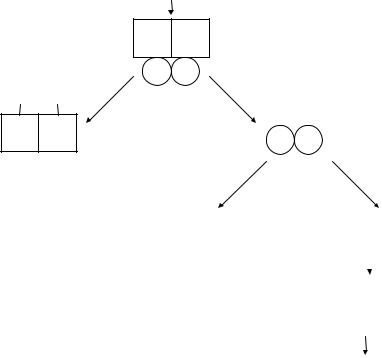
ядерные ген-регуляторные белки связываются с промоторной областью ДНК, что ведет к активации транскрипции специфических генов и синтезу новых молекул белков (ферментов). Изменение активности белков (ферментов) и повышение синтеза специфических белков (ферментов) приводит к изменению клеточного метаболизма, что и лежит в основе биологического ответа клетки на воздействие гормона.
Какой ключевой фермент метаболизма будет фосфорилирован зависит от начального информационного сигнала. Например, фосфорилирование протеинкиназой А фермента киназы фосфорилазы в скелетных мышцах, приводящее к усилению распада гликогена, происхо-
дит при связывании адреналина с β2-адренорецепторами этих клеток. Одновременно протеинкиназа А фосфорилирует также гликогенсинтазу, вызывая ингибирование этого фермента.
Активация протеинкиназы А
цАМФ
R R
Протеинкиназа А
СС
цАМФ цАМФ
R R |
С С |
фосфорилирование проникновение цитозольных в ядро белков 
фосфорилирование ген-регуляторных белков
активация
транскрипции
На этом этапе также происходит усиление входного сигнала, так как одна молекула протеинкиназы может фосфорилировать несколько молекул специфических белков.
Снятие гормонального сигнала
5. Дефосфорилирование белков. Фосфатные группы могут быть удалены из белков специальными ферментами – протеин-фосфатазами.
384
6. Гидролиз цАМФ. цАМФ быстро гидролизуется до 5′-АМФ ферментом фосфодиэстеразой. 5′-АМФ не является внутриклеточной сигнальной молекулой. [Замечание: фосфодиэстераза ингибируется производными метилксантинов – теофиллином и кофеином, что лежит в основе фармакологического действия этих лекарственных препаратов].
Таким образом, эффект гормона, обусловленный повышением уровня цАМФ, быстро прекращается, если рецептор освобождается от гормона.
1.14. Холерный токсин и аденилатциклазный механизм
Холера – особо опасное инфекционное заболевание, которое характеризуется неукротимой диареей и быстрым (в течение нескольких часов) развитием угрожающей жизни дегидратации.
Слизистая оболочка кишечника, в дополнение к способности всасывать переваренные компоненты пищи, секретирует электролиты и воду в просвет кишечника. Секреция происходит в криптах, а процессы всасывания в ворсинках слизистой оболочки кишечника. Хло- рид-ион – первичный ион секреции. Он движется через специальные каналы, активность которых регулируется концентрацией цАМФ. Ион натрия пассивно следует за ионом хлора. Вода перемещается, чтобы поддержать изоосмолярность.
Холерный токсин вызывает диарею посредством резкой стимуляции аденилатциклазы клеток крипт слизистой оболочки кишечника. Это ведет к накоплению цАМФ, что активирует секреторные хлоридканалы. Секреция кишечного сока увеличивается в 10 раз, что приводит к развитию диареи с последующей дегидратацией организма.
В настоящее время расшифрован молекулярный механизм активации аденилатциклазы холерным токсином. Холерный токсин – белок (ММ 87 кДа) сложного строения – проникает в клетку через взаимодействие с мембранным ганглиозидом GM1. Попав в клетку, токсин к а- тализирует АДФ-рибозилирование ГТФ-связывающего белка (G-белка) в результате чего белок стабилизируется в виде комплекса с ГТФ. Другими словами, G-белок теряет ГТФ-азную активность. Это приводит к постоянной активации аденилатциклазы (эффект “постоянно нажатой кнопки звонка”).
Реакция, катализируемая холерным токсином
G-белок + НАД+ → G-белок-рибоза- Р – Р -рибоза-аденин + никотинамид
385
1.15. Са2+/фосфатидилинозитоловый механизм
Многие рецепторы реагируют на гормоны через активацию мембраносвязанной фосфолипазы С. Связующим звеном между рецептором и фосфолипазой С служат Gq-белки.
Ca2+/фосфатидилинозитоловая система
Гормон
|
|
|
|
|
Фосфо- |
|
|
|
|
Рецептор |
G-белок |
|
|
||||||
|
|
|
|
|
липаза С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ФИ-4,5-Ф2 |
|
|
||
С20:4 |
|
ДАГ |
ИФ3 |
|
|
||||
Простагландины |
Протеин- |
↑ [Са2+] |
|
|
|||||
|
|
|
киназа С |
|
+КМ |
|
Активация |
||
|
|
|
|
|
|
|
|
||
|
|
Фосфорилирование КМ-Са2 |
|
протеинкиназ |
|||||
|
|
|
|||||||
|
|
|
|
белков |
|
Фосфорилирование |
|||
|
|
|
|
|
|||||
|
|
Изменение |
|
||||||
|
|
метаболизма |
|
|
белков |
||||
Активированная фосфолипаза С расщепляет мембраносвязанный фосфатидилинозитол-4,5-бисфосфат (ФИФ2), высвобождая два фрагмента – инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ). Эти молекулы являются вторичными посредниками.
Образование инозитолтрифосфата и диацилглицерола
CH2 O R1
CH |
O |
R |
2 |
OH |
|
Фосфолипаза С OH |
P |
|
CH2 |
|
O R1 |
|
2 |
|
|
P |
P |
|
|
|
|||||
CH2 |
O |
|
P |
|
|
|
|
|
|
|||
|
OH |
|
5OH |
|
+ CH2 |
O |
R2 |
|||||
|
|
|
|
|
1 |
|
P |
|||||
|
|
|
|
|
P |
|
|
|
CH2 |
OH |
||
|
|
|
|
OH |
|
|
OH |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
ФИФ2 |
|
|
ИФ3 |
|
|
ДАГ |
||
1. Инозитол-1,4,5-трифосфат. Это производное инозитола связывается с рецепторами на эндоплазматическом ретикулуме, вызывая быстрое высвобождение Са2+ из внутриклеточных депо в цитозоль. Ионы Са2+ связываются с белком кальмодулином; образованный ком-
386

плекс Са2+/кальмодулин вызывает широкий круг биологических эффектов. Инозитолтрифосфат – короткоживущий химический сигнал, так как быстро дефосфорилируется до инозитол-1-фосфата и инозитола. Инозитол вновь используется для ресинтеза фосфатидилинозитол- 4,5-бисфосфата.
2. Диацилглицерол. Этот второй продукт активирует мембраносвязанную протеинкиназу С – фермент, который фосфорилирует различные белки-мишени. Диацилглицерол содержит во втором положении остаток арахидоновой кислоты. Высвобождающаяся под действием фосфолипазы А2 свободная арахидоновая кислота является исходным материалом для синтеза биологически активных соединений –
простагландинов.
3. Кальмодулин и Са2+.
а. Ионы кальция присутствуют в клетке в концентрации 10–7 М, и многие внутриклеточные процессы реагируют на изменение концентрации Са2+ от 10–7 до 10–6 М. Это ярко контрастирует с концентрацией внеклеточного Са2+, которая в 10.000 раз выше, и составляет пр имерно
2,5×10–3 М.
б. Кальмодулин (КМ). Почти все внутриклеточные эффекты Са2+ опосредованы семейством кальций-связывающих белков, в котором насчитывается около 100 представителей. Кальмодулин – наиболее распространенный из этих белков и присутствует во всех клетках.
в. Комплекс Са2+-кальмодулин и ферменты. При увеличении концентрации ионов кальция в цитозоле до 10–6 М происходит связывание четырех молекул ионов кальция с кальмодулином. Это вызывает конформационные изменения, которые позволяют Са2+-КМ-комплексу связать и активировать молекулы белков, чаще ферментов, которые неактивны в отсутствие Са2+-КМ-комплекса. Перечень Са2+-КМ- регулируемых ферментов обширен и включает различные кальмоду- лин-зависимые киназы, аденилатциклазу, фосфодиэстеразу, фосфолипазу А2 и др.
1.16. цГМФ и гуанилатциклазный механизм
По многим аспектам цГМФ сигнальная система аналогична цАМФ-пути, описанному выше. Во-первых, в некоторых тканях цГМФ синтезируется из ГТФ посредством мембраносвязанной гуанилатциклазы. Эта реакция аналогична образованию цАМФ при активации аденилатциклазы. Во-вторых, цГМФ может активировать цГМФзависимую протеинкиназу (протеинкиназу G). Действие цГМФ обрывается фосфодиэстеразой, гидролизующей цГМФ до неактивного ГМФ. Однако имеются и принципиальные различия: 1) мембрансвя-
занная гуанилатциклаза отличается от аденилатциклазы тем, что
387

этот фермент является интегральной частью рецептора и, следова-
тельно, структурно сходен с тирозин-специфической протеинкиназой; 2) многие ткани содержат и цитозольную форму гуанилатциклазы, которая не сопряжена с мембранным рецептором; 3) в противоположность цАМФ, который воздействует на широкий круг процессов,
цГМФ действует как узкоспециализированный мессенджер, вовлечен-
ный в процессы расслабления гладких мышц, агрегации тромбоцитов и систему фоторецепции.
1.17. Монооксид азота – специализированная сигнальная система
Открытие монооксида азота (NO) как биологического регулятора стало началом развития нового направления в регуляции клеточных функций. Первоначально открытый в начале 80-х годов Furchgott и Zavadski эндотелий-высвобождаемый фактор релаксации, определяющий уровень тонического напряжения гладких мышц сосудов, был затем идентифицирован как оксид азота. Позже установлено, что монооксид азота действует как нейромедиатор в головном мозге, предотвращает агрегацию тромбоцитов и играет важную роль в функции макрофагов. Монооксид азота представляет собой газ, который может существовать в виде относительно стабильного, нейтрально заряженного радикала (NO•) с липофильными свойствами. В клетках монооксид азота имеет очень короткий период полужизни. Он существует 6-
10секунд, затем превращается в нитриты и нитраты.
1.Синтез монооксида азота. NO синтезируется из аргинина при
участии НАДФН и О2.
Синтез монооксида азота
NH2-C-NH-(CH2)3-CH-COOH + O2 |
NH2-C-NH-(CH2)3-CH-COOH + NO• |
||
|
|
|
|
NH2 |
NH2 |
O |
NH2 |
|
L-Аргинин |
L-Цитруллин |
|
Продуктом реакции, кроме монооксида азота, является цитруллин. Реакция катализируется ферментом NO-синтазой. Имеется две изоформы этого фермента. Конститутивная – Са2+-кальмодулин- зависимая форма NO-синтазы найдена в эндотелии, нервной ткани и тромбоцитах. Индуцибельная – Са2+-независимая форма может быть экспрессирована в гепатоцитах, макрофагах и нейтрофилах. Специфическим индуктором синтеза фермента является интерлейкин-1.
388
2. Сосудорасширяющее действие монооксида азота. Монооксид азота синтезируется в эндотелиальных клетках, диффундирует к гладким мышцам сосудов, где активирует цитозольную гуанилатциклазу.
Сосудорасширяющее действие монооксида азота |
|
|
и атриопептинов. |
Эндотелиоцит → NO |
Атриопептины |
Миоцит |
|
растворимая |
ANF-R |
гуанилатциклаза |
|
ГТФ |
→ цГМФ |
|
↓ |
Расслабление |
|
гладких мышц сосудов |
|
ANF-R – рецептор атриопептинов, обладающий собственной гуанилатциклазной активностью.
В результате увеличивается концентрация цГМФ, что вызывает расслабление гладких мышц сосудов. Отметим, что нитраты (нитроглицерин и нитропруссид) метаболизируются с образованием NO, который и обуславливает их сосудорасширяющее действие.
3. Роль монооксида азота в бактерицидной активности макро-
фагов. В норме в макрофагах активность NO-синтазы низка, но синтез фермента заметно стимулируют бактериальные липополисахариды и γ- интерферон, высвобождаемый в ответ на инфекцию. Активированные макрофаги образуют активную форму кислорода – супероксид анион, который комбинируется с монооксидом азота и образует бактерицидное соединение – пероксинитрит (ONOO–).
4.Роль монооксида азота в патологии. Чрезмерное образование
вклетках монооксида азота и других активных форм азота (ONOO– и
NO2) получило название “нитрозилирующего стресса”, конечным итогом которого может быть некроз/апоптоз клетки. Чрезмерное накопление NO в организме играет ведущую роль в развитии ряда патологических процессов: нарушении тонуса и повреждении сосудов, шока, сахарного диабета и его осложнений, воспалительных и аутоиммунных заболеваний.
389
1.18. Монооксид углерода (СО) – другой эндогенный фактор активации цитозольной гуанилатциклазы
Монооксид углерода (угарный газ) может образовываться в организме из двух источников:
1)распад гема при участии гемоксигеназы (гем → биливердин);
2)НАДФН-зависимое ферментативное перекисное окисление мембранных фосфолипидов.
Активация цитозольной формы гуанилатциклазы монооксидом углерода in vitro и на изолированных клетках имеет сходные с NO эффекты, то есть ингибирование агрегации тромбоцитов и расслабление гладких мышц сосудов. Также как и NO, монооксид углерода выполняет функции нейромедиатора в ЦНС.
Лекция 38
ГОРМОНЫ ГИПОФИЗА И ГИПОТАЛАМУСА.
Гипоталамо-гипофизарные гормоны
Историческая справка.
1887 г. - Минковский высказал предположение о влиянии гипофиза на рост.
1912 г. - Кушинг постулировал существование гормона роста. 1944 г. - Li и Evans получили животный соматотропин в кристал-
лическом виде.
1957 г. - Salmon и Daughaday обнаружили фактор сульфатации, который позднее назвали соматомедином.
1970 г. - Li установил аминокислотную последовательность человеческого соматотропина и синтезировал его.
1979 г. - Goeddel et al. синтезировали соматотропин методом генной инженерии.
1982 г. - Guillemin et al., Rivier et al., Esch et al. выделили сома-
толиберин.
Начало 30-х годов Aschheim и Zondek привели доказательства гонадотропной функции передней доли гипофиза.
1932 г. - Hohlweg и Junkmann доказали зависимость гонадотропной функции гипофиза от гипоталамуса.
Начало 80-х гг. - Schally и Guillemin показали, что гонадолиберин является декапептидом и расшифровали его структуру.
1942 г. -Li, Sauers выделили АКТГ.
390
