
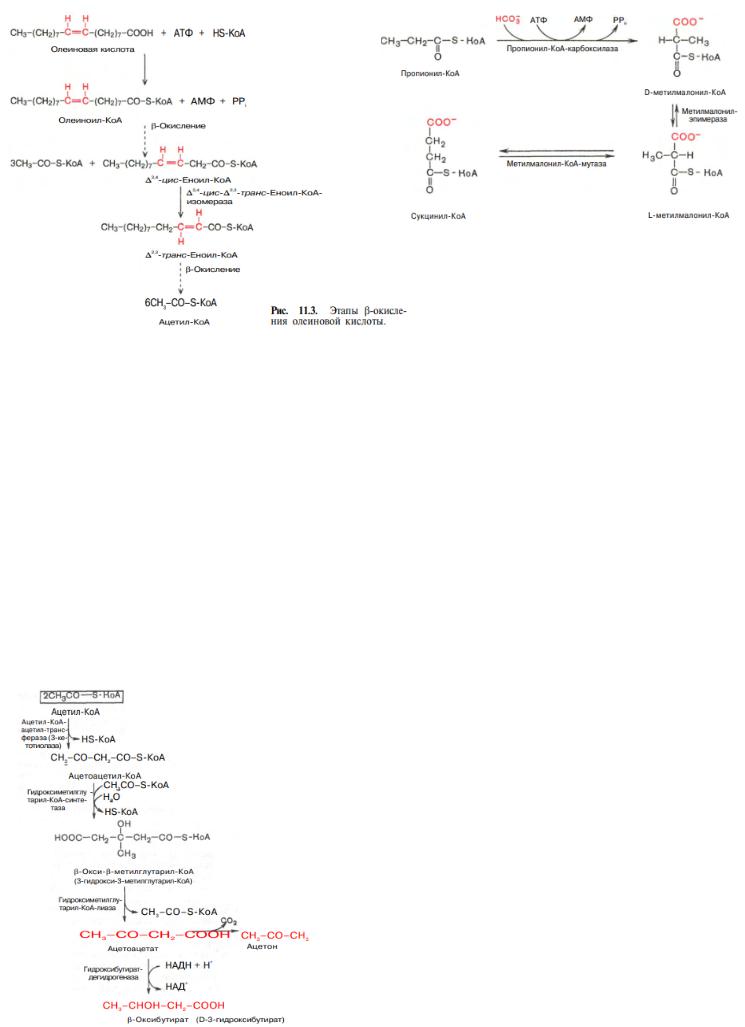
МЕТАБОЛИЗМ КЕТОНОВЫХ ТЕЛ
«Кетоновые (ацетоновые) тела» - ацетоуксусную кислоту (ацетоацетат) СН3СОСН2СООН, β- оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3 В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в
результате спонтанного декарбоксилирования ацетоацетата и не имеет определенного физиологического значения.
Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными.
Во-первых, в обычных условиях промежуточными продуктами β-окисления жирных кислот являются КоА-эфиры этих кислот, например β-оксибутирил-КоА, ацетоацетил-КоА.
Во-вторых, β-оксибутирил-КоА, образующийся в печени при β-окислении жирных кислот, имеет L- конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D- изомер. Именно β-оксибутират D-конфигурации образуется в ходе метаболического пути синтеза β- окси-β-метилглутарил-КоА (3-гидрокси-3-метилглутарил-КоА):
. |
На первом этапе из 2 |
молекул ацетил-КоА образуется |
|
|
ацетоацетил-КоА. Реакция катализируется ферментом |
||
|
ацетил-КоА-ацетилтрансферазой |
(3- |
|
|
кетотиолазой). |
Затем |
ацетоацетил-КоА |
взаимодействует еще с одной молекулой ацетил-КоА. Реакция протекает под влиянием фермента
гидроксиметилглутарил-КоА-синтетазы.
Образовавшийся β-окси-β-метилглутарил-КоА способен под действием гидроксиметилглутарил-КоА-лиазы
расщепляться на ацетоацетат и ацетил-КоА. Ацетоацетат восстанавливается при участии НАД-
зависимой D-3-гидроксибутиратдегидрогеназы, при этом образуется D-β-оксимасляная кислота (D-3- гидроксибутират). Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры.
Второй путь синтеза кетоновых тел. Образовавшийся путем конденсации 2 молекул ацетил-КоА ацетоацетилКоА способен отщеплятьикоэнзим А и превращаться в

ацетоацетат. Этот процесс катализируется ферментом ацетоацетил-КоА-гидролазой
(деацилазой):
Однако второй путь образования ацетоуксусной кислоты (ацетоацетата) не имеет существенного значения, так как активность деацилазы в печени низкая.
«жиры сгорают в пламени углеводов». Ацетил-КоА, образовавшийся при окислении жирных кислот, включается в цикл трикарбоновых кислот в условиях, когда расщепление жиров и углеводов соответствующим образом сбалансировано. Включение ацетил-КоА в цикл Кребса зависит от доступности оксалоацетата для образования цитрата. Однако если расщепление жиров преобладает, судьба ацетил-КоА изменяется. Объясняется это тем, что в отсутствие углеводов или при нарушении их использования концентрация оксалоацетата снижается. При голодании или диабете оксалоацетат расходуется на образование глюкозы и поэтому не может конденсироваться с ацетил-КоА. В таких условиях путь метаболизма ацетил-КоА отклоняется в сторону образования ацетоацетата и D-3-гидроксибутирата, т.е. кетоновых тел.
Вкрови здорового человека кетоновые тела содержатся лишь в очень небольших концентрациях (в сыворотке крови 0,03–0,2 ммоль/л). При патологических состояниях (у лиц с тяжелой формой сахарного диабета, при голодании, а также у животных с экспериментальным острым стрептозотоциновым или аллоксановым диабетом) концентрация кетоновых тел в сыворотке крови увеличивается и может достигать 16–20 ммоль/л.
Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Основным местом образования ацетоацетата и 3-гидроксибутирата служит печень. Из митохондрий печени эти соединения диффундируют в кровь и переносятся к периферическим тканям.
Действительно, сердечная мышца и корковый слой почек предпочтительно используют в качестве «топлива» ацетоацетат, а не глюкозу. В противоположность этому глюкоза является главным «топливом» для мозга у лиц, получающих сбалансированную пищу. При голодании и диабете мозг адаптируется к использованию ацетоацетата. В условиях длительного голодания 75% потребности мозга в «топливе» удовлетворяется за счет ацетоацетата.
Впериферических тканях 3-гидроксибутират (β-оксимасляная кислота) способен окисляться до ацетоацетата, а последний активируется с образованием соответствующего КоА-эфира (ацетоацетил-КоА). Ацетоацетат может быть активирован путем переноса КоА с сукцинил-КоА в реакции, катализируемой специфической КоА-трансферазой. Образовавшийся ацетоацетил-КоА далее расщепляется тиолазой с образованием 2 молекул ацетил-КоА, которые затем включаются в
цикл Кребса:
второй путь активации ацетоацетата – это использование АТФ и HSKoA аналогично тому, как при активации жирных кислот:
БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. В цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
Митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакций β-окисления, осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути.
Внемитохондриальная система биосинтеза de novo жирных кислот (липогенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3 – (в качестве источника СО2 ); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота.
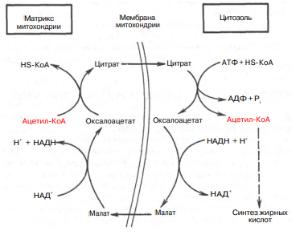
Строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Цитрат стимулирует синтез жирных кислот в цитозоле клетки. Образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетилКоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной
трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитрат-лиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбоксилаттранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:
Существует еще один путь переноса внутримитохондриального ацетил-КоА в цитозоль клетки – с участием карнитина. Карнитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.
Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-карбоксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.
Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный аллостерический центр, т.е. представляет собой полиферментный комплекс


Суммарное уравнение синтеза пальмитиновой кислоты:
Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2 , которая затем отщепляется, суммарное уравнение можно представить в следующем виде:
Последовательность и характер реакций в синтезе жирных кислот, начиная с образования β-кетоацил-АПБ и кончая завершением одного цикла удлинения цепи на два углеродных атома, являются как бы обратными реакциями окисления жирных кислот.
На самом деле пути синтеза и окисления жирных кислот не пересекаются даже частично. По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикислоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пентозофосфатного цикла, частично – в других реакциях, в частности в реакциях:
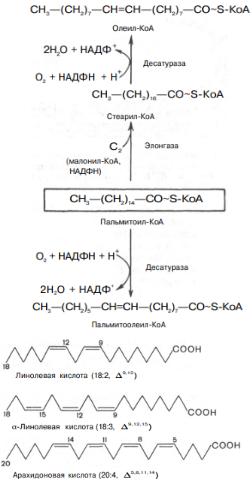
Образование ненасыщенных жирных кислот. Элонгация жирных кислот. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные.
Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот.
Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5 . Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название десатураз.
Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.
НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ
В настоящее время показано, что в микросомах клеток млекопитающих образование двойных связей может происходить только на участке цепи жирной кислоты от 9-го до 1- го углеродных атомов, ибо в микросомах отсутствуют десатуразы, которые могли бы катализировать образование двойных связей в цепи далее 9-го углеродного атома. У животных двойные связи могут образовываться в Δ4 -, Δ5 -, Δ6 - и Δ9 -положении, но не далее 9 -положения, в то время как у растений – в Δ6 -, Δ9 -, Δ12 и Δ15 -положении. Поэтому в организме млекопитающих, в том числе и человека, не могут образовываться, например, из стеариновой кислоты (18:0) линолевая (18:2; 9,12) и линоленовая (18:3; 9,12,15) кислоты. Эти кислоты относятся к категории незаменимых жирных кислот. К незаменимым жирным кислотам обычно относят также арахидоновую кислоту (20:4; 5,8,11,14). У большинства млекопитающих арахидоновая кислота может образовываться из линолевой кислоты. Структуры незаменимых жирных кислот:
Незаменимые жирные кислоты должны поступать в организм с пищей. При длительном их отсутствии в пище у животных наблюдается отставание в росте, развиваются характерные поражения кожи и волосяного покрова. Описаны случаи недостаточности незаменимых жирных кислот и у человека. Так, у детей грудного возраста, получающих искусственное питание с незначительным содержанием жиров, может развиться чешуйчатый дерматит, который поддается лечению препаратом линолевой кислоты.
Нарушения, обусловленные недостатком незаменимых жирных кислот, наблюдаются также у больных, жизнедеятельность которых в течение длительного времени поддерживается только за счет внутривенного питания, почти лишенного жирных кислот. Во избежание этих нарушений необходимо, чтобы на долю незаменимых жирных кислот приходилось не менее 1–2% от общей потребности в калориях. Незаменимые жирные кислоты содержатся в достаточно больших количествах в растительных маслах.
Исследования, проведенные с применением изотопов, показали, что арахидоновая кислота и некоторые другие 20-углеродные (эйкозановые) кислоты, содержащие двойные связи, участвуют в образовании эйкозаноидов.
ЭЙКОЗАНОИДЫ
Эйкозаноиды – обширная группа физиологически и фармакологически активных соединений. К
ним относятся простаноиды (простагландины, простациклины, тромбоксаны) и
лейкотриены. Наиболее активным предшественником эйкозаноидов является входящая в состав фосфолипидов плазматических мембран арахидоновая кислота. Последняя освобождается из фосфолипидного бислоя мембраны при действии фосфолипазы А2. В образовании эйкозаноидов принимают участие также и другие незаменимые жирные кислоты (линолевая и α-линоленовая), но только после элонгации на два углеродных атома и десатурации, т.е. после превращения в 20углеродные тетраеновые кислоты. Поэтому эйкозаноиды можно разделить на 3 группы (в каждую входят простагландины, тромбоксаны и лейкотриены) в зависимости от предшественников: линолеата, арахидоната и линолената.

Пути метаболизма арахидоната (субстрата) различны, причем синтез простаноидов конкурирует за субстрат с синтезом лейкотриенов. Эти два пути называют соответственно циклооксигеназным
и липоксигеназным
Простагландины (ПГ, Pg). По существу ПГ представляют собой 20-углеродные жирные кислоты, содержащие 5-углеродное кольцо и гидрокси- и/или кетогруппы:
Обнаружено шесть первичных природных ПГ, три из них серии Е (ether-soluble) и три – серии F (phosphate-soluble). ПГ серии Е содержат в положении 9 кетогруппу, а ПГ серии F – гидроксигруппу.
Имеется также несколько вторичных ПГ, представляющих собой продукты энзиматического превращения первичных.
ПГ проявляют свое действие в чрезвычайно низких концентрациях (1– 10 нг/мл). Будучи введенными в организм, они вызывают сокращение гладкой мускулатуры, регулируют приток крови к определенному органу, оказывают переменчивое влияние на кровяное давление, контролируют транспорт ионов через мембраны и т.д.
В целом ПГ, не являясь гормонами, модулируют действие последних. Они преимущественно влияют на физиологические функции тех клеток, в которых синтезируются. Характер воздействия ПГ зависит от типа клетки, и этим ПГ отличаются от гормонов с их однозначным эффектом.
ПГ могут использоваться как терапевтическое средство для предотвращения оплодотворения, стимулирования нормальных родов, прерывания беременности, предупреждения развития или обезболивания язвы желудка, лечения воспалительных процессов и регуляции кровяного давления, а также для снятия приступов астмы и др.
Среди продуктов эндопероксидации вторичных ПГ необходимо отметить тромбоксаны и простациклины. Тромбоксаны образуются в тромбоцитах и после выхода в кровяное русло вызывают сужение кровеносных сосудов и агрегацию тромбоцитов.
Простациклины образуются в стенках кровеносных сосудов и являются сильными ингибиторами агрегации тромбоцитов. Таким образом, тромбоксаны и простациклины выступают как антагонисты. Поэтому соотношение тромбоксана и простациклина во многом определяет условия тромбообразования на поверхности эндотелия сосудов.
Лейкотриены. Это производные 20-углеродных полиненасыщенных (эйкозановых) кислот. Название: «лейкоциты» (впервые эти соединения были обнаружены в лейкоцитах) и «триены» (у всех представителей этого класса соединений из четырех ненасыщенных связей три являются конъюгированными). Лейкотриены синтезируются из эйкозановых кислот в лейкоцитах, клетках мастоцитомы, тромбоцитах и макрофагах по липоксигеназному пути в ответ на иммунологические и неиммунологические стимулы.

Лейкотриены прежде всего рассматриваются как медиаторы воспалительных реакций; они вызывают сокращение мышечной ткани бронхов в концентрациях, в 100–1000 раз меньших, чем гистамин; способствуют сокращению коронарных сосудов.
БИОСИНТЕЗ ТРИГЛИЦЕРИДОВ *
Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, так как свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются. Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глицерофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3- фосфата в основном связано с процессами гликолиза и гликогенолиза. В процессе гликолитического распада глюкозы образуется дигидроксиацетонфосфат ( Последний в присутствии цитоплазматической
глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:
Если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата. Образовавшийся глицерол-3- фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат): Как отмечалось, ацилирование глицерол-3-фосфата
протекает последовательно, т.е. в 2 этапа. Сначала
глицерол-3-фосфат-ацилтрансфераза
катализирует образование лизофосфатидата (1- ацилглицерол-3-фосфата, затем 1-ацилглицерол-3-
фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3- фосфата) *. Далее фосфатидная кислота гидролизуется
фосфатидат-фосфогидролазой до 1,2-диглицерида
(1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется
диацилглицерол-ацилтрансферазой:

Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. Большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях.
МЕТАБОЛИЗМ ФОСФОЛИПИДОВ
В отличие от триглицеридов и жирных кислот фосфолипиды не являются существенным энергетическим материалом. Фосфолипиды играют важную роль в структуре и функции клеточных мембран, активации мембранных и лизосомальных ферментов, в проведении нервных импульсов, свертывании крови, иммунологических реакциях, процессах клеточной пролиферации и регенерации тканей, в переносе электронов в цепи «дыхательных» ферментов. Особая роль фосфолипидам отводится в формировании липопротеидных комплексов.
Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются в эндоплазматической сети клетки.
Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфингомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов.

Биосинтез фосфатидилэтаноламина. Первоначально этаноламин при участии
соответствующей киназы фосфорилируется с образованием фосфоэтаноламина:
Затем фосфоэтаноламин взаимодействует с ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и пирофосфат (PPi):
В следующей реакции ЦДФ-этаноламин, взаимодействуя с 1,2-диглицеридом, образующимся при дефосфорилировании фосфатидной кислоты, превращается в фосфатидилэтаноламин. Реакция катализируется ферментом
этаноламинфосфотрансферазой:
Биосинтез фосфатидилхолина (лецитина).
предшественником фосфатидилхолина. В результате метальных групп от трех молекул S-аденозилметионина образуется фосфатидилхолин:
Фосфатидилэтаноламин является последовательного переноса трех к аминогруппе остатка этаноламина
Существует еще один путь синтеза фосфатидилхолина в клетках животных. В этом случае, как и при синтезе фосфатидилэтаноламина, используется ЦТФ в качестве переносчика, но уже не фосфоэтаноламина, а фосфохолина. На первом этапе синтеза свободный холин активируется под действием холинкиназы с образованием фосфохолина:
|
Холин + АТФ –> Фосфохолин + АДФ. |
|
Затем фосфохолин реагирует с ЦТФ, образуя |
||
цитидиндифосфатхолин (ЦДФ-холин): |
||
|
Фосфохолин + ЦТФ –> ЦДФ-холин + РРi . |
|
В дальнейшем ЦДФ-холин взаимодействует с 1,2- |
||
диглицеридом, в результате чего образуется |
||
фосфатидилхолин: |
|
|
ЦДФ-холин + 1,2-диглицерид –> Фосфатидилхолин + |
||
|
ЦМФ. |
|
Биосинтез фосфатидилсерина. У млекопитающих фосфатидилсерин0 |
образуется в реакции |
|
обмена этаноламина на серин следующим путем: |
0 |
|
Существует и второй путь образования фосфатидилсерина, который связан0 с предварительным вовлечением фосфатидной кислоты в синтез фосфоглицеридов: 0
0
Затем происходит перенос серина на фосфатидильный остаток с образованием фосфатидилсерина:
ЦДФ-диглицерид + L-серин –> Фосфатидилсерин + ЦМФ.
Таким же путем образуется фосфатидилинозитол.
