
Строениеобменуглеводов |
190 |
|
|
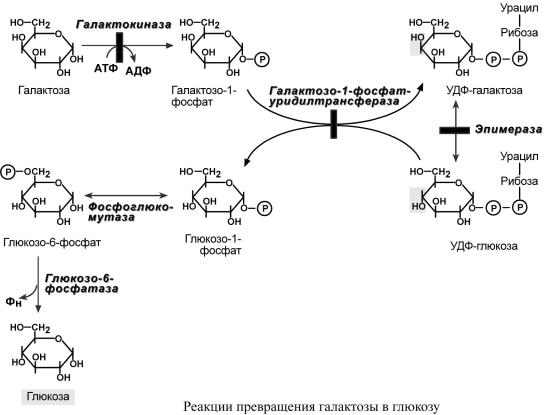
Патогенез. |
Избытокгалактозыпревспиртращается |
галактитол (дульцитол),нака |
п- |
||
ливающийсяхрусталикеосмотпр влесюдачесводу.Изменякиющий |
|
|
етсолевойяс |
о- |
|
став, нарушаетсяконформация |
белков хрусталика,чтоприводиткатмолодомрактево |
|
|
з- |
|
расте.Катарактавозможнадажеуплодовматерей |
,котбольнырые |
галактоземией и упо- |
|||
треблявших молокововремябеременности. |
|
|
|
|
|
|
|
Придефектегалактозо |
-1-фосфат-уридилтрансферазы АТФпостояннорасходуетсяна |
|
|
||||
фосфоргалактозыдефицитлированэнергиие |
|
|
угнетает активность многихферментов |
, |
|||
"токсически" действуя на всеклетки,особеннона |
нейроны,гепа |
тоциты,нефроциты |
.Какр |
е- |
|||
зультат, возможнызадержкапсихомотразвитиятсталостьнекроз,умственнаяо , геп |
|
|
|
|
|
а- |
|
тоципеченитоврроз.Впочкахшечнизбытокгалаееметозытаболитовинг |
|
|
|
|
|
и- |
|
бирует всасывание аминокислот. |
|
|
|
|
|
|
|
Основылечения |
. Исключениеизрационамолокадругихисточникгалактпо озыв |
|
|
|
|
з- |
|
воляетпредотразпатологичесвитиератсимптть.Однахранностьмовинтеллектаих |
|
|
|
|
|
|
|
можетбытьдостигнутатолькопр , позднпервыхнейм2 жизнисяцев,диагнос |
|
|
|
|
|
тике |
|
ивовремяначатомлечении. |
|
|
|
|
|
|
|
|
П Р Е ВФРРАУЩКЕ Н И Е |
Т О З Ы ВГ Л Ю К О З У |
|
|
|||
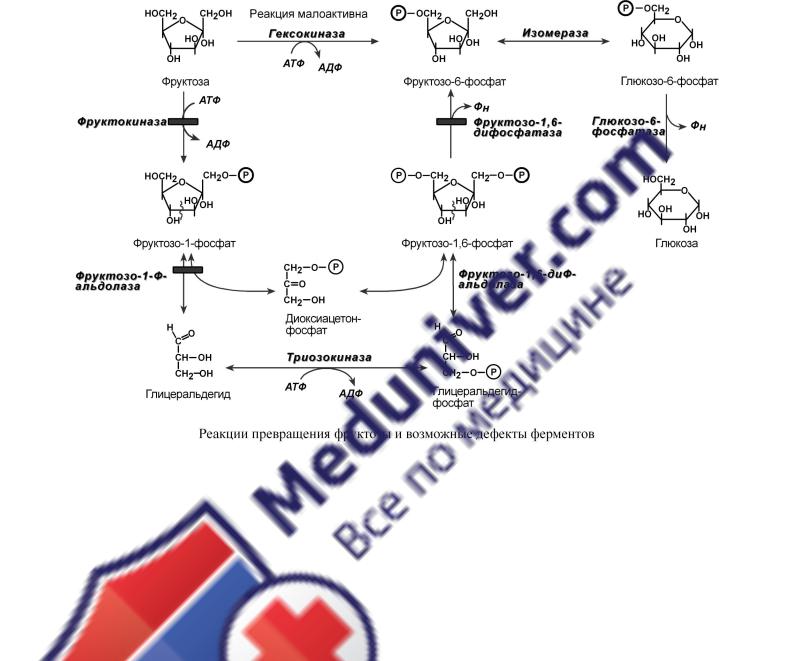
Реакциипереходафруктвглюкозузыстаточнопросты.Сначпроисходитлакт |
|
|
|
|
|
и- |
|
вацияфруктозыпосредствомфосфорилирования |
|
: 6-го атомауглерода |
припомощи |
гексоки- |
|||
назы или 1-го атомауглеродапри |
участии фруктокиназы. Приэтомг |
ексокиназаимеетг |
|
о- |
|||
раздоболеенизкоесродствофруктозе.Фруктозо |
|
-6-фосфатдалее |
|
изомеризуетсяи |
глюкозо- |
||
6-фосфатаза отщепляет ужененуж |
ный фосфат. |
|
|
|
|
|
|
Еслиобразуется |
фруктозо-1-фосфат,тоонприучастии |
альдолазы разделяетсяна |
|||||
глицеральдегдиокси.Д лиеецеральдегидтонфосфатфосфорилируется |
|
|
|
триозоки- |
|||
назой. |
|
|
|
|
|
|
|
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
191 |
|
|
|
У полученных триозофосфатов есть альтернатива: o либо использоваться в гликолизе,
o либо объединяться во фруктозо-1,6-дифосфат, дефосфорилироваться в фруктозо-6- фосфат, изомеризоваться в глюкозо-6-фосфат и далее превращаться в свободную глюкозу.
При первом варианте фруктоза используется в печени как энергетический субстрат или для синтеза жиров. Второй вариант подразумевает получение глюкозо-6-фосфата или глюкозы и их использование в каких-либо целях.
Особенностью мышц является отсутствие фруктокиназы, поэтому фруктоза в них превращается сразу в фруктозо-6-фосфат и поступает в реакции гликолиза или синтеза гликогена.
Особенностью метаболизма фруктозы является то, что фермент фруктокиназа является инсулин-независимым. В результате в печени превращение фруктозы в пировиноградную кислоту и ацетил-SКоА происходит быстрее, чем для глюкозы. Это объясняется "игнорированием" лимитирующей реакции метаболизма глюкозы, катализируемой фосфофруктокиназой. Дальнейший метаболизм ацетил-SКоА в данном случае может привести к избыточному образованию жирных кислот и триацилглицеролов.
НА Р У Ш Е Н И Я ПРЕВРАЩ ЕНИЯ ФРУКТОЗЫ
Эссенциальная фруктозурия
Генетический дефект фруктокиназы приводит к доброкачественной эссенциальной фруктозурии, протекающей безо всяких отрицательных симптомов.
Наследственная фруктозурия
Заболевание формируется вследствие наследственных аутосомно-рецессивных дефектов других ферментов обмена фруктозы.
Строениеобменуглеводов |
|
|
|
|
|
192 |
|
|
|
|
|
||
Дефект фруктозо-1-фосфат альдолазы,котвнормеприсутствуетаяпечени,к |
|
|
|
и- |
||
шечнивеществекорковомпочек, |
прояпослевведениялярационтсямладенцасоков |
снижениеммобилизации |
|
|||
фруктов,соде жащихуктозу |
исахарозу |
. Патогенезсвязансо |
|
|||
гликогена из-заингибглиркофруктозогеванфосфорилазыия |
|
-1-фосфатоми |
ослаблением |
|||
глюконеогенеза,т.к.дефектныйферментспособучаствоватьренкцияхналогично |
|
|
|
|
|
|
фруктозо-1,6-дифосфат альдолазе.Пр оявляетсязаболеваниеснижениемконцентрации |
|
|
|
|
||
фосфатов вкрови,гиперфруктоземией,тяжелойпосле ищевойогликемией. |
|
|
|
Отмечается |
||
вялость,нарушениясознания,почечныйканацидозльцевый. |
|
|
|
|
|
|
Дефект фруктозо-1,6-дифосфатазы проявлясходнопредыдущим,нотся |
|
|
етак |
я- |
||
жело. |
|
|
|
|
|
|
П Р Е ВГРЛАЮВЩКЕОНЗИЫЕ |
Ф Р У К Т О З У |
|
|
|
||
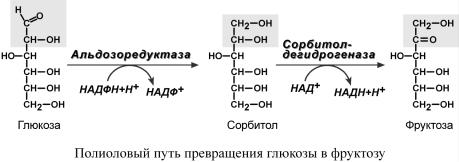
Превращениеглюкозыфруктозупроисходит |
полиоловомпути |
метаболизмагл |
ю- |
|||
козы.Дляобеспеченреакцийэтогопутвклеткахприсутствуетяфермент |
|
|
альдозоредукта- |
|||
за,котораяпревращаетглюкозусорбитол. |
|
Обычно вданнуюреакциюпопадаетнеболее |
|
глюкозами- |
||
1%глюкозы,ионаисподполяьзфруктозыченияетсявпроцессесинтеза |
|
|
|
|
||
нов. |
|
|
|
|
|
|
Отдельноезначениепутьимвс етменныхпузырьках,которыесинтезируютфруктозу |
|
|
|
|
|
|
для семеннойжидкости |
.Сперматозоиды,находящиесязд |
есь,используютфруктозувкач |
|
|
е- |
|
ствеосновногоэнергетичсубстрата,ноприереходевскогоженскиеполовыепутипер |
|
|
|
|
е- |
|
ключаютсянаглюкозу.Счи, использованповышаетаетсяфруктозыстабильность |
|
|
|
|
|
|
предотвпреждевремращазрушениеакрососпт мноеыи |
|
|
я. |
|
|
|
Клизначимостьиеская |
полиолпутипровинсулинявляетсявого |
независимыхтк |
а- |
нях,вкоторыеглюкозапоступает |
неконтролируемо поградиентуконцентрации |
– эндоте- |
|
лий,хрустаглаза,клеткиклубочикпоче,но ков |
, впервуюочередь,нейроны |
. Путь активи- |
|
руетсяпри |
гипергликемиях,когдапотокглюкозывклеткиувеличиваетсяскоростьсинт |
|
е- |
|
за сорбитола резковозрастает. |
|
инозитола, |
||
Наксоплрбитвнейронахпниедсинтезлавляет |
циклическогоспирта |
|||
входящегосоставфосфолипидов |
ииспользуемогопри |
передачегормональногосигнала, |
и |
|
снижаетактивность |
Na+,K+-АТФазы,что нарушапроведениенервногоимпульсат. |
Избыток |
||
вклетке осмотическиактивных |
сорбитолафрудерживаетктозыводу,изменяетформу |
|
|
|
|||
клетокиих |
функциональную активность. |
|
|
|
|
||
Такжеи |
збыточнаяработа |
альдозоредуктазыприводит |
|
расходованию НАДФНвкле |
т- |
||
ках,чтоснижаетактивность |
ряда процессов,например,восстановление |
|
глутатиона вработе |
||||
антиоксистемидантных |
, синтез вазодилататора оксидаазот |
(NO),нейтрализация аммиа- |
|||||
ка вреакциивосстан |
овительногоаминирования |
α-кетоглутарата, |
микросомальное окисле- |
||||
ние. |
|
|
|
|
|
|
|

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
193 |
|
|
|
|
|
|
С У Д Ь Б А И И С Т О Ч Н И К И Г Л Ю К О З Ы В К Л Е Т К Е
Наличие глюкозы в клетке обеспечивается, в первую очередь, проникновением ее из крови. Также почти все клетки имеют запасы гликогена, который используется как внутриклеточный резерв глюкозы. В то же время печеночные клетки и почки обладают способностью синтезировать глюкозу из неуглеводных компонентов (глюконеогенез).
После проникновения в клетку глюкоза способна превращаться по различным направлениям:
o часть глюкозы обязательно используется в энергетическом обмене, она сгорает в реакциях катаболизма для синтеза АТФ,
o при достаточно большом количестве в клетке глюкоза запасается в виде гликогена, к синтезу гликогена способны большинство тканей,
o в гепатоцитах (при высокой концентрации) и в адипоцитах глюкоза перенаправляется на синтез триацилглицеролов и, например, в печени, на синтез холестерола,
o при определенных условиях часть глюкозы идет в реакции пентозофосфатного пути, в котором образуются рибозо-5-фосфат и НАДФН,
o некоторая доля глюкозы используется для синтеза гликозаминов и далее структурных или иных гетерополисахаридов.
ФО С Ф О Р И Л И Р О В А Н И Е -Д Е Ф О С Ф О Р И Л И Р О В А Н И Е
ГЛ Ю К О З Ы
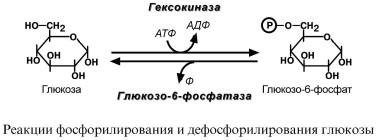
Попав в любую клетку, глюкоза немедленно фосфорилируется ферментом гексокиназой и уже не может выйти из клетки. Поэтому гексокиназа получила название "ловушка для глюкозы". Фосфорилирование глюкозы решает сразу несколько задач:
o фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула отрицательно заряжена и отталкивается от фосфолипидной поверхности мембраны,
o наличие заряженной группы обеспечивает правильную ориентацию молекулы в активном центре фермента,
o уменьшается концентрация свободной (нефосфорилированной) глюкозы, что спо-
собствует диффузии новых молекул из крови.
Строениеобменуглеводов |
194 |
|
|
Дефосфорилирование глюкозыосуществляется |
глюкозо-6-фосфатазой.Этотфермент |
|
|||||||||
естьтольковпечени.Вэпителиичкахканальцевпочекработафермента |
|
|
|
|
тесно связана |
||||||
реабсорбциейглюкозы |
иразныхамино |
- икетокислотсм(Глюконео" |
генез") |
.Вгепатоцитах |
|
||||||
ферментнеобходим, |
т.к. печеньподдерживает |
постконцентрацииянство |
|
глюквкровизы |
|
|
|||||
приголоданиимышечныхнагрузках |
|
. |
|
|
|
|
|
|
|
||
|
|
|
Особенностигексок |
иназы |
печени от другихтк |
|
|||||
Существуютпринципиотличияметглюкоаболильныев змаы |
|
|
|
а- |
|||||||
ней.Этообъясняетрядомпричин,вчастности, я |
|
|
|
наличием втканях различныхизофе |
|
р- |
|||||
ментов гексокиназы. Для печени характерен особый изофермент гексокиназа IV,пол у- |
|||||||||||
чившийсобственназваниеое |
|
– глюкокиназа. Отличиями этогоферментаотгексокиназ |
|
|
|
||||||
другихтканей |
являются: |
|
|
|
|
|
|
|
|
|
|
o |
низкоесродство |
кглюкозе |
(в1000разменьше) |
,чтоведеткзахватуглюкозыпеч |
|
|
|
е- |
|||
ньютолькоприеевысокойконцентрациикровипосле( еды) |
|
|
|
.Инымисловами, |
|
печень |
|||||
не будет использовать глюкозу,еслиеё |
|
концентрация вкрови |
невнорм(ысокальном |
|
|
||||||
диапазоне) |
. |
|
|
|
|
|
|
|
|
|
|
o |
продукт реакции (глюкозо-6-фосфат) неингибирует фермент,втовремякакдр |
|
|
|
у- |
||||||
гихтканяхгексокиназачувсттакомувлияниюительна. |
|
|
|
Этоп зволяетгепатоциту |
|
|
|
||||
единицувременизахватыватьглюкозыбольше,че |
|
|
|
монмосразужеутилизоватьет, |
|
|
|
|
|||
o |
чувствительностьк |
действию инсулина – ферментактивируется |
этимгормоном |
. |
|
||||||
Благодаря таким отличиямгепатоцитможетэффективнозахватыватьглюкпослезу |
|
|
|
|
|
|
|||||
еды,накапливать |
глюкозо-6-фосфат и,неторопясь" ", |
метаболизировать его влюбомнапра |
|
в- |
|||||||
лении – синтезгликогена,пентозофосфатныйпуть,окислдоац тил |
|
|
|
-SКоА , CO2 и H2O, и |
|||||||
синтезлипидов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
М Е Т АГБЛОИЛКИОЗГМЕН А |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
Наибольшиезапасыглимеютсякогв на |
|
|
печени и скелетныхмышцах |
|
,новообще |
|
|||||
гликспосинтгенсобензироваться |
|
почти вовсехтканях.Резервыгликогенаклетках |
|
|
|
|
с- |
||||
пользуютсявзависимостиот |
их функциональныхособенностей. |
7 |
|
|
|
|
|
||||
В мышцах количествогликогена |
снижается обычнотолько |
вовремя |
физической |
||||||||
нагрузки – длительной |
/или напряженной. |
Накопление гликогена здесь отмечаетсявпер |
и- |
||||||||
одвосстановления ,особенно , есливосстановлениесопровождается |
|
приемом богатойуглев |
|
о- |
|||||||
дамипищи. |
И,конечно,количествогликогенамиоцитеснижается |
|
|
|
(к акивовсехдругих |
|
|
||||
клетках) вовремяголодания. |
|
|
|
|
|
|
|
|
|
||
Гликоген печени расщепляприснижконцентрацииглюктсяниивкр,преждевизы |
|
|
|
|
|
|
|||||
всегомеждуприемамипищи.Через12 |
|
|
-18часовголодзапгликоганиясывпечполнениа |
|
|
|
|
о- |
|||
стьюистощаются. |
Накапгликогенвается |
|
в печени только послееды |
,пригипергликемии |
. |
||||||
Этообъясняется |
особенностямиглюк,котораяимееткиназынизкоесродствоглюки зе |
|
|
|
|
|
|
||||
можетработать |
исключительно приеевысокихконцентрациях |
вкрови . |
|
|
|
|
|||||
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
195 |
|
|
|
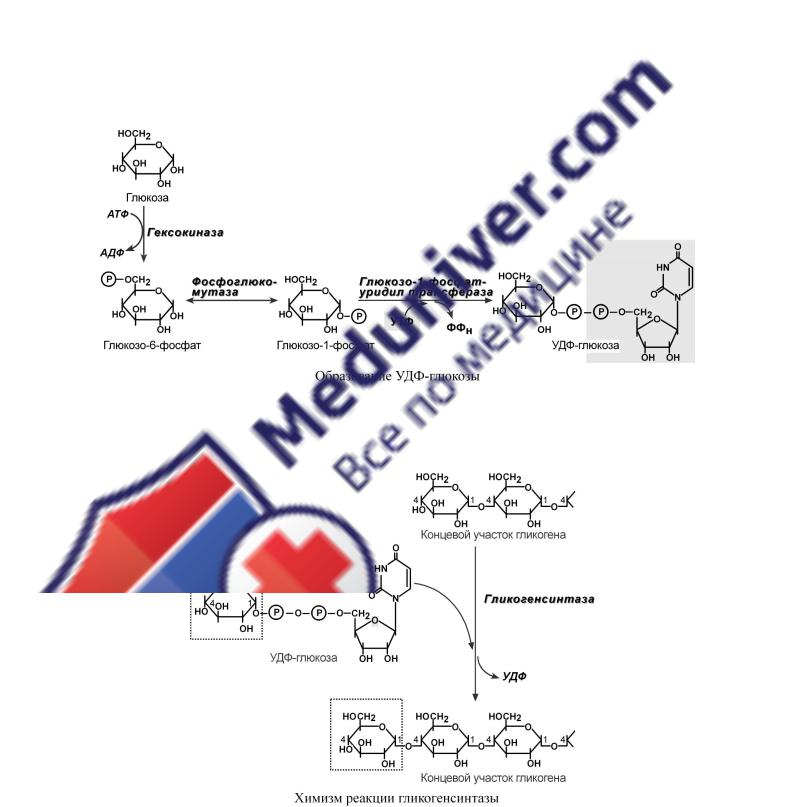
С И Н Т Е З Г Л И К О Г Е Н А
Синтез гликогена начинается с образования глюкозо-6-фосфата под действием глюкокиназы в печени или других гексокиназ в остальных тканях. Как уже говорилось, глюкокиназа обладает низким сродством к глюкозе, и в гепатоцитах глюкоза будет задерживаться только при ее высоких концентрациях.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1.Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат.
2.Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата.
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4-глюкозы на концевом участке гликогена.
Строениеобменуглеводов |
196 |
|
|
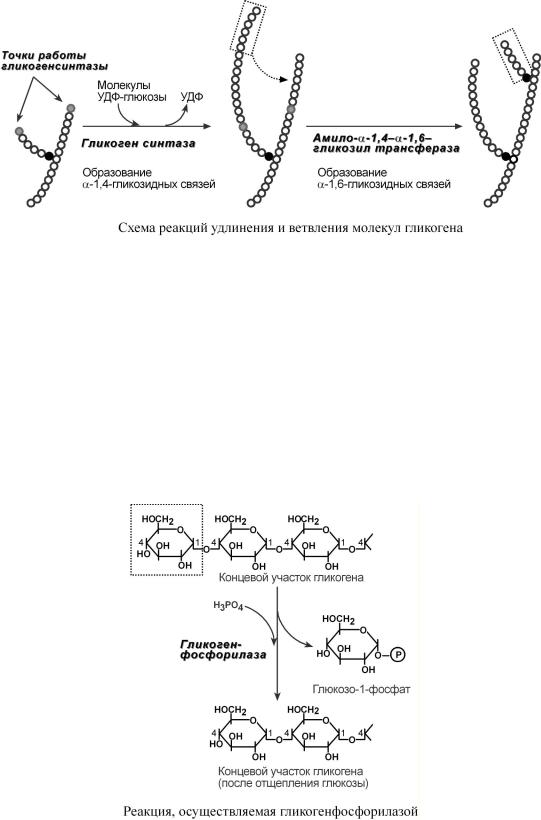
4. Амило-α1,4-α1,6-гликозилтрансфераза, "гликоген-ветвящий" фермент – переносит фрагментсминимальнойдлинойвостатков6 глюкозы на соседнююцепьобразованием α1,6-гликозиднойсвязи.
|
М О Б ИГЛЛИИЗКАОЦГИЕ ЯН А |
|
|
|
|
||
Мобилизациягликогена |
(гликогенолиз)втканях |
активпрнедосируесвоботаткеся |
|
|
д- |
||
нойглюкозывклетке,азначитвкровиголодание( ,мышечнработ)Приэтом. уровеньая |
|
поддерживаеттолько печень,вкотор |
|
|
|
||
глюкозыкрови |
"целенаправленно" |
ой имеетсягл |
ю- |
||||
козо-6-фосфатаза,гидролизующ |
ая фосэфглюкозатныйир |
ы.Образуемая |
приэтом |
свобод- |
|||
наяглюкозавыходитчерезплазмембрануатическуювкровь.Остальоргаиспользные |
|
|
|
|
|
у- |
|
ютгликогентолькодлясобственныхнужд. |
|
Вгликогенолизенепосредственноучаству |
юттрифермента: |
1. Фосфорилазагликоген |
(кофермент пиридоксальфосфат) – расщепляет |
α1,4-гликозидныесвязиобразованиемглюкозо |
-1-фосфата.Ферментрабдтехопортает, |
покадоточкиветвленияα(1 |
-6)останетсяостатка4 глюкозы. |

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
197 |
|
|
|
2. α(1-4)-α(1-4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и "открытая" доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, "деветвящий" фермент – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, служащая субстратом для фосфорилазы.
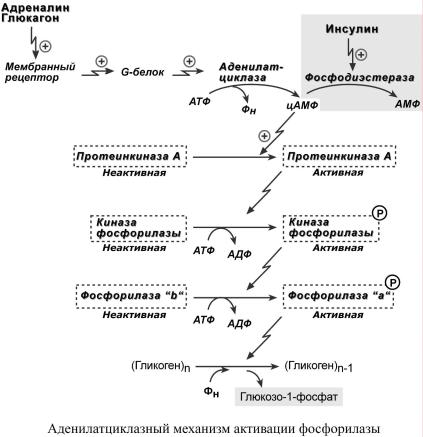
Р Е Г У Л Я Ц И Я О Б М Е Н А Г Л И К О Г Е Н А
Метаболизм гликогена в печени регулируется несколькими гормонами, одни из которых активируют ферменты синтеза гликогена, а другие – ферменты распада гликогена. Основные ферменты метаболизма гликогена активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферментам производят протеинкиназы, источником фосфата является АТФ:
o фосфорилаза гликогена активируется после присоединения фосфатной группы, o синтаза гликогена после присоединения фосфата инактивируется.
Фосфорилирование указанных ферментов начинается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Дефосфорилирование этих ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз, через сложный внутриклеточный механизм передачи сигнала, выступает инсулин. Таким способом инсулин запускает синтез гликогена за счет быстрой активации гликогенсинтазы и инактивации гликогенфосфорилазы.
Строениеобменуглеводов |
198 |
|
|
|
Одновременно инсулин и глюкокортикоиды увелсиглнтезчи,увеличваюткогена |
|
и- |
||||||
вая количество молекул гликогенсинтазы. |
|
|
|
|
|
||||
|
Длярегуляцииактивностифосфорилазысинтазыглиспкогенасобыйльзуется |
|
|
|
|
|
|
||
каскадныйаденилатциклазныймеханизм |
|
(смниже) |
. |
|
|
|
|
||
|
|
АК Т ФОСФОРИЛАЗЫВ А Ц И Я |
|
ГЛИКОГЕНА |
|
|
|||
|
Скоростьглико |
генолизалимитируетсятолькоскоростьюработы |
|
|
|
|
фосфорилазы глико- |
||
гена.Ееактивностьможетизменяться |
|
тремя способами: |
|
|
|
||||
o |
ковалентнаямодификация, |
|
|
|
|
|
|
|
|
o |
кальций-зависимаяактивация, |
|
|
|
|
|
|
||
o |
аллостерическаяактивацияпомощьюАМФ. |
|
|
|
|
|
|
|
|
|
|
Ковалентнаямодификация |
|
|
|
|
|
||
|
Придействии |
некготорыхрмоновнаклеткуп |
|
|
роисходит активация ферментачерез |
||||
аденилатциклазныймеханизм |
,который являетсятакназывакаскаднымремымгулиро |
|
|
ва- |
|||||
нием.Последовательностьсобытийданноммеханизмевключает: |
|
|
|
|
|
|
|
||
1М. |
олекула гормона (адреналин,глюкагон) |
взаимодействует сосвоим |
рецептором; |
||||||
2Активный. гормон |
-рецепткомплексв рздействуетнмембранныйа |
|
|
|
G-белок; |
|
|||
3. G-белок активируетфермент |
аденилатциклазу; |
|
цАМФ) – вторичныйпосредник |
||||||
4А. денилатциклпревращаетАТФциклическийАМФза( |
|
|
|
||||||
|
(мессенджер); |
|
|
протеинкиназуА |
|
|
|
||
5. цАМФаллостерическиактивируетфермен |
|
|
; |
|
|
||||
6П. ротеинкиназаАфосфорилиразличнывнутбелкииклеточные.уОднизэтихбем |
|
|
|
|
|
л- |
|||
|
ков является синтазагликогена |
, |
ееактивностьугнетается |
|
,другимбелком |
– киназа |
|||
|
фосфорилазы,котораяпри |
фосфорилактивируется; овании |
|
|
|
|
|
||
7К. иназафосфосфорилируетрилазы |
|
фосфорилазу" |
b" гликогена,послед няяврезультате |
||||||
|
превактивнуюращается |
фосфорилазу "а" ; |
|
|
|
|
|
||

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
199 |
|
|
|
8. Активная фосфорилаза "а" гликогена расщепляет α1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ и, следовательно, ликвидирует развитие аденилатциклазного механизма действия глюкагона и адреналина, со всеми вытекающими последствиями.
Кальций-зависимая активация
Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca2+ и кальмодулином. Этот путь работает при инициации кальцийфосфолипидного механизма (см "Гормоны") либо при отсутсвии стимуляции аденилатциклазы. Это оправдывает себя, например, в мышцах при умеренной нагрузке, когда влияние адреналина через аденилатциклазу еще не произошло или недостаточно, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca2+.
Аллостерическая активация
Также существует активация фосфорилазы гликогена с помощью АМФ – аллостерическая активация благодаря присоединению АМФ к молекуле фосфорилазы "b". Способ работает в любой клетке – при увеличении расхода АТФ и накоплении продуктов его распада АДФ и АМФ.
Г Л И К О Г Е Н О В Ы Е Б О Л Е З Н И
Это наследственные заболевания, обусловленные недостаточностью каких-либо ферментов, отвечающих за метаболизм гликогена. Средняя частота встречаемости составляет
1:40000.
ГЛ И К О Г Е Н О З Ы
Синдром гликогеноза возникает в результате дефекта фермента синтеза или мобилизации гликогена, что приводит к накоплению или изменению структуры гликогена в разных тканях, чаще в печени и мышцах. В настоящее время гликогенозы делят по патогенетиче-
скому признаку на печеночные, мышечные и смешанные формы.
Всего существует 12 типов гликогенозов. По патогенетическому признаку гликогенозы делят:
•печеночные – 0, I, III, IV, VI, VIII, IX, Х, ХI типов,
•мышечные – V и VII типов,
•смешанные – II типа.
