
Обмен железа |
320 |
ТРАНСПОРТ ЖЕЛЕЗА
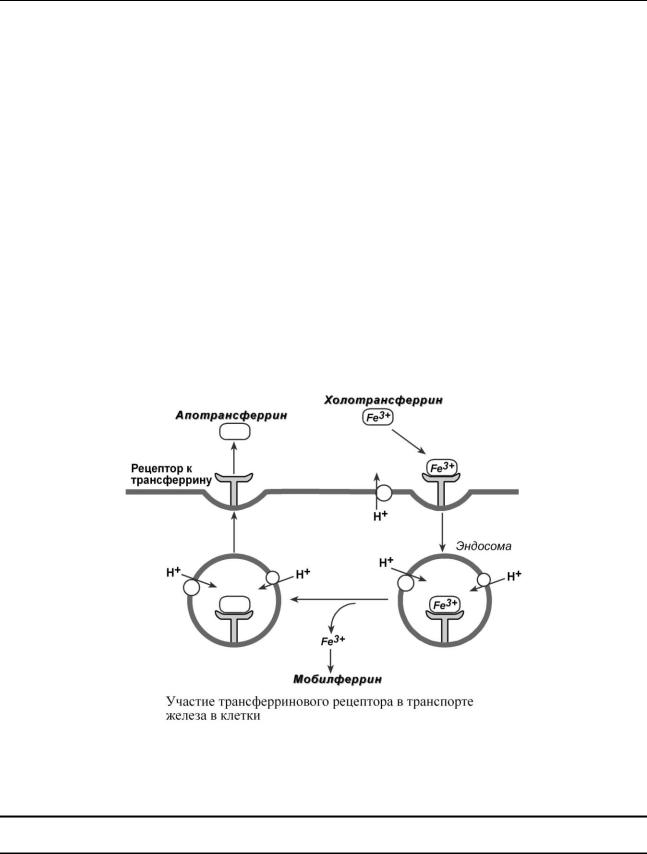
После всасывания железо либо откладывается в клетках кишечника в составе ферритина, либо сразу попадает в кровоток и в комплексе с трансферрином переносится в клетки печени, костного мозга или других тканей. Нагруженный железом трансферрин (холотрансферрин) взаимодействует со своим специфическим мембранным рецептором. Трансферриновый рецептор на низком уровне экспрессируется во всех типах клеток, на высоком уровне
– в активно делящихся клетках.
После образования тройного комплекса (железо, апотрансферрин, рецептор) он перемещается в цитоплазму эндоцитозом и оказывается внутри эндосом. На мембране эндосомы присутствует H+-АТФаза, создающая кислый рН внутри нее. В результате железо диссоциирует из комплекса и составляет свободный пул. Далее оно может доставляться мобилферрином к месту использования, например, встраиваться в порфириновое кольцо гема, включаться в железопротеины или депонироваться с ферритином.
Эндосома, содержащая апотрансферрин-рецепторный комплекс, возвращается обратно к плазматической мембране. При нейтральных рН апотрансферрин имеет низкое сродство к своему рецептору и высвобождается в кровоток, что позволяет другой молекуле холотрансферрина связаться с рецептором.
Вне связи с белками железо очень токсично, так как запускает свободно-радикальные реакции с образованием активных форм кислорода.
Запасы железа в организме находятся в основном в гепатоцитах и макрофагах. Большая часть железа, необходимого организму, непрерывно поступает из макрофагов при его рециркуляции после утилизации стареющих эритроцитов или других клеток.
Р Е ГУ ЛЯЦ ИЯ ОБМ Е Н А ЖЕ Л Е З А
Основными факторами, влияющими на обмен железа, являются потребности гемопоэза, пищевой фактор и уровень запаса в тканях. Количество железа в организме поддерживается на одном уровне тремя основными путями:
1.Регуляция всасывания в кишечнике.
2.Поддержание рециркуляции железа эритроцитов.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
321 |
|
|
|
3. Система IRE/IRP, позволяющая каждой клетке регулировать количество потребляемого железа.
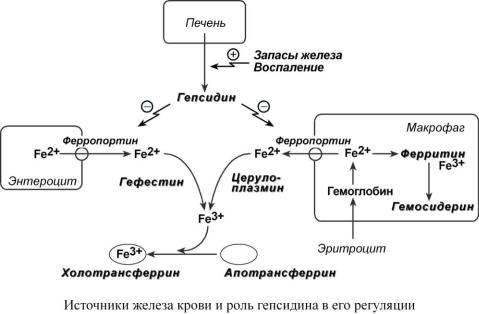
Функции гепсидина
Среди белков-регуляторов обмена железа к настоящему времени наиболее хорошо изучен гепсидин, олигопептид из 25 аминокислот. Гепсидин синтезируется в печени при достаточном количестве железа в гепатоците или под действием цитокинов.
Действие гепсидина заключается в снижении активности белка ферропортина, отвечающего за выход ионов железа из клетки в кровь:
1.В энтероците действие гепсидина приводит к тому, что большая часть железа остается в клетке, запасается в ферритине и теряется при слущивании кишечного эпителия.
2.При действии гепсидина на макрофаг происходит задержка железа внутри макрофага.
Являясь белком острой фазы, гепсидин повышается при любых воспалительных процессах, протекающих в организме, и при бактериальных инфекциях. Повышение его продукции происходит под влиянием провоспалительных цитокинов, наиболее эффективным из которых является интерлейкин-6. Образующийся избыточный гепсидин, уровень которого может повышаться в сотни раз, связывается с ферропортином и вызывает его лизосомальную деградацию. Это блокирует выход железа из макрофагов и энтероцитов, вызывая гипоферремию. Недостаток железа в крови снижает его использование для эритропоэза – разви-
вается "анемия воспаления".
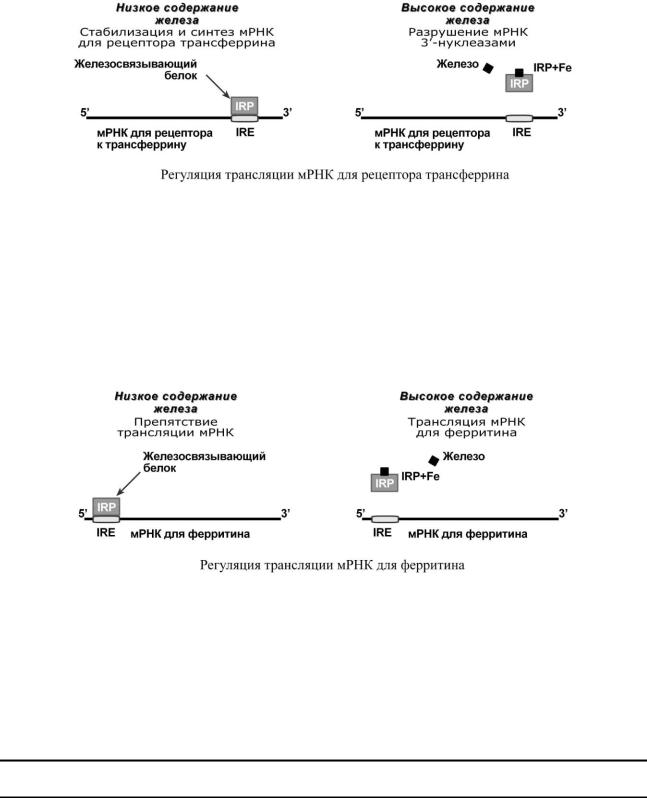
Система IRE/IRP
Система IRE/IRP (англ. iron-responsive–element – железочувствительный элемент; iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент) обеспечивает регуляцию:
o синтеза рецепторов к трансферрину, o синтеза ферритина.
Молекулы IRP способны связываться с участком IRE на матричных РНК двух белков – рецептора трансферрина и ферритина. При сниженной концентрации железа в клетке белок IRP активный, при высоком содержании – образуется комплекс IRP+Fe и белок инактивируется.
Обмен железа |
322 |
|
|
Присоединение активного IRP к 3'-концу мРНК рецептора трансферрина (при низком уровне железа) защищает мРНК от разрушения 3'-РНКазами и, как следствие, она существует дольше, образуется больше рецепторов, связывается больше холотрансферрина и повышается поток железа в клетки.
Присоединение активного IRP к 5'-концу мРНК ферритина (при низком уровне железа) не позволяет ей участвовать в процессе трансляции и синтезе новых молекул ферритина. Когда концентрация железа в клетке возрастает, оно присоединяется к IRP и снижает его сродство к матричной РНК. Конечным результатом является увеличение синтеза молекул ферритина, депонирующего железо.
ВЫВЕ ДЕНИЕ
В сутки обычные потери железа составляют 1-2 мг и происходят несколькими путями: o с желчью
o вместе со слущивающимся эпителием ЖКТ, o десквамация кожи,
o у женщин детородного возраста – от 14 до 140 мг/месяц,
oвыпадение волос, срезание ногтей.
НАР У ШЕ НИЕ ОБМ Е Н А ЖЕ Л Е З А
Избыток железа
Существует аутосомно-рецессивное заболевание гемохроматоз, связанное с нарушением гепсидиновой регуляции и избыточным всасыванием железа в кишечнике. В результате железо накапливается в органах и тканях: печени, поджелудочной железе, миокарде, селезенке, коже, эндокринных железах и др. Общее содержание железа в организме достигает 20-60 г при норме 2-4 г. Постепенно развиваются цирроз печени, кардиомиопатии, сахарный диабет 1 типа, артрит.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
323 |
|
|
|
Железодефицит
При недостаточности железа в организме мобилизация резервов происходит в следующем порядке:
o железо из депо (ферритин),
o затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
o далее истощаются запасы сывороточного железа (холотрансферрин), o в последнюю очередь страдает синтез гемоглобина.
Таким образом, железодефицитная анемия является проявлением крайнего дефици-
та железа, и нормальная концентрация гемоглобина крови не должна быть критерием обеспеченности организма железом.
Причины
Причинами железодефицита являются недостаток его в пище, заболевания ЖКТ со снижением всасывания (гастриты), потери железа с кровью при менструальных, кишечных или иных кровотечениях. У новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии, и также в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Симптомы
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
o ухудшение внимания и памяти у детей и взрослых,
oуплощение, неровность и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
o выпадающий и секущийся волос,
o поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
oнеинфекционный ларингофаринготрахеит (гиперемия и охриплость), что дезориентирует врача,
oмышечная слабость:
-общая утомляемость,
-недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение нескольких капель мочи при резком кашле, смехе, чихании,
-недостаточное сокращение кардиального сфинктера пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу,
o атрофический гастрит – может быть как причиной, так и следствием железодефицита,
половина больных гастритом имеет недостаток железа,
oобострение ИБС и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов в миокардиоцитах),
oизвращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
oизвращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
ГЕМ ОПРОТ ЕИН Ы . ОБМЕН ГЕМ А
Гемопротеины являются подвидом хромопротеинов и подразделяются на неферментативные белки и ферменты:
o гемоглобин (82% общего количества гема организма) локализован в эритроцитах и клетках костного мозга,
o миоглобин скелетных мышц и миокарда (17%),
oферменты – ферменты дыхательной цепи, P450, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза и т.д. – менее 1%.
С ТР ОЕ НИЕ И СИ Н ТЕ З ГЕ М А
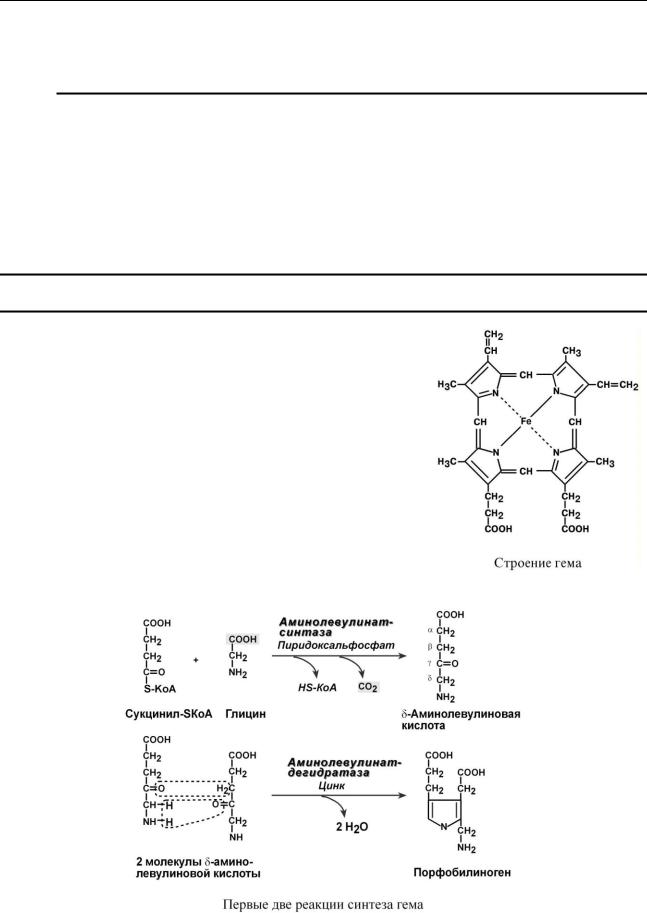
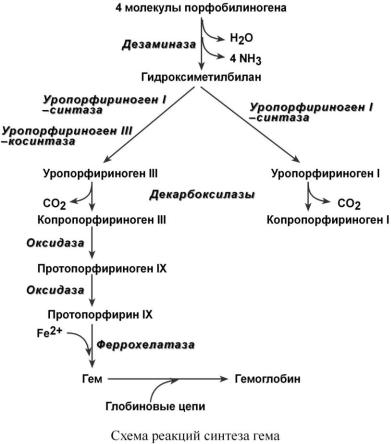
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника, в меньшем количестве в остальных тканях.
Первая реакция синтеза с участием
-аминолевулинат-синтазы ( - греч. "дельта") происхо-
дит в митохондриях.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
325 |
|
|
|
Следующая реакция при участии аминолевулинатдегидратазы протекает в цитозоле. После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиме-
тилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I – синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфи-
риноген III – косинтаза.
Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III возврашается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Р Е Г У Л Я Ц И Я С И Н Т Е З А Г Е М А
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.
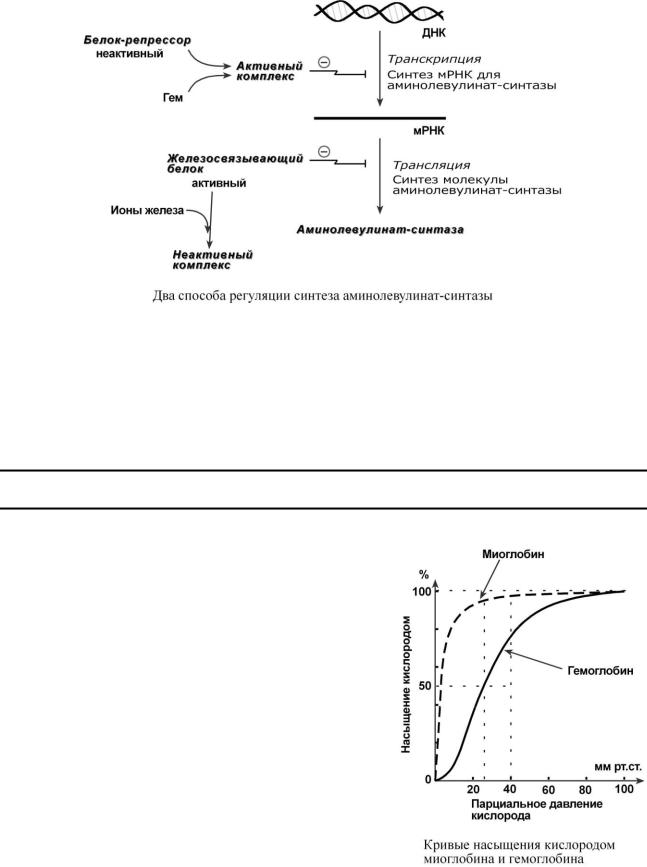
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза. Гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
С другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс.
Гемопротеины. Обмен гема |
326 |
|
|
Положительным модулятором этого же фермента служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
М И О Г Л О Б И Н
Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Мио-
глобин обладает более высоким сродством к кисло-
роду по сравнению с гемоглобином. Это свойство обусловливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
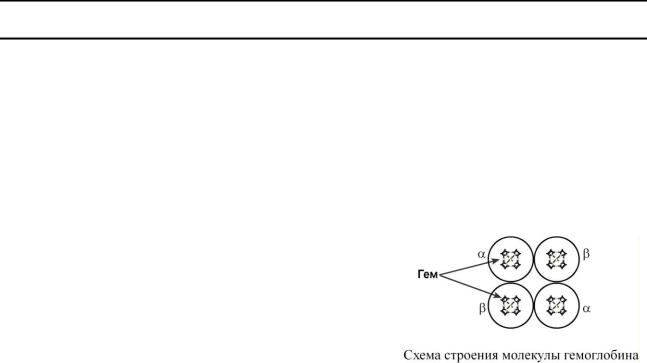
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина:
oодно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст.
для миоглобина,
oпри парциальном давлении кислорода от 26 до 40 мм рт.ст. (в тканях) гемоглобин насыщен на 50-
80%, тогда как миоглобин – почти на 100%. Таким образом, миоглобин остается оксигени-
рованным до того момента, пока количество кисло-
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
327 |
|
|
|
рода в клетке не снизится до предельных величин. Только после этого начинается отдача кислорода для реакций метаболизма.
ГЕ М О Г Л О Б И Н
СТ Р О Е Н И Е Г Е М О Г Л О Б И Н А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Протомеры соединяются друг с другом благодаря образованию гидрофобных, ионных, водородных связей. При этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемо-
глобине могут быть представлены различными типами полипептидных цепей: α ("альфа"), β ("бета"), ε ("'эпсилон"), ("гамма"), ("дельта"), ("кси"). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, вопервых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи
пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
НО Р М А Л Ь Н Ы Е И П А Т О Л О Г И Ч Е С К И Е
ФО Р М Ы Г Е М О Г Л О Б И Н А
Нормальные формы
Существует несколько нормальных вариантов гемоглобина:
oHbР – примитивный гемоглобин, содержит 2 - и 2 -цепи, встречается в эмбрионе между 7-12 неделями жизни,
oHbF – фетальный гемоглобин, содержит 2α и 2 -цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
oHbA – гемоглобин взрослых, доля составляет 98%, содержит 2α и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
o HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α и 2 -цепи,
oHbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
oHbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого" участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну молекулу гемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцита и при прохождении капилляров гемолиз.

Гемопротеины. Обмен гема |
328 |
|
|
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Р Е Г У Л Я Ц И Я П Р И С О Е Д И Н Е Н И Я К И С Л О Р О Д А К Г Е М О Г Л О Б И Н У
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется коопера-
тивное взаимодействие.
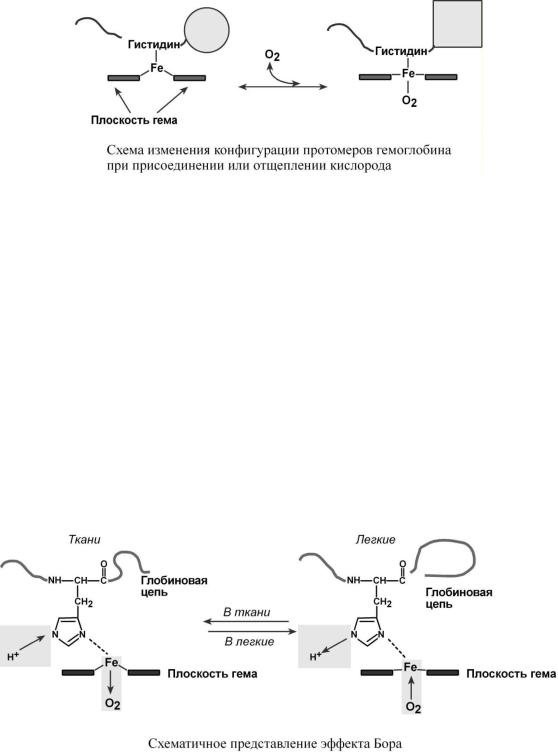
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
329 |
|
|
|
конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина, в легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
H-Hb + O2 HbO2 + H+
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях кислород отрывается и ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
