
- •Контрольные вопросы
- •Лабораторная работа № 2 Определение жесткости воды методом комплексонометрического титрования
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа № 3 Определение содержания Fe (II) в анализируемом растворе методом прямого окислительно-восстановительного титрования
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа № 5
- •4.1. Определение содержания хлорида калия в анализируемом растворе методом прямой кондуктометрии
- •Оборудование и реактивы
- •Ход работы
- •1. Построение калибровочного графика
- •2. Определение содержания хлорида калия по калибровочному графику
- •Контрольные вопросы
- •4.2. Стандартизация раствора хлорида бария по титрованному раствору сульфата натрия методом кондуктометрического титрования
- •Оборудование и реактивы
- •Ход работы
- •Оборудование и реактивы
- •Ход работы
- •1. В кислой среде
- •2. В щелочной среде
- •Контрольные вопросы
Ход работы
Отмеряют пипеткой 100,00 cм3 анализируемой воды, переносят в коническую колбу для титрования, добавляют 5 cм3 аммиачной буферной смеси, 2 см3 раствора сульфида натрия, 5 – 10 капель раствора гидроксиламина солянокислого, от 0,05 до 0,1 г сухого индикатора и титруют рабочим раствором трилона Б до изменения окраски в эквивалентной точке от винно-красной (красно-фиолетовой) до синей (с зеленоватым оттенком). Раствор трилона Б в начале титрования добавляют довольно быстро при постоянном перемешивании. Затем, когда цвет раствора начинает меняться, раствор трилона Б добавляют медленно. Конечной точки титрования достигают при изменении окрашивания, когда цвет раствора перестает меняться при добавлении капель раствора трилона Б. Титрование проводят не менее 3-х раз, до сходящихся результатов. Результаты титрования заносят в таблицу:
Vал, см3 |
V(ЭДТА), см3 |
100,00 |
… |
100,00 |
… |
100,00 |
… |
Титрант – раствор трилона Б (указывают точную молярную концентрацию эквивалента), определяемый показатель – жесткость.
По результатам титрования рассчитывают жесткость в полученной для анализа пробе по формуле:
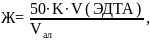
где Ж – жесткость, °Ж; 50 – коэффициент пересчета; К – поправочный коэффициент к концентрации раствора трилона Б; V(ЭДТА) – объем раствора трилона Б, израсходованный на титрование, см3; Vал – объем аликвоты, см3.
Контрольные вопросы
1. Какие органические вещества называются комплексонами? В чем их особенность как лигандов?
3. Какие органические вещества используют в качестве индикаторов в методе комплексонометрического титрования? Каков принцип их действия?
4. Перечислите требования, предъявляемые к металлохромным индикаторам.
5. В каком случае при проведении комплексонометрического титрования используют метод обратного титрования и титрования по заместителю?
6. Катионы каких металлов можно определить методом комплексонометрического титрования?
Лабораторная работа № 3 Определение содержания Fe (II) в анализируемом растворе методом прямого окислительно-восстановительного титрования
Метод перманганатометрии основан на реакциях окисления восстановителей перманганат-ионом. Окисление может проводиться в кислой, щелочной и нейтральной среде.
Кислая среда:
MnO4- + 8H+ + 5e- Mn2+ + 4H2O
Щелочная среда:
MnO4- + e- MnO42-
Слабощелочная или нейтральная среда:
MnO4- + 2H2O + 3e- MnO2↓ + 4ОН-
В то время как при титровании в кислой среде образуются почти бесцветные ионы Mn2+, в слабощелочной или нейтральной среде выпадает темно-бурый осадок MnO2, что сильно затрудняет фиксирование точки эквивалентности.
Кроме того, окислительная способность перманганата калия в кислой среде гораздо выше, чем в щелочной. Поэтому в перманганатометрии используют чаще всего реакции окисления перманганатом в кислой среде. Титрование перманганатом проводят без индикатора. Приготовить титрованный раствор перманганата по точной навеске нельзя, так как твердый KMnO4 всегда в какой-то степени загрязнен диоксидом марганца MnO2. Кроме того, он легко разлагается под влиянием восстановителей – аммиака, органических веществ, попадающих в воду. Вследствие этого концентрация раствора KMnO4 в первое время после приготовления несколько уменьшается. Перманганат окисляет саму воду:
4MnO4- + 2H2O 4MnO2↓ + 3O2 + 4 OH-
Процесс окисления воды медленный, но ускоряется при нагревании, освещении, под действием кислот, оснований, ионов Mn+2 и MnO2 (автокатализ). Необходимо свести влияние всех этих факторов к минимуму. Для этого нужно соблюдать следующие правила работы с раствором перманганата калия:
1) титр раствора перманганата калия устанавливают не ранее, чем через 7-10 дней после его приготовления;
2) периодически удаляют осадок MnO2, содержащийся в растворе перманганата, т.к. он каталитически ускоряет разложение KMnO4 (удаляют фильтрованием через стеклянный фильтр;
3) не допускают соприкосновения раствора перманганата калия с резиной, бумагой, т.к. KMnO4 окисляет эти вещества;
4) хранят раствор перманганата в темноте или в склянке из темного стекла;
5) стандартизируют раствор через каждые 1-2 недели.
В качестве первичного стандарта при стандартизации раствора перманганата калия используют раствор оксалата натрия (Na2C2O4) или щавелевой кислоты (Н2С2О4). В кислом растворе перманганат окисляет щавелевую кислоту до углекислого газа и воды. При этом суммарная реакция выражается уравнением:
2КMnO4 + 5H2C2O4 + 3H2SO4 2MnSO4 + 10CO2↑ + 8H2O + K2SO4
Окисление оксалат–ионов происходит по схеме:
С2О42- - 2е- 2СО2
Используя перманганатометрию, можно определять содержание в растворе различных восстановителей, например, ионов Fe2+, Sn2+. Данное определение основано на реакции:
MnO4- + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O
Титрование ведут в кислой среде (для этого раствор подкисляют серной кислотой).
