
4 курс / Акушерство и гинекология / Руководство_по_акушерству_Сидорова_И_С_,_Кулаков_В_И_,_Макаров_И
.pdfкровопотере является потеря 25—30% от объема ОЦК и снижение уровня гемоглобина ниже 70— 80 г/л, а гематокритного числа ниже 25%.
9.11.3. Родоразрешение при гестозе путем кесарева сечения. Особенности возмещения операционной кровопотери
При тяжелом гестозе или при его критических формах (преэклампсия, эклампсия) неизменно возникает вопрос о неотложном родоразрешении, так как пролонгирование беременности до доношенного срока становится опасным для жизни и здоровья матери и плода.
Показания к немедленному родоразрешению путем кесарева сечения:
•эклампсия во время беременности или в первом периоде родов;
•преэклампсия;
•тяжелая форма гестоза и отсутствие условий для быстрого и бережного родоразрешения («незрелая» шейка матки, тазовое предлежание, диспропорция таза матери и головки плода, другие осложнения, указывающие на неблагоприятную акушерскую ситуацию);
•признаки тяжелого поражения печени (HELLP-синдром, ОЖГ, почечно-печеночно- легочная недостаточность);
•анурия и олигурия (почечная недостаточность);
•отслойка сетчатки глаза (ретинопатия);
•преждевременная отслойка плаценты (даже непрогрессируюшая);
•ухудшение состояния роженицы (повышение артериального давления, тахикардия, одышка) или плода (декомпенсированная ФПН, децелерации на КТГ, снижение сатурации плода до 40% и ниже, критический кровоток);
•аномалии родовой деятельности, требующие длительной корригирующей терапии;
•патологическое начало родов (патологический прелиминарный период, несвоевременное излитие околоплодных вод, «незрелая» шейка матки, дистоция или анатомическая ригидность шейки матки и др.);
•преждевременное родоразрешение при тазовом предлежании плода.
Стандартные манипуляции перед кесаревым сечением:
▲Катетеризация подключичной вены для измерения ЦВД и возможной длительной интенсивной инфузионной терапии.
▲Катетеризация одной из периферических вен для проведения инфузионной терапии.
▲Катетеризация мочевого пузыря для оценки почасового диуреза и контроля за состоянием
мочи.
▲Мониторирование основных жизненных функций (артериальное давление, пульс, дыхание, РСо2, Ро2, ЭКГ).
▲Контроль и коррекция показателей крови (гемоглобин, гематокритное число, число форменных элементов крови, свертываемость).
Оперативное родоразрешение при тяжелом гестозе, кроме изложенных стандартных мероприятий, требует:
• контроля за средним артериальным давлением;
• коррекции ОЦК;
• поддержания стабильного артериального давления, в том числе среднего в пределах 90— 100, систолического 120—130 мм рт. ст., или умеренно выраженной гипертензии (артериальное давление 140/90 - 150/100 мм рт. ст.), которую следует снижать постепенно и осторожно;
• устранения беспокойства, напряжения, судорог;
• поддержания Рсо2 артериальной крови при ИВЛ на уровне 25—35 мм рт. ст., во время самостоятельного дыхания — 20—40 мм рт. ст., а Ро2 артериальной крови на уровне 100 мм рт. ст.;
• рН артериальной крови 7,3—7,6;
• оптимальных показателей крови для кесарева сечения:
— гематокритное число 30—35%,
— коллоидно-осмотическое давление плазмы выше 15 мм рт. ст.,
521

—осмолярность плазмы 280—330 мм рт. ст.,
—содержание глюкозы 5,55—16,55 ммоль/л.
Целесообразно при кесаревом сечении у больных с тяжелым гестозом (включая критические формы — эклампсию, преэклампсию) поддерживать наиболее важные функции сердечнососудистой и дыхательной систем:
Таблица 9.4. Схема инфузионно-трансфузионной терапии при возмещении интраоперационной кровопотери [Молчанов И. В. и др., 1998; Мокеев И. Н., 2002]
Предполагае |
Инфузионная терапия |
|
Трансфузионная терапия |
|
|||||
коллоиды |
|
кристаллоид |
эритроцитна |
|
свежеза |
|
|||
мый объем |
|
|
концентрат |
||||||
|
ы |
я масса |
|
|
|||||
кровопотери |
|
|
|
|
5% раствор |
морожен |
тромбоцито |
||
% ОЦК |
лекарственное |
|
доза, мл/кг |
доза, мл/кг |
доза (1 доза |
|
альбумина |
ная |
в |
средство |
|
равна 250 мл) |
|
|
плазма |
||||
|
|
|
|
|
|||||
20 |
Инфукол ГЭК 6% |
10-15 |
10-15 |
0 |
0 |
0 |
0 |
||
30 |
Инфукол ГЭК 6% |
20-25 |
0 |
6* |
0 |
0 |
0 |
||
|
Инфукол ГЭК 6% |
25-33 |
(10) |
6-8* |
0 |
В случае |
значимых |
||
50 |
Инфукол ГЭК 10% |
15-20 |
(10) |
6-8* |
0 |
нарушений гемо- |
|||
|
коагуляции |
||||||||
|
Инфукол ГЭК 6% |
33-45** |
10-15 |
15 и более |
|
|
|||
|
|
В случае |
|
|
|||||
75 и более |
Инфукол ГЭК 10% |
20-30** |
10-15 |
15 и более |
|
гипоальбум |
|
|
|
|
|
|
|
|
|
|
инемии |
|
|
Примечания.
0 — целесообразность введения определяется индивидуально;
*— индивидуальный подход в зависимости от показателя гематокритного числа;
**— доза завышена по жизненным показаниям.
•нормотонию;
•гипероксию;
•гипокапнию;
•умеренную гемодилюцию;
•умеренную гипергликемию.
Необходимо также корригировать диурез, устранять гиповолемию и контролировать систему свертывания крови.
Во время кесарева сечения следует избегать любой гипотонии (систолическое давление ниже 100 мм рт. ст.) или тяжелой гипертензии (систолическое давление выше 170 мм рт. ст., среднее выше 130).
Далее приводим схему инфузионно-трансфузионной терапии при возмещении кровопотери, рекомендуемую в настоящее время (табл. 9.4).
На сегодняшний день инфукол ГЭК 6% и 10% можно считать лекарственным средством, приближающимся к идеальному для проведения инфузионной гемодилюции при оперативных вмешательствах.
Тактика ведения больных по предполагаемой схеме инфузионно-трансфузионной терапии различается в зависимости от величины кровопотери.
При операционной кровопотере до 20% ОЦК не показано использование препаратов донорской крови. В ходе операции кровопотеря возмещается или инфузией раствора инфукол ГЭК 6% или растворов кристаллоидов (солевые или буферные растворы). В раннем послеоперационным периоде используются только глюкозосолевые растворы (в суточной потребности).
При операционной кровопотере до 30% ОЦК в течение операции в качестве базового раствора используется инфукол ГЭК 6%. Его количество, необходимое для инфузии, дозируется из расчета 20—25 мл/кг. При значимом снижении показателя гематокритного числа (пороговый показатель — 25—27%) проводится трансфузия эритроцитной массы из расчета 6—8 мл/кг. В раннем послеоперационном периоде вводят только глюкозосолевые растворы (в суточной потребности).
При операционной кровопотере до 50% ОЦК в качестве базового раствора используется инфукол ГЭК 6%, который вводится из расчета 25— 33 мл/кг. Другими компонентами инфузионно-
522

трансфузионной терапии являются донорские эритроциты (6—8 мл/кг) и при необходимости кристаллоидные растворы (до 10 мл/кг). При применении раствора инфукол ГЭК 10% его доза составляет 15—20 мл/кг, а остальная инфузионная терапия не отличается от таковой при использовании 6% раствора.
Враннем послеоперационном периоде основу инфузионной терапии составляют глюкозосолевые растворы (в суточной потребности). Раствор инфукол ГЭК 6% или 10% вводится по индивидуальным показаниям в зависимости от показателей центральной гемодинамики.
При операционной кровопотере 75% ОЦК и более необходимым является использование растворов инфукол ГЭК 6% или 10%, количество которых в этих ситуациях может дозироваться из расчета 45 мл/кг и 30 мл/кг и выше по жизненным показателям для 6% и 10% растворов соответственно.
Обязательными компонентами терапии при подобных кровопотерях являются трансфузии эритроцитной массы (15 мл/кг и более) и инфузии растворов кристаллоидов (10—15 мл/кг).
Враннем послеоперационном периоде, как правило, приходится дополнительно назначать коллоиды и эритроцитную массу.
Трансфузию свежезамороженной плазмы и концентрата тромбоцитов следует осуществлять только в случае значимых нарушений гемокоагуляции, а 5% раствора альбумина — только в случае гипоальбуминемии.
Нелишним будет еще раз напомнить, что особое внимание следует обратить на неоправданно широкое применение в анестезиологии и интенсивной терапии препаратов свежей донорской крови, к которым относятся эритроцитная масса, свежезамороженная плазма, концентрат тромбоцитов и растворы альбумина. В свете современных представлений как в нашей стране, так и за рубежом, трансфузии свежезамороженной плазмы должны проводиться только при значимых коагулопатиях для восстановления плазменных факторов свертывания вместе с одновременным введением малых доз гепарина. При этом свежезамороженная плазма не должна рассматриваться в качестве плазмозамещающего средства и источника белка.
Кроме того, должны быть ограничены показания к введению раствора альбумина, так как внедрение в широкую клиническую практику растворов на основе ГЭК 6% и 10% дает достаточные возможности для поддержания онкотического давления. Необходимо ориентироваться на основные показатели гемостаза и корригировать их (табл. 9.5).
Таблица 9.5. Основные контрольные показатели гемостаза и способ их коррекции во время оперативных вмешательств
Объем кровопотери,% |
Контрольные |
Способ коррекции |
|
ОЦК |
показатели |
||
|
15-30
50
75
100
ОЦК < 100% |
Коррекция содержания интерстициальной |
|
жидкости и дефицита электролитов введением |
|
сбалансированных растворов кристаллоидов |
|
Замещение потери объема раствором |
|
инфукола ГЭК 6% |
Гематокритное число < |
Дополнительное замещение потери объема |
25-27% |
раствором инфукола ГЭК от 6% или 10%, |
|
коррекция гемостаза введением эритроцитной |
|
массы |
Общий белок сыворотки < |
Дополнительно по показаниям коррекция |
50 г/л Альбумин < 15-25 |
гемостаза введением альбумина, препаратов |
г/л Плазматические |
плазматических факторов свертывания крови, |
факторы свертывания |
а при их отсутствии — свежезамороженной |
крови < 35% |
плазмы и малых доз гепарина |
Тромбоциты < 50,0 • 109/л |
Дополнительно коррекция гемостаза |
|
введением концентрата тромбоцитов |
Указанные выше положения относительно применения препаратов донорской крови касаются как их трансфузии в ходе операций, так и в раннем послеоперационном периоде, а также при проведении интенсивной терапии.
При профилактике и базовой инфузионно-трансфузионной терапии операционной
523
кровопотери наиболее важными можно считать следующие положения.
1. Поддержание режима гемодилюций (уровень показателя гематокритного числа не выше
30%).
2.Препаратом выбора для инфузии при операциях является раствор на основе ГЭК второго поколения инфукол ГЭК 6% и 10%, при использовании которого многократно сокращаются показания к применению препаратов донорской крови, а при кровопотере до 50% ОЦК в раннем послеоперационном периоде при стабильных показателях гемодинамики появляется возможность ограничиться инфузией глюкозосолевых растворов.
3.Применение препаратов донорской крови должно производиться только по показаниям. Показанием к трансфузии эритроцитной массы, как правило, является снижение гематокритного числа менее 25—-27%.
Свежезамороженная плазма показана только при значимых нарушениях гемокоагуляции, ее не следует рассматривать в качестве плазмозамещающего раствора и источника белка. Показанием для инфузии растворов альбумина является снижение его уровня в сыворотке ниже 25 г/л. Во всех остальных случаях вместо этих потенциально опасных препаратов необходимо использовать растворы препарата инфукол ГЭК 6% и 10%.
Внедрение в рутинную практику операционной нормоволемической гемодилюций растворами инфукола ГЭК 6% и ГЭК 10% позволит обеспечить проведение абсолютно безопасной инфузионно-трансфузионной терапии при операциях.
Таким образом, в связи с практически полным отсутствием негативного влияния на систему гемостаза лекарственного средства инфукол ГЭК 6% и 10% снижаются показания к использованию плазмы.
Все большее внимание уделяется поиску эффективных и безопасных путей восполнения кровопотери и профилактики кровотечений при абдоминальном родоразрешении, поскольку в настоящее время акушерская кровопотеря продолжает оставаться одной из основных причин материнской смертности, а переливание свежезамороженной плазмы чревато известными серьезными осложнениями. На основании клинического применения растворов инфукола ГЭК в Научном центре акушерства, гинекологии и перинатологии РАМН выработаны рекомендации по восполнению кровопотери во время абдоминального родоразрешения у беременных с изокоагуляцией только 10% раствором инфукола ГЭК без введения свежезамороженной плазмы, а у беременных с исходной гиперкоагуляцией — либо 10% раствором инфукола ГЭК, либо аутоплазмой без использования свежезамороженной плазмы. Такая схема терапии позволяет адекватно возместить кровопотерю, не вызывает снижения гемокоагуляционного потенциала и обеспечивает профилактику риска тромботических осложнений.
524
Глава 10. ФЕТОПЛАЦЕНТАРНАЯ НЕДОСТАТОЧНОСТЬ
Нарушения морфофункционального состояния плаценты представляют собой одну из основных причин осложненного течения беременности и родов, а также перинатальной заболеваемости и смертности.
Патологические изменения, которые происходят при фетоплацентарной недостаточности (ФПН), приводят к:
•уменьшению маточно-плацентарного и фетоплацентарного кровотока;
•снижению артериального кровоснабжения плаценты и плода;
•ограничению газообмена и метаболизма в фетоплацентарном комплексе;
•нарушению процессов созревания плаценты;
•снижению синтеза и дисбалансу гормонов плаценты и их предшественников материнского
иплодового происхождения.
Все эти изменения подавляют компенсаторно-приспособительные возможности системы мать — плацента — плод, замедляют рост и развитие плода, обусловливают осложненное течение беременности и родов (угроза преждевременного прерывания беременности, гестоз, преждевременные и запоздалые роды, аномалии родовой деятельности, преждевременная отслойка плаценты и др.).
Фетоплацентарная недостаточность представляет собой симптомокомплекс, при котором возникают морфофункциональные нарушения плода и плаценты вследствие различных экстрагенитальных и гинекологических заболеваний и акушерских осложнений.
Разнообразие вариантов проявления ФПН, частота и тяжесть осложнений для беременной и плода, преобладающее расстройство той или иной функции плаценты зависят от срока беременности, силы, длительности и характера воздействия повреждающих факторов, а также от стадии развития плода и плаценты, степени выраженности компенсаторно-приспособительных возможностей системы мать — плацента — плод.
10.1. Причины и факторы риска
Фетоплацентарная недостаточность может развиваться под влиянием различных причин. Нарушения формирования и функции плаценты могут быть обусловлены заболеваниями сердца и сосудистой системы беременной (пороки сердца, недостаточность кровообращения, артериальная гипертензия и гипотензия), патологией почек, печени, легких, крови, хронической инфекцией, заболеваниями нейроэндокринной системы (сахарный диабет, гипо- и гиперфункция щитовидной железы, патология гипоталамуса и надпочечников) и целым рядом других патологических состояний.
ФПН при анемии обусловлена снижением уровня железа как в материнской крови, так и в самой плаценте, что приводит к угнетению активности дыхательных ферментов и транспорта железа к плоду.
При сахарном диабете нарушается метаболизм, выявляются гормональные расстройства и изменения иммунного статуса. Склеротическое поражение сосудов приводит к уменьшению притока артериальной крови к плаценте. На фоне данной патологии ФПН характеризуется замедленным или преждевременным созреванием плаценты с увеличением или уменьшением ее массы.
Важную роль в развитии ФПН играют различные инфекционные заболевания, особенно протекающие в острой форме или обостряющиеся во время беременности. Плацента может быть поражена бактериями, вирусами, простейшими и другими возбудителями инфекции. Наряду со специфическими воспалительными изменениями в плаценте отмечаются неспецифические реакции, характер которых зависит от времени и пути инфицирования.
Инфекционное поражение в I триместре нередко сопровождается прерыванием беременности. Инфицирование в более поздние сроки может быть ограничено локальными изменениями, которые зависят от характера возбудителя и пути его распространения.
Немаловажное значение в формировании ФПН играет патология матки: эндометриоз,
525
гипоплазия миометрия, пороки развития матки (седловидная, двурогая).
Фактором риска ФПН следует считать миому матки. Однако риск ФПН у беременных с миомой матки различен. К группе с высоким риском относят первородящих в возрасте 36 лет и старше с преимущественно межмышечным расположением миоматозных узлов больших размеров, особенно при локализации плаценты в области расположения опухоли. При центрипетальном росте миомы, подслизистой и шеечной локализации узлов, а также при нарушении питания опухоли вероятность возникновения ФПН и нарушения развития плода приближается к 85%.
Группу с низким риском ФПН составляют молодые женщины до 30 лет без тяжелых экстрагенитальных заболеваний, с небольшими миоматозными узлами преимущественно подбрюшинного расположения в дне и теле матки.
Среди осложнений беременности, наиболее часто сопутствующих ФПН, ведущее место занимает гестоз, что обусловлено известными патогенетическими механизмами и морфофункциональными изменениями в системе мать — плацента — плод, которые имеют место при данной патологии. Степень выраженности ФПН соответственно зависит от тяжести и длительности течения гестоза.
Угрозу прерывания беременности следует одновременно рассматривать и как причину, и как следствие ФПН. В связи с различной этиологией ФПН при угрозе прерывания беременности патогенез этого осложнения имеет различные варианты, а прогноз для плода зависит от степени развития защитно-приспособительных реакций.
При низком расположении или предлежании плаценты васкуляризация субплацентарной зоны снижена. Более тонкая стенка нижнего сегмента матки не обеспечивает необходимых условий для достаточной васкуляризации плацентарного ложа и его нормального функционирования. Относительно часто при данной патологии происходит отслойка плаценты, сопровождающаяся кровопотерей.
Многоплодная беременность представляет естественную модель ФПН в результате неадекватного обеспечения потребностей двух и более плодов.
В основе ФПН при изосерологической несовместимости крови матери и плода чаще всего лежат процессы нарушения созревания плаценты. У плода развиваются анемия и гипоксия, возникает задержка развития из-за нарушений процессов синтеза белка и снижения активности ферментов.
Увеличение частоты осложнений течения беременности при наличии рубца на матке определяется рядом факторов. Дистрофические изменения, происходящие в области рубца, оказывают влияние на иннервацию матки и приводят к патологической импульсации, что в свою очередь нарушает трофику и моторику передней стенки матки. Трофические изменения передней стенки матки нередко приводят к нарушению маточно-плацентарного кровообращения, особенно при локализации плаценты на передней стенке матки. Этим также объясняется увеличение частоты преждевременной отслойки плаценты, а также вероятности преждевременного прерывания беременности. Локализация плаценты на передней стенке матки резко ухудшает прогноз беременности, касающийся как состоятельности рубца, так и развития плода.
Функциональное состояние плаценты во многом обусловлено степенью ее развития в соответствии с гестационным сроком и сохранностью защитно-приспособительных механизмов. Соответствие зрелости плаценты гестационному сроку является одним из наиболее важных условий обеспечения адекватного развития плода и его защиты.
Несомненно, что поздний возраст беременной, отягощенный анамнез (аборты, воспалительные заболевания), вредные привычки, воздействие неблагоприятных факторов окружающей среды, плохое питание, социальная незащищенность и бытовая неустроенность также способствуют осложненному формированию плаценты и нарушению ее функции.
К факторам риска развития ФПН относят:
•возраст младше 17 лет и старше 35 лет;
•неблагоприятные социально-бытовые условия;
•токсическое и радиационное воздействие внешней среды;
•вредные пристрастия (алкоголь, курение, наркотики);
•инфекционные заболевания;
•экстрагенитальные заболевания (болезни сердечно-сосудистой системы, органов дыхания, печени, почек, крови, нервной системы, эндокринных органов, иммунной системы);
• гинекологические заболевания (воспалительной этиологии с нарушением
526
нейроэндокринной регуляции менструальной функции, сопровождающиеся новообразованиями);
•неблагоприятный акушерско-гинекологический анамнез (бесплодие, привычное невынашивание, самопроизвольные и искусственные аборты, преждевременные роды, перенашивание беременности, мертворождение, полостные операции на органах малого таза, рубец на матке, выскабливание стенок матки, осложненное течение предыдущей беременности и родов);
•осложнения настоящей беременности (ранний токсикоз, многоплодная беременность, тазовое предлежание плода, аномальное расположение плаценты, гестоз, изосенсибилизация крови матери и плода).
Перечисленные факторы прежде всего приводят к нарушениям маточно-плацентарного, а далее и фетоплацентарного кровообращения. В силу происходящих изменений развиваются необратимые морфологические процессы и нарушаются основные функции плаценты.
Клиническая практика и результаты научных исследований свидетельствуют о многофакторной природе ФПН. В этой связи практически невозможно выделить какой-либо единственный фактор развития данного осложнения. Перечисленные патологические состояния не в одинаковой мере оказывают влияние на развитие ФПН. Чаще всего в развитии этой патологии участвуют несколько этиологических факторов, один из которых может быть ведущим.
10.2.Патогенез
Знание основных звеньев патогенеза ФПН является фундаментом правильной диагностики, лечения и профилактики этого осложнения беременности.
В развитии ФПН можно выделить несколько взаимосвязанных патогенетических факторов:
•недостаточность инвазии цитотрофобласта;
•патологическое изменение маточно-плацентарного кровообращения;
•нарушение фетоплацентарного кровотока;
•незрелость ворсинчатого дерева;
•снижение защитно-приспособительных реакций;
•поражение плацентарного барьера.
Морфогенез плаценты во многом зависит от развития МПК. Согласно данным морфологических исследований, с 16—18-го дня наблюдается процесс инвазии интерстициального цитотрофобласта. На 5—6-й неделе процессы инвазии приобретают наиболее интенсивный характер с появлением клеток внутрисосудистого цитотрофобласта в просвете эндометриальных сегментов спиральных артерий. Первая волна инвазии цитотрофобласта способствует расширению и вскрытию спиральных артерий в межворсинчатое пространство, что обеспечивает начало и прирост МПК. К исходу 10-й недели на всей площади decidua basalis образуется система зияющих маточноплацентарных артерий с широким просветом и постоянным кровотоком. Первая волна инвазии цитотрофобласта затухает в течение 11—14 нед.
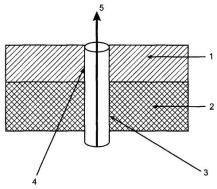
На 16—18-й неделе беременности начинается вторая волна инвазии цитотрофобласта за счет миграции внутрисосудистого цитотрофобласта в глубь стенок миометральных сегментов спиральных артерий, что сопровождается разрушением эластомышечных компонентов сосудов и замещением их фибриноидом (рис. 10.1). В это же время наблюдается проникновение интерстициального цитотрофобласта в миометрий для активации изменений в сосудистой стенке со стороны адвентициальной оболочки.
Рис. 10.1. Изменения в спиральных артериях в процессе инвазии цитотрофобласта.
527
1 — эндометрий; 2 — миометрий; 3 — миометральный сегмент спиральной артерии; 4 — эндометриальный сегмент спиральной артерии; 5 — кровоток по спиральной артерии в межворсинчатое пространство.
В результате деструкции мышечных элементов эндо- и миометральных сегментов спиральных артерий происходит значительное расширение их просвета и теряется способность отвечать на воздействие вазопрессорных факторов, что обеспечивает дальнейший прирост МПК.
Предполагается, что управляющую роль в этом сложном процессе выполняют децидуальные клетки, которые продуцируют местно-действующие регуляторы пролиферации и инвазии цитотрофобласта.
Происходящие изменения в стенках спиральных артерий следует рассматривать как адаптационный физиологический процесс, направленный на обеспечение непрерывного адекватного притока крови к межворсинчатому пространству.
Если к исходу I триместра беременности неполностью реализуется первая волна инвазии цитотрофобласта (сохраняются эластомышечные элементы эндометриальных сегментов спиральных артерий), то это приводит к значительному снижению объема притекающей материнской крови и задержке начала МПК. Образуются зоны некроза в decidua basalis, которые приводят к отслойке плаценты и смерти эмбриона.
Результаты многочисленных исследований плацентарного ложа во второй половине беременности при гестозе, гипертензии беременных, задержке развития плода свидетельствуют о том, что этим патологическим состояниям часто предшествует недостаточность второй волны инвазии цитотрофобласта в миометральные сегменты спиральных артерий. Сосуды сохраняют эндотелий, среднюю оболочку и эластические мембраны. Узкий просвет спиральных артерий, их резистентность и чувствительность к сосудодвигательным раздражителям препятствует нормальному кровотоку, не обеспечивает адекватного прироста МПК, приводит к уменьшению кровоснабжения плаценты и ишемии ворсин.
Возможно, артериальная гипертензия, связанная с беременностью, развивается как компенсаторная реакция, которая направлена на усиление притока крови в межворсинчатое пространство в ответ на недостаточность второй волны инвазии цитотрофобласта.
Нарушение кровотока в спиральных артериях сопровождается также геморрагическими нарушениями и в межворсинчатом пространстве. Патология спиральных артерий может привести как к преждевременной отслойке плаценты, так и к ее острому геморрагическому инфаркту.
Одним из ведущих факторов патогенеза ФПН является нарушение маточно-плацентарного кровообращения, в основе которого заложены морфофункциональные изменения сосудистой системы и отдельных ее компонентов, причем особое значение отведено расстройствам в бассейне спиральных артерий и в межворсинчатом пространстве.
К 10—12-й неделе физиологически протекающей беременности заканчивается период плацентации, который характеризуется васкуляризацией ворсин и превращением вторичных ворсин в третичные. Основной структурной единицей плаценты становится котиледон, который образован стволовой ворсиной с разветвлениями, содержащими сосуды плода. Центральная часть котиледона образует полость, которая окружена ворсинами второго и третьего порядка. В зрелой плаценте насчитывается от 30 до 50.
528

Рис. 10.2. Структура плаценты и маточно-плацентарного кровообращения.
1 — артерии пуповины; 2 — стволовая ворсина; 3 — децидуальная перегородка; 4 — деци-дуальный слой; 5 — миометрий; 6 — вены; 7 — спиральные артерии; 8 — хорион; 9 — амнион; 10 — межворсинчатое пространство;
11 — вена пуповины.
Межворсинчатое пространство с плодовой стороны образовано хориальной пластинкой и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластинкой, децидуальной оболочкой и отходящими от нее септами (рис. 10.2).
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих матку, открываются в межворсинчатое пространство 120—150 устьями. В результате гестационной перестройки спиральных артерий обеспечивается постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство.
За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, достигает хориальной пластинки и по разделительным септам возвращается в материнский кровоток через венозные устья.
Густая сеть терминальных и промежуточных ворсин образует капиллярное звено МПК, где через плацентарный барьер происходит диффузия газов и обмен питательных веществ между кровью матери и плода.
Отток крови из межворсинчатого пространства происходит через венозные устья, большинство из которых расположено вблизи септ, разделяющих котиледоны. Венозные устья и коллекторы не подвергаются гестационной перестройке, сохраняют эндотелиальную выстилку и отдельные гладкомышечные клетки.
Вены плацентарного ложа из верхней части тела матки переходят в гроздевидное сплетение, а из нижней части — в систему маточной вены, образуя многочисленные анастомозы.
На фоне сохранения мышечных элементов в стенках сосудов субплацентарной зоны, полной или частичной обтурации сосудов из-за атеросклеротических изменений, расстройства сосудистотромбоцитарного звена, тромбоза или микроэмболии происходят нарушения в сосудистой системе матки, межворсинчатом пространстве, сосудах плаценты и пуповины.
Следует принимать во внимание, что система кровоснабжения матки является лишь частью общей системы кровообращения организма женщины. Исходя из этого, патология МПК может расцениваться как одно из регионарных проявлений дезадаптации материнского организма и регуляторных механизмов сердечно-сосудистой системы (вегетативная нервная система, система ренин — ангиотензин, серотонин, брадикинин, катехоламины, простагландины и др.), которые изменяют тонус сосудов и реологические свойства крови.
Нарушение кровотока в отдельных сосудах не всегда приводит к значительному уменьшению кровоснабжения плаценты, так как оно компенсируется за счет коллатерального
529
кровотока. Если коллатеральное кровообращение выражено недостаточно, то развиваются нарушения микроциркуляции, ишемия и дегенерация участков плаценты.
Нарушение МПК характеризуется следующими важнейшими факторами:
•снижением притока к межворсинчатому пространству;
•затруднением оттока из межворсинчатого пространства;
•изменениями реологических и коагуляционных свойств крови матери и плода;
•расстройством капиллярного кровотока в ворсинах хориона.
Безусловно, что наиболее важной, но не единственной причиной снижения притока крови в межворсинчатое пространство является отсутствие гестационной перестройки миометральных сегментов спиральных артерий в результате недостаточности второй волны инвазии цитотрофобласта.
Определенную роль в уменьшении интенсивности кровотока в маточно-плацентарных сосудах играют гиповолемия (возникающая у беременных при гестозе), артериальная гипотензия или низкая локализация плаценты (нижний сегмент, предлежание плаценты).
Пороки сердца у беременных и снижение сократительной активности миокарда также приводят к уменьшению притока крови к матке. Анемия беременных способствует редукции газообмена и оксигенации крови плода.
Снижение МПК оказывает серьезное влияние на формирование ФПН в связи с тем что уровень газообмена обусловлен в большей степени скоростью кровотока, чем диффузионными свойствами плаценты. Следовательно, замедление кровотока в спиральных артериях и межворсинчатом пространстве неизменно приводит к снижению газообмена между кровью матери и плода.
Нарушение оттока крови из межворсинчатого пространства отмечается при сердечно-
сосудистых и легочных заболеваниях, при гипертонусе и повышенной сократительной активности матки. Во время сокращений матки значительно увеличивается давление в миометрии, амниотической полости и в межворсинчатом пространстве. При этом в маточно-плацентарных артериях давление крови существенно не изменяется, а венозный отток практически прекращается. На этом фоне происходит дальнейшее увеличение давления и существенное замедление циркуляции крови в межворсинчатом пространстве. Последующее возрастание давления в межворсинчатом пространстве до уровня, превышающего системное артериальное давление, служит препятствием для поступления крови по спиральным артериям (ишемия плаценты).
Таким образом, нарушение оттока и притока крови вызывает резкое снижение гемоциркуляции в межворсинчатом пространстве и уменьшение газообмена между кровью матери и плода.
Снижение скорости кровотока в межворсинчатом пространстве, особенно в сочетании с нарушением синтеза и баланса простагландинов Е2 и F2α, простациклина и тромбоксана А2, приводит к тромбообразованию, гиперкоагуляции, повышению вязкости крови, отложению фибрина, снижению микроциркуляции и развитию нодулярной ишемии.
Существенная роль в развитии ФПН отведена нарушению фетоплацентарного кровотока. Артериальная система ФПК, несущая венозную кровь от плода к плаценте, представлена двумя артериями пуповины, которые берут начало от общих подвздошных артерий плода. Конечными ветвями пуповинных артерий являются артерии и артериолы ворсин I, II и III порядка. Стенка артерий пуповины включает в себя два мышечных слоя: - наружный с циркулярным расположением мышечных пучков и внутренний с продольным их направлением.
Продолжением артериол являются многочисленные извитые капилляры в составе терминальных ворсин. На верхушках терминальных ворсин капилляры расширяются, образуя синусоиды, которые располагаются под истонченным синцитиотрофобластом и формируют плацентарный барьер.
От капиллярных петель на уровне промежуточных дифференцированных ворсин берет начало венозное звено ФПК. Далее от оснований опорных ворсин венозные сосуды (несут насыщенную кислородом кровь) направляются в толщу хориальной пластинки и сливаются в единую вену пуповины, представляющую собой мощный сосуд эластомышечного типа, переходящий в венозный проток в области печени плода.
Кровоток в пуповине и плаценте осуществляется за счет сократительной деятельности сердца плода, которое обладает ограниченными возможностями увеличения сердечного выброса.
530
