
4 курс / Акушерство и гинекология / Akusherstvo_Aylamazyan_2015
.pdfполной аспирации содержимого. У доношенных детей проводится 10-15-секундная тактильная стимуляция путем похлопывания по стопам или поглаживания по спине.
Первый этап реанимации - быстрое восстановление вентиляции, перфузии легких и сердечного выброса.
При рождении ребенка врач должен отметить, появилось ли самостоятельное дыхание, а если нет - есть ли сердцебиение? С учетом трех признаков (сердцебиение, характер дыхания и цвет кожного покрова) он должен немедленно решить вопрос о необходимости проведения реанимационных мероприятий и начать их не позже 15-20 с от момента рождения ребенка. Шкала Апгар должна использоваться для оценки их эффективности в конце 1-й и 5-й минуты. Оценку необходимо повторять (только при возникновении самостоятельного дыхания) каждые 5 мин до 20-й минуты жизни. При появлении самостоятельных, но неадекватных дыхательных движений (судорожные вдохи типа «гаспинг» или нерегулярное, затрудненное, поверхностное дыхание) следует сразу начать ИВЛ с помощью саморасправляющегося мешка («Ambu», «Penlon» и др.) или системы «Айра» через лицевую маску. Частота дыхания 40 в минуту, концентрация кислорода 60%, поток О2 не более 8 л/мин, длительность начального этапа вентиляции - 15-30 с.
При аномалиях развития верхних дыхательных путей и невозможности обеспечить свободную их проходимость следует использовать ротовой воздуховод. Он должен свободно помещаться над языком и доставать до задней стенки глотки, причем манжета остается на губах ребенка. Далее, через минуту после рождения, проводится оценка состояния ребенка и эффективности масочной вентиляции. В случае продолжения искусственной вентиляции легких (ИВЛ) через маску (более 1,5-2 мин) в желудок ребенка вводится зонд.
Вентиляция 30-60% кислородом через маску с помощью аппарата «Penlon» или системы «Айра» оказывается достаточно эффективной при рождении ребенка в асфиксии средней тяжести и легкой. При этом коррекция ацидоза происходит за счет оксигенации и снижения рСО2, что способствует расширению сосудистого русла легких.
Интубацию трахеи следует проводить немедленно:
1)при отсутствии дыхательных движений и наличии разлитого цианоза;
2)при массивной аспирации окрашенных меконием околоплодных вод, требующей санации трахеи;
3)новорожденным, гестационный возраст которых менее 27 нед, даже в случае наличия у них поверхностных дыхательных движений;
4)при подозрении на диафрагмальную грыжу;
5)при неэффективной масочной ИВЛ в течение 1-2 мин.
Интубацию и ИВЛ должен осуществлять специалист, лучше всех владеющий методами реанимации. Одновременно второй врач (или опытная медсестра) должен прослушать дыхательные шумы, чтобы убедиться в правильном положении эндотрахеальной трубки и хорошем газовом обмене, а также оценить частоту сердцебиений. Если частота сердечных сокращений (ЧСС) превышает 60 уд./мин, следует продолжить ИВЛ до восстановления адекватного самостоятельного дыхания, после чего оценить цвет кожного покрова. В случае брадикардии (60 и менее уд./мин) помощник проводит массаж сердца в соотношении с ИВЛ 3 : 1. Массаж сердца продолжается до тех пор, пока собственный сердечный ритм ребенка не достигнет 100 уд./мин. Если через 30 с на фоне адекватной ИВЛ ЧСС продолжает оставаться менее 60 уд./мин, следует начать медикаментозную терапию. Для этого второй помощник катетеризирует пупочную вену и вводит 0,1-0,3 мл/кг приготовленного заранее раствора адреналина. Последний можно
501
ввести непосредственно в эндотрахеальную трубку (для точности дозирования 0,1 мл из ампулы с адреналином разводят в 1 мл изотонического раствора натрия хлорида). Адреналин увеличивает частоту и силу сердечных сокращений и способствует повышению артериального давления, вызывая вазоконстрикцию периферических сосудов.
Если через 30 с ЧСС восстанавливается и превышает 60 уд./мин, непрямой массаж сердца прекращают, но продолжают ИВЛ до восстановления самостоятельного адекватного дыхания. Если же ЧСС остается ниже 60 уд./мин, следует повторно ввести адреналин. При наличии сохраняющейся бледности кожного покрова (несмотря на адекватную оксигенацию) и слабого пульса (что является признаком гиповолемии или острой кровопотери) для восполнения объема циркулирующей крови (ОЦК) и улучшения тканевой перфузии следует ввести изотонический раствор натрия хлорида (10 мл/кг). Результат - нормализация пульса, артериального давления, исчезновение бледности кожного покрова.
В тех случаях, когда асфиксия новорожденного возникла на фоне длительной хронической внутриутробной гипоксии (на что указывают тяжелая экстрагенитальная патология матери, осложнение беременности гестозом, перенашивание), для устранения возможного метаболического ацидоза ребенку после восстановления адекватного легочного дыхания следует ввести в вену 4% раствор натрия бикарбоната из расчета 2 мкг/кг или 4 мл на 1 кг массы тела. Скорость введения - 1 мкг/кг в минуту. Однако следует помнить, что вливание натрия бикарбоната в дозе 3 мкг/кг приводит к образованию такого количества СО2, которое образуется в организме за 1,5 мин. Поэтому для выведения СО2 требуется наличие хороших вентиляционно-перфузионных отношений, т. е. восстановление адекватного дыхания. Поскольку осмолярность 4% раствора натрия бикарбоната составляет 952 мосм/л, быстрое струйное введение этого препарата может способствовать гипернатриемии, которая на фоне гипоксических изменений гемодинамики может привести к появлению внутрижелудочковых кровоизлияний, особенно у недоношенных детей.
Стимуляторы дыхания применяются только в том случае, если известно, что за час до рождения ребенка мать получала наркотические вещества. С целью борьбы с наркотической депрессией вводят внутривенно или эндотрахеально 0,01 мл/кг налоксона.
Если через 10 мин от начала проведения реанимационных мероприятий в полном объеме у ребенка отсутствует сердцебиение, реанимационные мероприятия в родильном зале следует прекратить. В остальных случаях сердечнолегочной реанимации новорожденного следует добиваться устойчивого повышения ЧСС более 100 ударов в минуту. После первичной стабилизации состояния ребенок транспортируется в палату интенсивной терапии на фоне продолжающейся ИВЛ.
Следующий этап реанимации включает переход на самостоятельное дыхание, профилактику вторичной гипоксии, коррекцию нарушений метаболизма.
Глубоко недоношенные дети вследствие дефицита сурфактанта не способны к созданию и поддержанию функциональной остаточной емкости легких, определяющей эффективный альвеолярный газообмен. По этой причине респираторная терапия этим детям проводится путем создания положительного давления в дыхательных путях (методика СРАР) и введения экзогенного сурфактанта. Из зарегистрированных в РФ препаратов экзогенного сурфактанта для профилактического и раннего терапевтического применения используется порактант альфа (куросурф♠). Профилактическое введение сурфактанта показано:
1)всем недоношенным, родившимся ранее 27-й недели беременности;
2)детям, родившимся на 27-29-й неделях беременности, матери которых не получили курс антенатальной профилактики дистресс-синдрома;
502
3) родившимся на 27-29-й неделях беременности, потребовавшим интубации трахеи в родильном зале.
Необходимым условием проведения оксигенотерапии, особенно у недоношенных детей, является непрерывный мониторинг оксигенации методом пульсоксиметрии с первой минуты жизни. Сатурация кислорода должна быть не менее 80% к 5-й минуте жизни и не менее 85% к 10-й минуте. Уровень сатурации не должен превышать 95% на любом этапе проведения реанимационных мероприятий.
Профилактика гипоксии плода и асфиксии новорожденного должна основываться на дородовой диагностике и состоять из следующих компонентов:
•своевременной госпитализации беременных групп повышенного риска развития гипоксии плода;
•интенсивной терапии акушерской и экстрагенитальной патологии беременных;
•досрочного родоразрешения при отсутствии эффекта от проводимой терапии гипоксии плода.
Показания к досрочному окончанию беременности находятся в прямой зависимости от ее срока. До 37-й недели беременности для принятия такого решения необходимы положительные результаты, по крайней мере, 2-3 исследований, свидетельствующих о гипоксии плода (например, низкий уровень выделения эстриола, данные ЭКГ и ФКГ).
В конце беременности для принятия решения о досрочном ее завершении достаточно положительного результата одного вида исследования, например амниоскопии. Досрочное родоразрешение предпочтительнее проводить через естественные родовые пути.
Контрольные вопросы
1.Сформулируйте определение понятия «асфиксия новорожденного».
2.Назовите причины асфиксии новорожденного.
3.Опишите оценку степени тяжести асфиксии новорожденного по шкале Апгар.
4.Назовите основные признаки, характеризующие состояние жизненно важных функций новорожденного.
5.Назовите методы, применяемые для оживления новорожденного при асфиксии.
ГЛАВА 41. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЕННОГО
Гемолитическая болезнь (ГБ) плода и новорожденного является заболеванием, возникающим в результате несовместимости крови матери и плода по некоторым антигенам, при котором происходит гемолиз эритроцитов плода под влиянием изоантител матери к антигенам эритроцитов плода.
На современном этапе развития иммуногематологии известно более 250 антигенов эритроцитов, которые принято распределять в 29 генетических независимых систем. Каждая система кодируется одним или несколькими генами. Антигены эритроцитов являются протеинами (система резус), гликопротеинами или гликолипидами (система АВ0).
В исследованиях последних лет было показано, |
что существуют всего два |
гена (RHD и RHCE),отвечающих за продукцию антигенов |
эритроцитов системы резус. |
|
503 |
Так, продукция антигена D контролируется геном RHD, в то время как интигенов C, с, E, е - геном RHCE. При этом большое количество антигенов, составляющих систему резус (48 антигенов), объясняется мутациями в этих двух генах. Отсутствуют данные о наличии антигена d, так как не имеется гена, отвечающего за синтез этого антигена.
Гемолитическая болезнь плода и новорожденного может быть обусловлена и другими, кроме D, антигенами системы резус, а также другими, так называемыми «иррегулярными», антигенами других систем или совокупностью нескольких антигенов одной системы. В этом случае для характеристики аллоиммунного процесса в литературе наиболее часто используют термин «эритроцитарная аллоиммунизация». Именно аллоиммунизация по антигенам эритроцитов является основной причиной развития у плода анемического синдрома.
Наибольшее клиническое значение в патогенезе тяжелых форм гемолитической болезни плода и новорожденного имеют антигены системы резус (Rhesus), насчитывающей 48 антигенов. Развитие резус-изоиммунизации возможно при беременности резус-отрицательной (d-отрицательной) матери резус-положительным плодом, т. е. при образовании в крови матери антител к антигенам эритроцитов плода системы резус. Подобная акушерская ситуация возникает при наличии у резусотрицательной женщины резус-положительного супруга.
Риск развития заболевания плода и новорожденного у резус-конфликтной супружеской пары, в которой мать имеет отрицательный резус-фактор, разный и зависит, прежде всего, от зиготности отца по Rh0 (D). Если отец является гомозиготным носителем Rh0 (D) (генотип DD), то все дети у резус-отрицательной матери (генотип dd) будут иметь резус-положительную кровь (генотип Dd). Если же отец в супружеской паре гетерозиготен (генотип Dd), то риск иметь резусположительную кровь у потомства составляет около 50%. Гомозиготными носителями Rh0(d) являются около 45% людей с резус-положительной кровью.
Этиология и патогенез. Конфликт вследствие изосерологической несовместимости матери и плода чаще всего развивается по антигенам эритроцитов Rh-Hr и АВ0.
Взависимости от этнической принадлежности частота резус-отрицательной принадлежности крови в популяции варьирует от менее 1% у китайцев, до 30% и более у басков. У европейцев частота в среднем составляет 15%.
Впатогенезе изоиммунизации можно выделить несколько последовательных
стадий:
•аллоиммунизация матери;
•трансплацентарный перенос антител к плоду;
•разрушение (гемолиз) клеток крови плода;
•развитие у плода клинических проявлений заболевания. Аллоиммунизация матери.Аллоиммунизация матери может явиться следствием двух основных причин:
•плодово-материнский трансплацентарный перенос эритроцитов плода в кровоток матери во время беременности и родов (основная причина);
•ятрогенная (встречается редко, связана с введением в организм резусотрицательной женщины резус-положительной крови при проведении ей в прошлом переливаний крови или при аутогемотерапии).
В течение I триместра физиологической беременности эритроциты плода проникают через плацентарный барьер у 3% беременных (их объем составляет около 0,03 мл). Число подобных случаев увеличивается во II триместре беременности (15%). В III
504
триместре беременности фетальные эритроциты можно обнаружить в кровотоке матери у 45% беременных. В родах объем трансплацентарных кровотечений достигает 30-40 мл.
Объем плодово-материнских трансфузий может значительно увеличиваться при наличии у беременной акушерских и экстрагенитальных заболеваний, которые сопровождаются повышением проницаемости плацентарного барьера (угроза прерывания беременности; гестоз; заболевания почек, гипертоническая болезнь, сахарный диабет и др.). В этих случаях в кровоток матери попадает больший объем эритроцитов плода, что может привести к раннему развитию заболевания.
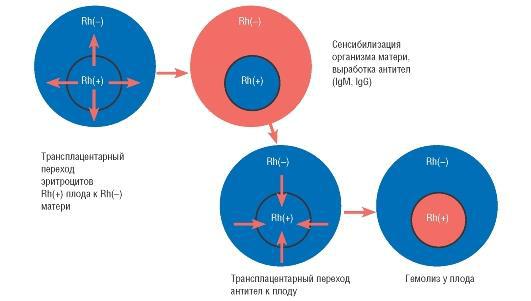
При попадании антигена в кровоток матери развивается гуморальный иммунный ответ, который зависит от того, первично или повторно попадает антиген в организм матери. Первичный иммунный ответ после попадания D-антигена в кровоток матери проявляется через определенное время - от 6 нед до 12 мес. Он состоит в появлении иммуноглобулинов класса М, молекулы которых имеют значительные размеры и не проникают к плоду через плацентарный барьер. Это объясняет отсутствие гемолитической болезни у плодов большинства первобеременных резус-отрицательных женщин. Вторичный иммунный ответ возникает, как правило, при повторной беременности. Для его развития достаточно 0,1 мл крови плода. Он характеризуется появлением антител в значительно более высоком титре. При этом образуются иммуноглобулины класса G, которые имеют меньшую, по сравнению с иммуноглобулинами класса М, молекулярную массу (схема 41.1). При этом иммуноглобулины класса G, образующиеся при вторичном иммунном ответе, состоят из четырех субклассов: IgG1, IgG2, IgG3, IgG4. Наиболее активными являются IgG1 и IgG3.
Схема 41.1. Основные этапы патогенеза гемолитической болезни плода
505
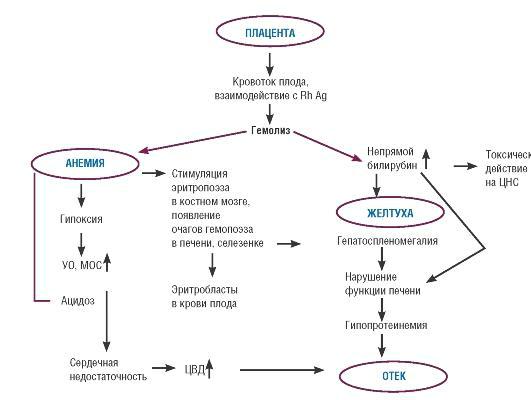
Схема 41.2. Основные звенья патогенеза гемолитической болезни плода
Трансплацентарный перенос антител к плоду, разрушение (гемолиз) клеток крови плода.Иммуноглобулины класса G свободно проникают через плацентарный барьер, взаимодействуют с соответствующими антигенами мембраны эритроцитов резусположительного плода, приводя к их гемолизу. Наиболее агрессивными являются IgG1 и IgG3. В большинстве случаев они обусловливают развитие гемолиза у плода.
Развитие у плода клинических проявлений заболевания. Массивное разрушение эритроцитов приводит к развитию анемии у плода, появление которой вызывает повышение концентрации эритропоэтина. Эритропоэтин стимулирует гемопоэз, появляются очаги экстрамедуллярного кроветворения, в основном в печени и селезенке плода, которые существенно увеличиваются в размере (схема 41.2). Усиленный гемопоэз характеризуется незавершенностью развития эритроцитов и появлением в циркуляции эритробластов.
Массивный гемолиз сопровождается образованием в большом количестве непрямого билирубина, который обладает выраженным токсическим действием на ткани, богатые липидами (мозг, печень). У плода непрямой билирубин выводится плацентой. Однако после рождения, в связи с прекращением плацентарного кровообращения и невозможностью выведения непрямого билирубина почками, высока вероятность его токсического действия на печень и головной мозг с развитием печеночной недостаточности и энцефалопатии.
Повышенная функциональная нагрузка на печень, неблагоприятное действие непрямого билирубина нарушает ее функции, в том числе синтез белка. Следствием этого процесса становятся гипопротеинемия, снижение онкотического давления плазмы крови, отеки и портальная гипертензия.
Развитие анемии у плода приводит к снижению кислородной емкости крови. Это, в свою очередь, влечет за собой усиление анаэробного гликолиза в тканях, ацидоз, снижение буферных резервов крови, повреждение эндотелия капилляров и развитие хронической гипоксии. На фоне хронической гипоксии и ацидоза возникает
506
компенсаторное увеличение сердечного выброса и минутного объема, приводящее к гипертрофии миокарда и постепенному развитию сердечной недостаточности и, как следствие, к повышению центрального венозного давления (ЦВД). Повышение ЦВД затрудняет ток лимфы по магистральным лимфатическим сосудам, вызывая нарушение оттока интерстициальной жидкости и увеличение ее онкотического давления. Весь комплекс происходящих патологических процессов вызывает накопление жидкости в тканях и серозных полостях плода, что клинически проявляется развитием у него генерализованного отека и при отсутствии соответствующего лечения приводит к внутриутробной гибели плода.
Понимание патофизиологии развития гемолитической болезни плода позволило разработать методы ее диагностики, лечения и профилактики.
Диагностика и ведение беременности при наличии резус-конфликтного брака. В диагностическом алгоритме заболевания и его прогнозе важное значение имеют данные акушерско-гинекологического анамнеза, особенности клинического течения настоящей беременности, наличие факта сенсибилизации беременной с определением классов и субклассов циркулирующих антиэритроцитарных антител, ультразвуковое исследование, оценка признаков гипердинамического типа кровообращения у плода с помощью допплерометрии кровотока в его средней мозговой артерии у плода, а также инвазивные методики, первостепенное значение из которых имеет пункция сосудов пуповины - кордоцентез.
Данные акушерско-гинекологического анамнеза позволяют оценить принципиальную возможность развития сенсибилизации. Риск развития заболевания повышают:
• отсутствие иммунопрофилактики при предыдущих беременностях, закончившихся искусственным или самопроизвольным абортом, родами или эктопической беременностью;
• гемолитическая болезнь плода и новорожденного при предыдущей беременности, в том числе анте-, интраили постнатальная гибель детей.
К группе риска по развитию гемолитической болезни плода также относят беременных, имеющих переливание крови (несовместимой по резус-фактору) или ее компонентов в анамнезе.
Особенности клинического течения настоящей беременности. К факторам риска аллоиммунизации при настоящей беременности относят:
• угрозу прерывания беременности, особенно если она сопровождается наличием кровянистых выделений из половых путей или формированием ретрохориальной гематомы;
•акушерские осложнения, нарушающие кровообращение в системе мать-плацента- плод (гестоз, в том числе с развитием плацентарной недостаточности);
•экстрагенитальные заболевания, способствующие увеличению проницаемости плацентарного барьера (заболевания сердечно-сосудистой системы, сахарный диабет и др.);
•инвазивные процедуры, проведенные во время беременности, особенно выполненные трансплацентарным доступом (хорионбиопсия, плацентобиопсия, амниоили
кордоцентез).
Определение в крови матери антиэритроцитарных антител. Суммарный титр антиэритроцитарных антител позволяет выявить факт наличия сенсибилизации.
507
При отсутствии антиэритроцитарных антител в крови беременной повторное исследование на их наличие выполняется в 28 нед беременности (перед осуществлением первого этапа иммунопрофилактики) или после акушерских осложнений и операций, которые могут усилить сенсибилизацию.
При обнаружении антиэритроцитарных антител, в сроки 18-24 нед беременности проводят их идентификацию с определением классов (IgМ, IgG) и субклассов (IgG1, IgG2, IgG3, IgG4). Клиническое значение имеет выявление IgG. Исследование в крови субклассов антиэритроцитарных антител позволяет сформировать группу риска сенсибилизированных беременных, имеющих риск развития у плода гемолитической болезни. Так, выявление в крови антител агрессивных субклассов (IgG1, IgG3) свидетельствует о высоком риске развития заболевания у плода и беременной рекомендуется наблюдаться у специалиста 1 раз в 2 нед. При выявлении неагрессивных субклассов антител (IgG2, IgG4) - 1 раз в месяц. При этом в процессе наблюдения осуществляется анализ ультразвуковых и допплерометрических маркеров гемолитической болезни плода, которые могли бы предоставить информацию о развитии заболевания и его тяжести. При появлении признаков гипердинамического типа кровообращения рекомендуется проведение операции внутриутробной трансфузии.
Ультразвуковое исследование позволяет выявить ряд признаков, характерных для заболевания плода:
•увеличение толщины и структуры плаценты;
•многоводие (не является специфическим признаком гемолитической болезни); при терминальной стадии заболевания может формироваться маловодие;
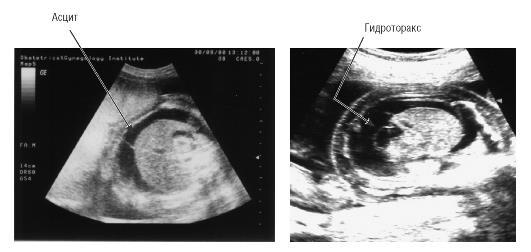
•отечный синдром у плода (асцит, гидроторакс, гидроперикард, анасарка);
•кардио-, сплено-, гепатомегалия (рис. 41.1).
Допплерометрическое исследование кровотока у плода позволяет выявить увеличение его скорости, обусловленное развитием анемического синдрома. Это является адаптивной реакцией, развивающейся на фоне снижения оксигенации и вязкости крови. Самую высокую чувствительность в диагностике анемии у плода имеет допплерометрия кровотока в средней мозговой артерии, поскольку в первую очередь адаптивные гемодинамические реакции наблюдаются в мозговой гемоциркуляции (рис. 41.2, 41.3).
Рис. 41.1. Ультразвуковые признаки гемолитической болезни плода
508
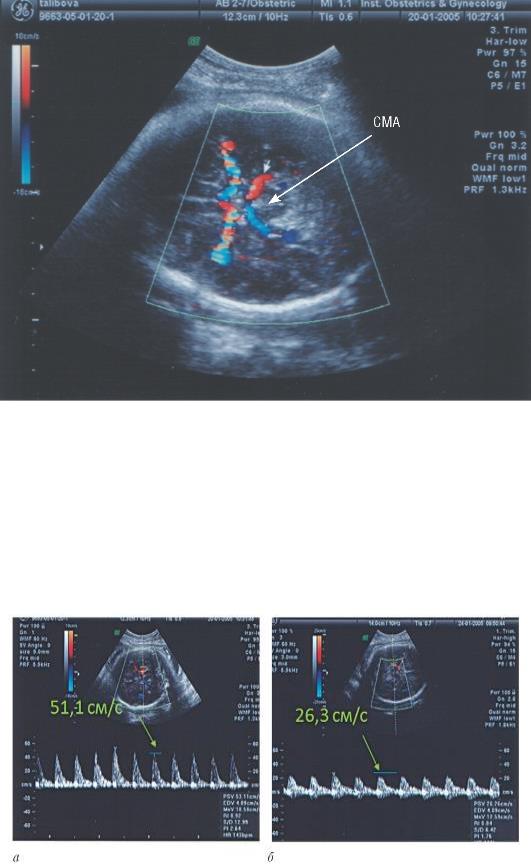
Рис. 41.2. Оценка кровотока в средней мозговой артерии (СМА) плода
Критерием тяжелой анемии у плода (до 35-й недели беременности), требующей проведения лечебных мероприятий, считают максимальную систолическую скорость кровотока в средней мозговой артерии, которая превышает физиологическую более чем в 1,5 раза (более 1,5 МоМ). МоМ - это кратность медиане (multiples of median), т. е. отношение величины максимальной систолической скорости кровотока у конкретной беременной к средней величине максимальной систолической скорости кровотока в эти сроки физиологической беременности. Именно при этих значениях начинает формироваться снижение гемоглобина в крови ниже 0,65 МоМ от среднего уровня, характерного для каждого срока беременности (табл. 41.1).
Рис. 41.3. Допплерометрия кровотока в средней мозговой артерии плода: а -при анемии плода; б- плод без анемии
509
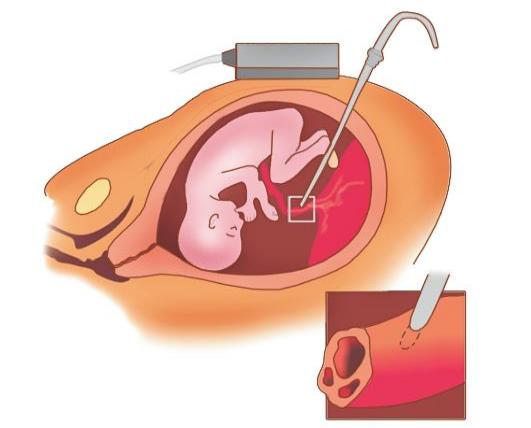
Таблица 41.1. Классификация степеней тяжести анемического синдрома у плода
(Mari G., 1995)
Степень тяжести анемии |
Гемоглобин, МоМ |
|
|
Легкая |
От 0,65 до 0,84 |
|
|
Средней степени |
От 0,55 до 0,65 |
|
|
Тяжелая |
Менее 0,55 |
|
|
Кардиотокография. Метод используется для антенатального мониторинга функционального состояния плода во второй половине беременности, а также для контроля функционального состояния плода при проведении инвазивных вмешательств (амниоцентеза, кордоцентеза).
Характер и анализ кардиотокограмм при отсутствии тяжелых форм изоиммунизации не отличается от таковых, проводимых при другой акушерской патологии. При тяжелых формах изоиммунизации с развитием тяжелой анемии кривая сердечного ритма плода может приобретать специфическую синусоидальную форму.
Амниоцентез - пункция амниотической оболочки с целью получения околоплодных вод. При гемолитической болезни плода в околоплодных водах увеличивается содержание билирубина, о котором судят по величине оптической плотности околоплодных вод при помощи спектрофотометрии. На основании величины оптической плотности околоплодных вод ранее были предложены классификации степени тяжести заболевания (модифицированная шкала А. Liley, 1960). Однако этот метод дает большое количество ложноположительных и ложноотрицательных результатов, поэтому в настоящее время в практике широко не используется.
Рис. 41.4. Кордоцентез
510
