
Лабораторные работы по физике / Оптика / Lab_110
.docСопоставление формул (6) и (22) показывает, что формула Бальмера - Ридберга (6) является частным случаем формулы Бора. В самом деле, положив в (22) значение Z = 1, найдем:
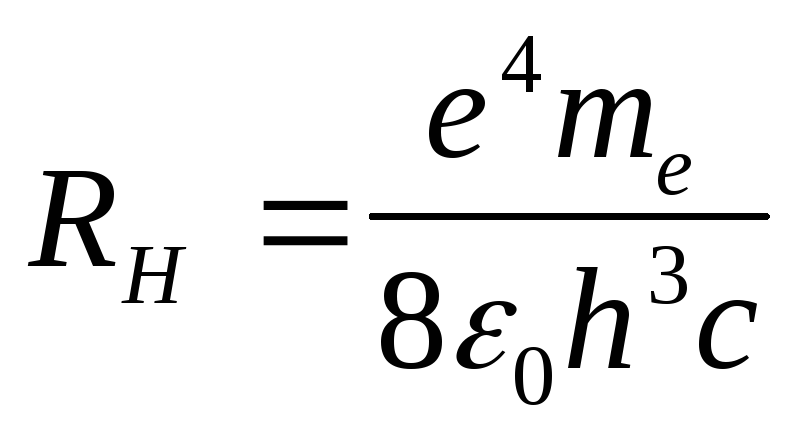 .
(24)
.
(24)
Полагая
в (22) значение m
= 2 и
![]() легко
убедится, что (22) в этом случае тождественно
совпадает с формулой (6).
легко
убедится, что (22) в этом случае тождественно
совпадает с формулой (6).
Рассмотрим главнейшие следствия из полученных результатов. Прежде всего, воспользуемся формулой (24) для вычисления значения величины постоянной Планка h.
Заметим что в системе СИ величины, входящие в (24) имеют следующие численные значения:
заряд
электрона
![]()
масса
электрона
![]()
скорость
света
![]()
электрическая
постоянная
![]()
постоянная
Ридберга
![]() .
.
Подставляя эти величины в (24) найдем:
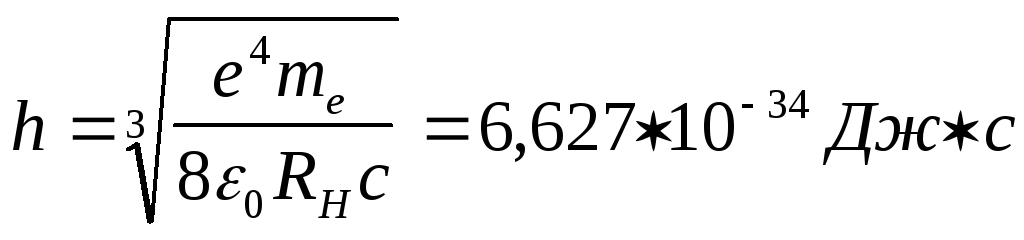 . (26)
. (26)
Весьма
интересен результат использования
формулы (19) для вычисления радиуса орбиты
нормального атома водорода. В самом
деле, подставляя в эту формулу Z
=
1, n
= 1 и
используя значения постоянных, приведенных
в (25), (26) найдем что радиус
![]() ,
который часто обозначается через
,
который часто обозначается через
![]() ,
будет равен :
,
будет равен :
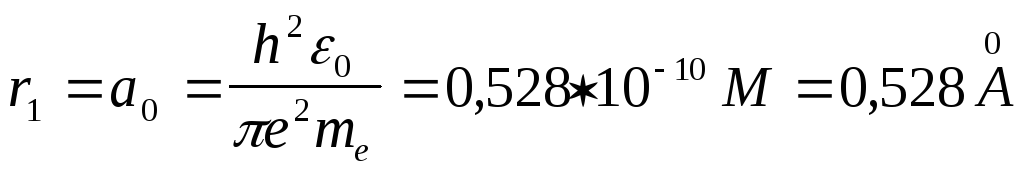 .
(27)
.
(27)
Кинетическая
теория газов, как известно, дает значение
![]() .
Это также указывает на хорошее согласование
рассматриваемых значений
.
Это также указывает на хорошее согласование
рассматриваемых значений
![]() ,
полученных в результате применения
совершенно независимых методов расчета.
,
полученных в результате применения
совершенно независимых методов расчета.
Если
же значение
![]() известно, то из формулы (19) сразу
получается, что радиусы
квантовых орбит водородоподобных атомов
оказываются пропорциональными квадратам
главных квантовых чисел этих орбит и
обратно пропорциональна зарядам
(порядковым номерам Z)
атомов:
известно, то из формулы (19) сразу
получается, что радиусы
квантовых орбит водородоподобных атомов
оказываются пропорциональными квадратам
главных квантовых чисел этих орбит и
обратно пропорциональна зарядам
(порядковым номерам Z)
атомов:
![]() .
(28)
.
(28)
Далее, обратим особое внимание на совпадение формулы Бора (22) с формулой Бальмера- Ридберга (6) при условии Z = 1, m = 2. Это значит, что спектральные линии Бальмера отмечают квантовые перескоки электрона атома водорода с орбиты n на орбиту m = 2, где n=3,4,5..... Но тогда необходимо придти к выводу, что, подставляя в формулу Бора (21) значения m = 1 и n ³ 2 можно получить закономерности новых спектральных серий спектра атомов водорода. Именно такие серии и были найдены в спектре атомов водорода. Так, открытая Лаймоном, и поэтому названная его именем, СЕРИЯ ЛАЙМОНА объединяет спектральные линии спектра атомов водорода, лежащие в ультрафиалетовой области; для этой серии m = 1, n ³ 2. СЕРИЯ ПАШЕНА объединяет спектральные линии того же спектра, лежащие в ближайшей инфракрасной области; для этой серии m = 3, n ³ 4. В более далекой инфракрасной области расположены СЕРИЯ БРЕККЕТА, для которой m = 4 и n ³ 5, и СЕРИЯ ПФУНДА, для которой m = 5, n ³ 6.
На рис.3 изображены линии всех перечисленных спектральных серий атомов водорода, а на рис.4 дана энергетическая схема, поясняющая их происхождение. Такого рода схема значительно удобнее для изображения квантовых переходов излучающего фотоны электрона “с орбиты на орбиту”. Так как согласно формуле (28), радиусы орбит пропорциональны величинам n2, т.е. вырастают в геометрической прогрессии с ростом квантовых чисел n = 1,2,3..., то на рисунке трудно уместить большое число орбит.
Схема рис.4 строится с учетом того, что энергия, соответствующая орбите, характеризуемой квантовым числом, может быть выражена в электрон-вольтах. При этом следует вспомнить, что:
![]() (29)
(29)
Поэтому,
с учетом (25) величину
![]() ,
определяемую формулой (20) можно представить
в таком виде:
,
определяемую формулой (20) можно представить
в таком виде:
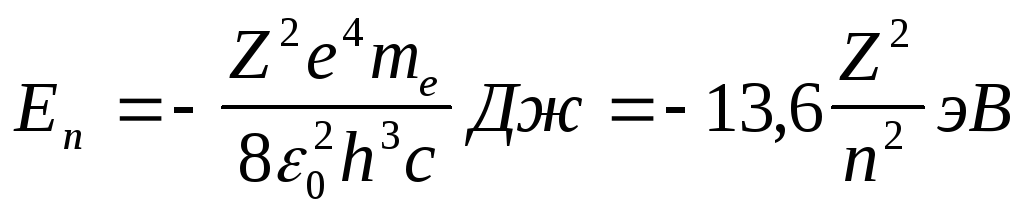 .
(30)
.
(30)
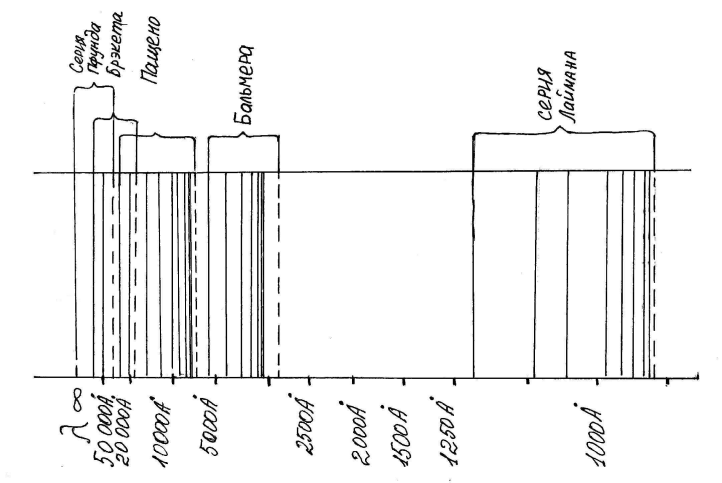
Рис..3
Значениям
Z
= 1 и
n
= 1 соответствует
энергия
![]() .
.
Эта величина называется НАИНИЗШИМ ЭНЕРГИТИЧЕСКИМ УРОВНЕМ ЭЛЕКТРОНА В АТОМЕ ВОДОРОДА. Знак “минус”, как отмечалось выше, означает необходимость затраты работы на ионизацию, так как электрон притягивается к ядру атома. Другими словами, можно сказать, что для удаления электрона из нормального атома водорода требуется работа, равная 13.6 электрон-вольта. Такая работа называется ЭНЕРГИЕЙ ИОНИЗАЦИИ, или сокращенно ПОТЕЦИАЛОМ ИОНИЗАЦИИ.
Энергетические
уровни электрона в атоме водорода,
представленные на схеме рис.4 горизонтальными
линиями, вычислены по соотношению (30),
в которое подставлены значения Z
= 1 и
n
= 1,2,3,… . На
левой от наблюдателя стороне схемы
нанесена шкала энергий в электрон-вольтах.
Величины
![]() показывают работу, которую надо затратить,
чтобы удалить электрон из атома с уровня
n.
Вертикальные линии выражают переходы
между различными уровнями, причем их
длина выражает энергию перехода.
показывают работу, которую надо затратить,
чтобы удалить электрон из атома с уровня
n.
Вертикальные линии выражают переходы
между различными уровнями, причем их
длина выражает энергию перехода.

Рис.4
ОПИСАНИЕ УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ.
Принципиальная схема монохроматора УМ-2 показана на рис.5. Он имеет коллиматор К0, призму П, зрительную трубу Ка и барабан Б, имеющий винтовую канавку, по которой при его вращении движется ползунок А, снабженный отсчетной риской. Свет от источника S попадает в коллиматор К0 через щель, которая находится в фокусе объектива О1. Призма имеет особую структуру: она склеена из трех отдельных призм “а”, “б” и “в”, из которых призмы “а” и “в” имеют преломляющий угол 30О, а промежуточная призма “б” является призмой “полного внутреннего отражения”. Выходящий из коллиматора луч падает на призму “а” и разлагается в спектр, который представляет собой ряд цветных монохроматических линий. Эти спектральные линии падают под разными углами на основании призмы “б”, отражаются от него и попадают в призму “в”. В призме “в” спектральные линии еще больше расходятся, после чего попадают в зрительную трубу Ка, снабженную окуляром О2, образуя спектр КФ.
Особенностью структуры рассматриваемого прибора является возможность посылать лучи различных длин волн вдоль оси зрительной трубы при повороте призмы П. С этой целью столик с призмой сделан поворотным, а коллиматор и зрительная труба жестко связаны между собой, располагаясь под углом 90О друг к другу. Поворот столика с призмой осуществляется при повороте барабана Б. Положение призмы фиксируют по шкале барабана в условных единицах.
В центре поля зрения трубы Ка есть указатель в виде вертикальной стрелки. Вращая с помощью барабана столик с призмой, можно направлять лучи той или иной длины волны вдоль оптической оси зрительной трубы для совмещения нужного участка спектра с указателем.
Для того чтобы можно было пользоваться таким спектрометром, необходимо его проградуировать, т.е. поставить в соответствие положение барабана и длину волны света, совпадающего с указателем зрительной трубы. Градуировку производят, используя источник линейчатого спектра, длины волн отдельных линий которого известны с достаточной точностью. По результатам такой градуировки строят градуировочную кривую l = f(x,дел). Затем, при изучении “неизвестного” спектра, по местоположению соответствующих линий этого спектра определяют их длину волны.
Градуировочная (дисперсионная) кривая спектрометра имеет нелинейный характер. Это говорит о том, что одна область спектра “растянута”, а другая - “сжата”. Это, в свою очередь, означает, что одинаковому интервалу длин волн Dl в разных частях спектра соответствуют разные углы поворота барабана Б. Степень сжатия или растяжения различных участков спектра принято характеризовать линейной дисперсией (Dx = Dx/Dl) или фактором дисперсии (KD = 1/ Dx =Dl/Dx). Эти величины можно легко определить по градуировочной кривой. Для этого на градуировочной кривой выбирают не менее пяти точек, затем в окрестности каждой точки выбирают небольшой интервал длин волн Dl и определяют соответствующий ему интервал делений на шкале барабана Dx, как показано на рис. 6.
 П
П
К0 S
“а”
“б”
“в”
Б
О1
Ка
ф А
к
О2
Рис. 5
В данной работе градуировочную кривую используют для определения длин волн серии Бальмера в спектре атома водорода. Серия Бальмера - единственная серия в спектре атома водорода, несколько линий которой лежат в видимой области спектра, которые можно наблюдать визуально.
Для серии Бальмера справедлива формула:
![]() ,
(31)
,
(31)
где
![]() - волновое число равное обратной величине
длины волны (1/l),
RH
- постоянная Ридберга для атома водорода,
2 -
номер энергетического уровня, на который
осуществляется переход электрона,
n
- номер энергетического уровня, с которого
осуществляется переход электрона. При
этом n
целое число >
2. Тогда красная линия водорода Нa
образуется в результате перехода
электрона с уровня n
= 3, зелено-голубая линия Нb
- с уровня n
= 4, фиолетовая Нg
- с уровня n
= 5 и слабая фиолетовая Нd
- с уровня n
= 6. Зная длины волн указанных линий легко
рассчитать значение постоянной Ридберга
по формуле:
- волновое число равное обратной величине
длины волны (1/l),
RH
- постоянная Ридберга для атома водорода,
2 -
номер энергетического уровня, на который
осуществляется переход электрона,
n
- номер энергетического уровня, с которого
осуществляется переход электрона. При
этом n
целое число >
2. Тогда красная линия водорода Нa
образуется в результате перехода
электрона с уровня n
= 3, зелено-голубая линия Нb
- с уровня n
= 4, фиолетовая Нg
- с уровня n
= 5 и слабая фиолетовая Нd
- с уровня n
= 6. Зная длины волн указанных линий легко
рассчитать значение постоянной Ридберга
по формуле:
![]() .
(32)
.
(32)
Постоянную Ридберга для атома водорода можно вычислить и через “мировые константы” по формуле:
l
l1
Dl1
 1
1
l2
Dl2
2
Dx2 Dx1
Рис. 6
![]() .
(32)
.
(32)
Постоянную Ридберга для атома водорода можно вычислить и через “мировые константы” по формуле:
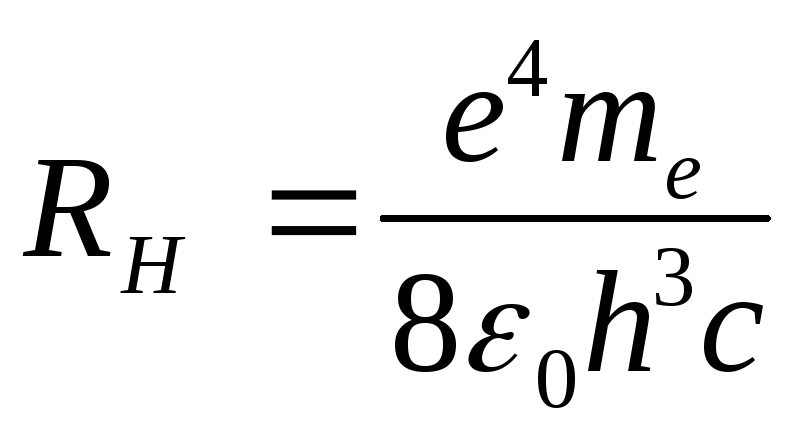 ,
(33)
,
(33)
где:
е =1,6.10-19 Кл - заряд электрона,
me = 9,1.10-31 кг - масса электрона,
с = 2,99793.108 м/с - скорость света в вакууме,
h = 6,62.10-34 Дж.с - постоянная Планка,
e0 = 8,85.10-12 Ф/м - электрическая постоянная вакуума.
Порядок выполнения работы.
Задание 1.Градуировка шкалы спектрометра.
1.Включите в качестве источника света, спектр которого известен, ртутную лампу. Длины волн ртутных линий даны в таблице 1.
2.Наблюдая в окуляр зрительной трубы линейчатый спектр ртути найдите в нем линии, указанные в таблице 1. (Они должны быть наиболее яркими среди линий одного цвета). Вращением барабана, начиная с красной линии, последовательно подводите выбранные линии к стреле указателя и делайте отсчет по барабану. Эти отсчеты занесите в таблицу 1.
3.По
данным таблицы 1 постройте на миллиметровой
бумаге градуировочный график и сделайте
построения, показанные на рис. 6. Определите
значения Dli
и
Dxi
и занесите их в таблицу 2. При этом
интервал Dli
для всех точек должен быть одинаковым.
Вычислите значения линейной дисперсии
Di
= Dxi/Dli
в дел/![]() и фактора дисперсии КD
= Dli/Dxi
в
и фактора дисперсии КD
= Dli/Dxi
в
![]() /дел.
Запишите полученные результаты в таблицу
2 и постройте на миллиметровой бумаге
график зависимости D
= f(l).
Из этого графика должно следовать, что
линейная дисперсия не является постоянной
величиной.
/дел.
Запишите полученные результаты в таблицу
2 и постройте на миллиметровой бумаге
график зависимости D
= f(l).
Из этого графика должно следовать, что
линейная дисперсия не является постоянной
величиной.
Задание 2. Определение длин волн линий серии Бальмера в спектре атома водорода.
1.Выключите ртутную лампу и поставьте перед входной щелью спектрометра водородную газоразрядную трубку.
2.Наблюдая в окуляр зрительной трубы линейчатый спектр атома водорода, найдите в нем красную линию Нa и запишите отсчет по барабану в таблицу 3. Затем, вращением барабана последовательно подведите к стрелке указателя линии Нb, Нg, Нd и запишите соответствующие отсчеты в таблицу 3. Зная значения отсчетов для каждой линии спектра атома водорода, по градуировочной кривой спектрометра определите длины этих волн и их значения запишите в таблицу 3.
3.Зная длины волн указанных линий серии Бальмера, вычислите по формуле (32) для каждой из них значение постоянной Ридберга RH и запишите в таблицу 3.
4.Вычислите среднее значение полученной вами постоянной Ридберга. Затем определите значение постоянной Ридберга по формуле (33).
Таблица 1
|
Цвет линии в спектре ртути |
Длина
волны линии ( |
Показания шкалы в делениях (xi) |
|
Ярко-красная |
6234 |
|
|
Желтая |
5780 |
|
|
Светло-зеленая |
5460 |
|
|
Светло-голубая |
4916 |
|
|
Синяя |
4358 |
|
|
Фиолетовая |
4062 |
|
Таблица 2
|
li( |
Dli( |
Dxi (дел) |
Dxi/li
(дел/ |
Dli
/
Dxi
( |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3
|
Знак линии |
n |
Деления шкалы |
Длина
волны ( |
Волновое
число ( |
RH
( |
|
Нa |
|
|
|
|
|
|
Нb |
|
|
|
|
|
|
Нg |
|
|
|
|
|
|
Нd |
|
|
|
|
|
Полученные значения сравните между собой и со значением этой величины, известной из справочников.
Вопросы для допуска к работе.
1.Какие виды спектров вы знаете?
2.Что общего и чем отличаются спектры испускания и спектры поглощения?
3.Сформулируйте постулаты Бора.
4.Что значит проградуировать спектрометр?
5.С какими спектрами вы будете иметь дело в работе?
6.Как вы должны градуировать спектрометр?
7.Как определить длину волны линии в исследуемом спектре?
Вопросы для защиты работы.
1.В чем заключаются сериальные закономерности в атомных спектрах?
2.Что общего между линиями одной серии?
3.Модели строения атома и их недостатки.
4.Вывод формулы радиуса орбиты в водородоподобном атоме.
5.Вывод формулы полной энергии электрона на орбите в водородоподобном атоме.
6.Вывод формулы для расчета постоянной Ридберга для атома водорода.
7.Вывод формулы Бальмера-Ридберга.
Методические указания к лабораторной работе по разделу “Оптика”. “Изучение линейчатых спектров”.
Автор: к.ф-м.н. Родэ Сергей Витальевич
Лицензия ЛР №021296 от 18.06.1998
Подписано к печати.................. № заказа............
Формат 60 х 88 1/16 МГУДТ, 113806
Бумага....................... ул. Садовническая, 33
Печать офсетная Типография МГУДТ, 113806
Объем в усл. печ. л. ................ ул. Садовническая, 33
Тираж...300........экз.
