
4. Тройная точка
В однокомпонентном веществе кривая испарение – конденсация имеет конец в виде критической точки. Кривая «плавление – кристаллизация», а также кривые перехода между кристаллическими состояниями, различной структуры, могут либо уходить в бесконечность, либо заканчиваться тройной точкой.
Тройной, на диаграмме Р – Т, называют точку, в которой возможно равновесие трех фаз однокомпонентного вещества.
Правило фаз Гиббса: в веществе, состоящем из k компонентов, одновременно могут существовать не более k + 2 равновесных фаз , т. е.
k + 2.
Из правила фаз Гиббса следует, что однокомпонентное вещество в равновесии не может иметь более трех фаз. Например, пар, вода и лед могут находиться в равновесии при давлении 6,09103 бар при температуре t = + 0,01 оС (рис. 4).
Рис.
4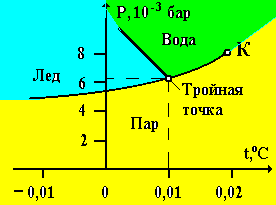
Так как тройным точкам соответ-ствует вполне определенная температура, то их используют в качестве стандартных (реперных) точек температурной шкалы.Из фазовой Р – Т диаграммы (рис. 4) видно, что вещество при нагревании не обязательно должно проходить стадию жидкого состояния для того, чтобы превратиться в газ. При нагревании до давления ниже тройной точки, твердое тело непосредственно переходит в газ (сублимация, или возгонка). Кривая равновесия фаз «жидкость – газ» заканчивается критической точкой К. Для переходов между жидкими и твердыми фазами существование критической точки невозможно из-за анизотропии кристаллической структуры. Поэтому кривая плавления продолжается неограниченно. Кривые равновесия «твердое тело – газ» уходят в начало координат (0 К), т. е. при абсолютном нуле температуры вещество при любом давлении находится в твердой фазе (исключение составляет гелий, который переходит в твердое состояние при давлении Р = 25 атм и Т 0 К). Фазовые диаграммы могут иметь несколько тройных точек, что связано с наличием нескольких модификаций вещества в твердом состоянии (полиморфизм).
На рис. 5 приведена фазовая диаграмма воды в координатах Р – t.
Рис.
5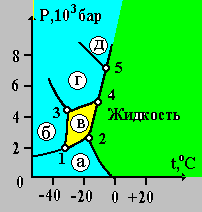
6. Эффект Джоуля – Томсона
Рассмотрим процесс, при котором газ или жидкость медленно перетекает под действием постоянного перепада давления сквозь пористую перегородку при теплоизоляции с окружающей средой (адиабатическое дросселирование).
В опытах Джоуля и Томсона измерялась температура в двух сечениях непрерывного и стационарного потока газа (до и после пористой перегородки). В результате трения газа при прохождении перегородки скорость газового потока была малой и кинетическая энергия практически не изменялась.
Газ, первоначально занимавший объем V1 при давлении Р1, перетекает сквозь перегородку, занимая объем V2 при давлении Р2 (рис. 6).
Рис. 6
При прохождении газом перегородки происходит замедление теплового движения его молекул и температура понижается.
Расширение газа в условиях адиабатического дросселирования не меняет его внутренней энергии, но вызывает увеличение потенциальной энергии взаимодействия молекул (расстояние между молекулами увеличивается) за счет кинетической энергии.
