
Уср энз 2
.docx
 УЧРЕЖДЕНИЕ
ОБРАЗОВАНИЯ
УЧРЕЖДЕНИЕ
ОБРАЗОВАНИЯ
”ПОЛЕССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ“
Факультет биотехнологический
Кафедра биохимии и биоинформатики
УПРАВЛЯЕМАЯ САМОСТОЯТЕЛЬНАЯ РАБОТА № 2
на тему:
Структура ферментов. Активный центр фермента
Подготовил |
|
Децук Валерия Петровна |
|||
Студент 2 курса, гр.22БХ-1 |
(подпись) __________________2023 |
||||
|
|
|
|
||
Проверил |
|
Аль Меселмани Моханад Али |
Доцент |
(подпись) ___________________2023 |
|
ПИНСК 2023
Оглавление
Глава 1. Структура ферментов 3
Глава 2. Активный центр фермента 5
Заключение 9
Глава 1. Структура ферментов
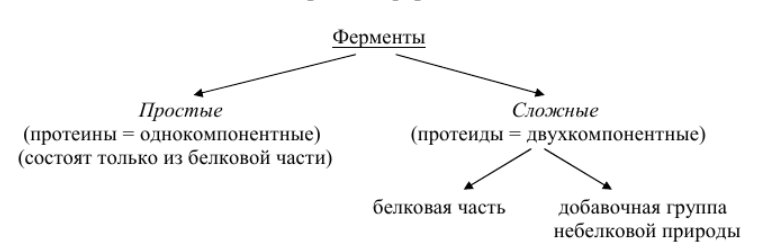 По
своей структуре ферменты разделяются
на простые и сложные.
По
своей структуре ферменты разделяются
на простые и сложные.
Схема 1 – Виды ферментов
Ферменты – это белковые катализаторы, которые ускоряют химические реакции, происходящие в организмах. Они играют важнейшую роль в множестве биологических процессов, таких как пищеварение, дыхание, обмен веществ и синтез молекул.
Структура ферментов особенно важна для понимания их функций и регуляции. Ферменты состоят из аминокислотных цепей, которые сворачиваются в определенную трехмерную форму. Часто ферменты состоят из нескольких подцепей, называемых субъединицами, связанных вместе.
Одной из важных частей структуры фермента является активный центр – это участок, который связывает субстрат, то есть молекулу, на которую фермент действует, и участвует в передаче сигналов для катализа реакции. Активный центр обычно состоит из аминокислотных остатков, которые образуют глубокую впадину или факторию во внутренней части фермента.
Для своей работы ферменты требуют определенных условий, таких как определенный pH и температура. Они способны катализировать химические реакции без самих участвующих в них ферментов не изменяя самих себя, позволяя использовать их многократно.
Одной из особенностей структуры ферментов является их специфичность. Каждый фермент обладает определенной субстратной специфичностью, что означает, что он может связываться только с определенными типами молекул и проводить реакции только с ними. Это связано с формой активного центра и особыми взаимодействиями между ним и субстратом.
Кроме активного центра, структура ферментов также включает в себя другие области, такие как аллостерические сайты, которые могут влиять на активность фермента, и домены, определяющие его трехмерную форму. Ферменты также могут содержать кофакторы и коферменты, которые помогают им выполнять свои функции.
Общая структура фермента определяется его последовательностью аминокислот в молекуле, а также его сворачиванием в определенную форму. Для изучения структуры фермента используются методы, такие как рентгеноструктурный анализ, ядерное магнитное резонансное спектроскопия и другие.
Глава 2. Активный центр фермента
Активный центр - из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
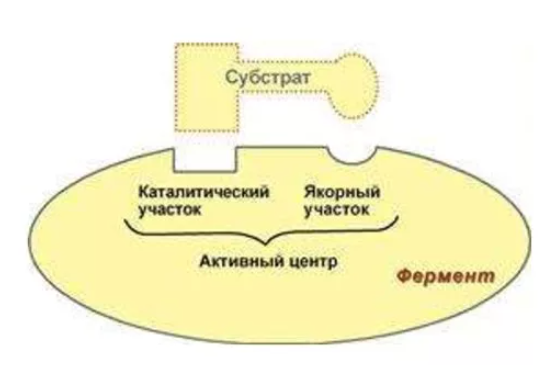
Рисунок 1 – строение активного центра фермента
В его пределах различают Адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр.
Каталитический центр - область активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата.
Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи.
Если фермент является сложным белком, то в формировании кат. центра участвует простетическая группа молекулы фермента (кофермент).
Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Адсорбционный центр - участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата.
Формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром.
Функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра).
Сорбция происходит только за счет слабых типов связей и потому является обратимой.
По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.
Структура адсорбционного центра определяет субстратную специфичность фермента, т. е. требования фермента к молекуле химического вещества, чтобы она могла стать для него подходящим субстратом.
Некоторые вещества, обладающие подходящими характеристиками (т. е. похожие на субстрат), могут тоже связываться с адсорбционным центром фермента. Но если в их молекуле нет такой химической связи, на которую может воздействовать каталитический центр данного фермента, то химических превращений этого вещества не произойдет.
Занимая активный центр фермента, такие молекулы блокируют его работу, т. е. являются обратимыми ингибиторами данного фермента (обратимыми, потому что связаны с ферментом слабыми типами связей).
Повышая концентрацию субстрата, их можно вытеснить из адсорбционного центра. Поэтому такие ингибиторы - конкурентными. Они конкурируют с истинным субстратом данного фермента за обладание его адсорбционным центром.
Аллостерическими центрами - такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит - обратимо) с тем или иным веществом (лигандом).
связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу.
такие вещества - аллостерическими активаторами или аллостерическими ингибаторами данного фермента.
Термин "аллостерический" (т. е. "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента (и потому не могут связываться с активным центром фермента). Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.
не у всех ферментов.
есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ.
некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
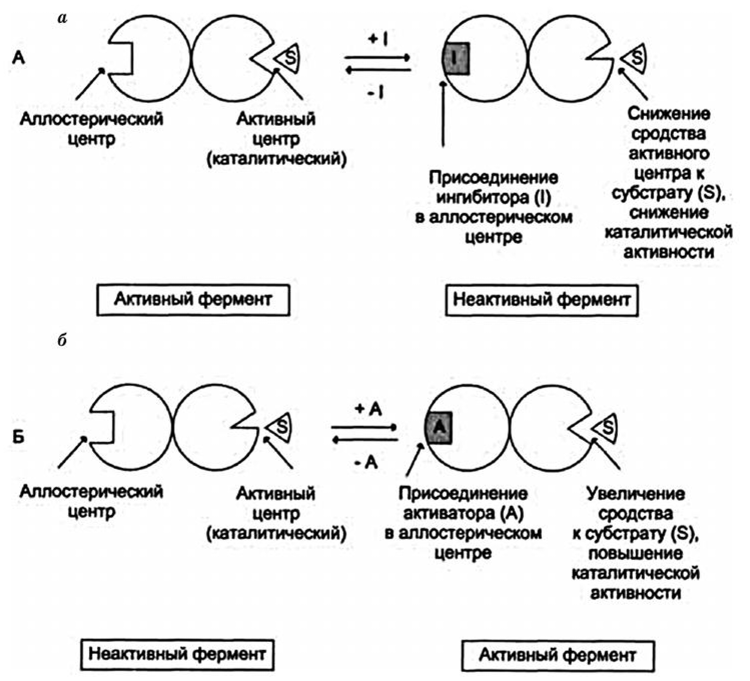
Рисунок 2 – механизм действия аллостерического центра
Специфичность к субстрату обусловлена комплементарностью структуры субстратсвязывающего центра фермента структуре субстрата.
Как показывае, субстратсвязывающий участок по форме соответствует субстрату (геометрическое соответствие), более того, между аминокислотными остатками активного центра фермента и субстратом образуются специфические связи (гидрофобные, ионные и водородные), т.е. устанавливается электронное или химическое соответствие.
Заключение
Структура фермента является сложной и разнообразной. Она включает в себя активные центры, специфические для каждого фермента, аллостерические сайты, домены и другие области. Ферменты играют важную роль во многих биологических процессах, и их структура определяет их функции и регуляцию. Изучение структуры ферментов позволяет лучше понять их работу и применение в различных областях науки и промышленности.
Наиболее важной частью фермента является активный центр. Активный центр фермента обычно взаимодействует со своим субстратом в специфичной манере, образуя комплекс фермента-субстрата, что позволяет провести необходимые химические превращения. После завершения реакции продукты покидают активный центр, и фермент готов к проведению следующей реакции.
Таким образом, можно сказать, что активный центр фермента играет ключевую роль в проведении катализируемых им реакций и обеспечивает эффективность и специфичность ферментативных процессов.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
Аль Меселмани, М.А. Энзимология : специальность 1-31 01 02– «Биохимия» [Электронный ресурс] : электронный учебно-методический комплекс / М.А. Аль Меселмани; УО "Полесский государственный университет". – Пинск : ПолесГУ, 2022. – 119 с.
Березов, Т. Т. Биологическая химия : учебник / Т. Т. Березов, Б. Ф. Коровкин. - 3-е изд., перераб. и доп. - М. : Медицина, 2012 - 704 с. ISBN 978-5-2251-00131
Ферменты. Классификация и номенклатура: учеб. пособ. Ч.III. / В.А. Смирнов, Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2008 – 42 с.
Основные понятия биохимии. Ферменты:учебное пособие для иностранных студентов /А. И. Суслова, В. И. Бахтаирова; ГБОУ ВПО ИГМУ Минздрава России, Кафедра химии и биохимии. – Иркутск: ИГМУ, 2014 –41с.
Артемук Е.Г., Королько А.В. Ферменты: учебное пособие/ Артемук Е.Г., Королько А.В. УО «Бресткий государственный университет им. А.С. Пушкина». - Брест, 2010.- 31 с.
