
- •Радиология и радиобиология. Предмет и задачи с/х радиобиологии и связь с другими науками.
- •Элементы ядерной физики. Строение атома. Физическая характеристика элементарных частиц, входящих в состав атома
- •Изотопы, изобары, изомеры. Стабильные и нестабильные изотопы.
- •Явление радиоактивности. Естественная и искусственная радиоактивность.
- •Радиоактивные излучения. Их виды и характеристика (природа, заряд, энергия, пробег).
- •Типы ядерных превращений.
- •Закон радиоактивного распада. Активность радиоактивного элемента и единицы активности.
- •Искусственные преобразования атомных ядер.
- •Взаимодействие альфа- и бета-излучений с веществом. Закон ослабления пучка бета-частиц. Слой половинного ослабления бета-частиц в веществе. Обратное рассеивание. Самопоглощение.
- •Виды взаимодействия гамма-излучения с веществом. Закон поглощения пучка гамма-излучения.
- •Основные эффекты взаимодействия нейтронов с веществом. Наведенная радиоактивность. Защита от ионизирующих излучений.
- •Понятие о радиометрии и дозиметрии, их цели и задачи.
- •Доза излучения, их виды и мощность. Единицы измерения доз и мощности дозы.
- •Относительная биологическая эффективность различных видов излучений. Коэффициент качества.
- •Расчет доз при внешнем и внутреннем облучении. Связь между активностью источника и дозой излучения.
- •Методы обнаружения и регистрации ионизирующих излучений. Ионизационные методы детектирования ионизирующих излучений.
- •Ионизационная камера.
- •Устройство и классификация счетчиков.
- •Сцинциляционный метод регистрации и измерения ионизирующих излучений. Разновидности сцинциляционных методов. Сцинтиллирующие кристаллы, сцинтиллирующие жидкости.
- •Полупроводниковые детекторы ионизирующих излучений.
- •Фотографичский, химический, калориметрический методы регистрации ионизирующих излучений.
- •23. Радиометрические приборы, их назначение и принципиальные узлы устройства. Классификация.
- •24. Спектрометрические методы радиационного контроля.
- •25. Отбор и подготовка проб к радиационному контролю.
- •26. Гаммаспектрометрические методы
- •27. Бета-спектрометрические методы
- •28. Альфаспектрометрические методы
- •29. Радиохимические методы радиационного контроля
- •30. Дозиметрические приборы. Их назначение и принципиальные узлы устройства. Классификация.
- •31. Основные методы измерения радиоактивности (абсолютный, расчетный, относительный)
- •32. Естественные источники ионизирующих излучений и радиоактивных загрязнений внешней среды.
- •33. Искусственные источники ионизирующих излучений.
- •34. Общие закономерности перемещения радиоактивных веществ в биосфере.
- •35. Радиоэкология и её задачи.
- •Физико-химическое состояние радионуклидов в воде, почве, кормах
- •37. Закономерности метаболизма радионуклидов в организме животных.(в уч не нашла)
- •38. Источники и пути поступления радиоактивных изотопов в организм.
- •39. Типы распределения радионуклидов в организме.
- •40. Накопление и выведение радионуклидов из организма. Понятие о критическом органе.
- •41. Эффективный период полувыведения. Ускорение выведения радиоактивных веществ из организма.
- •42. Группы радиотоксичности.
- •45) Основные факторы, обуславливающие токсичность радионуклидов.
- •46) Предельно допустимые концентрации радионуклидов в кормах для продуктивных животных. (Бк/кг или Бк/л)
- •47) Допустимые уровни содержания радионуклидов в продуктах и сырье животноводства, полученных от животных и птиц, содержащихся на загрязненной территории.
- •48) Пути использования кормов, животных и продукции животноводства, загрязненных радионуклидами.
- •49) Основные задачи радиационного мониторинга апк. (Арбитражный процессуальный кодекс)
- •50) Основные принципы организации радиационного мониторинга апк в аварийных ситуациях.
- •51) С помощью каких средств и технологических приемов можно добиться снижения содержания радионуклидов в организме животных и получаемой продукции?
- •52) Каковы принципы нормирования поступления радионуклидов в организм с/х животных?
- •53) Режим питания и содержания животных при радиоактивном загрязнении среды.
- •54) Использование веществ, ускоряющих выведение радионуклидов из организма животных.
- •55) Пути использования кормовых угодий, кормов, животных и продукции животноводства, загрязненных радионуклидами.
- •56) Современные представления о механизмах биологического действия излучений на молекулярном и клеточном уровнях.
- •57) Прямое и непрямое действие ионизирующих излучений.
- •58) Радиочувствительность и радиорезистентность.
- •59) Влияние ионизирующего излучения на цнс, органы чувств, железы внутренней секреции, систему крови, лимфоидные ткани, жкт, ссс, органы выделения, кости, хрящи, мышцы, половые железы.
- •60) Действие ионизирующего излучения на зародыш, эмбрион и плод.
- •61) Генетические эффекты. Радиационный мутагенез. Возможные последствия мутации в соматических клетках: лейкозы, рак. Зависимость ген.Эффекта от величины доз облучения во времени.
- •62) Влияние ионизирующих излучений на иммунобиологическую реактивность.
- •63) Значение естественной радиоактивности и малых доз радиации в биологических процессах.
- •64) Лучевая болезнь, ее формы и степени: лучевая травма, генетические эффекты.
- •65) Острая лучевая болезнь (олб), вызванная внешним облучением, ее периоды и степени тяжести.
- •66) Патогенез, клинические признаки, патологические изменения, диагноз, прогноз, лечение и профилактика лучевой болезни.
- •67. Особенности клинической и паталогоанатомической картины острой лучевой болезни, вызванной попаданием р-акт. В-в внутрь организма.
- •68. Особенности течения лучевой болезни у разных видов с/х животных.
- •69. Хроническая лб. Особенности и течение развития, течение заболевания. Диагноз, прогноз, исходы. Лечение и профилактика хрон. Лб.
- •70. Лб при внутреннем поражении. (см.67)
- •71. Лучевые ожоги. Этиология, патогенез, клин.Признаки, течение и исходы. Отличительные признаки луч.Ожогов от термических и химических. Профилактика и лечение.
- •72. Комбинированные луч.Поражения.
- •73. Отдалённые последствия действия радиации.
- •74. Хозяйственно полезные качества животных, подвергнувшихся воздействию ионизир. Излучения.
- •75. Использование биол.Действия иониз. Излучений на растит. И животные организмы с целью стимуляции роста, развития и продуктивности животных, изменение наследственный свойств организма.
- •77. Использование ион. Изл. В диагностике болезней, терапии, биол.Промышленности и др. Отраслях нар. Хоз-ва.
- •78. Применение радиоиндикаторного метода при исследовании функционального состояния органов и систем орг-ма, изучение обмена в-в у животных, фармакодинамики лек.В-в.
- •79. Приборы для оснащения радиационных служб и их назначение.
- •80. Технологические приёмы переработки животноводческой продукции, загрязнённой р-нуклидами.
- •81. Радиометрические, дозиметрические способы контроля.
- •82. Радиационный контроль мясн. Сырья и крс.
- •84. Каковы принципы рад. Безопасности.
- •85. Каковы основные пределы доз разных категорий населения.
- •86. Назовите средства и методы индив. Защиты при работе с рад.Источниками.
- •87. Назовите средства и методы индив. Защиты при нахождении в местности с высоким уровнем р-нуклидного загрязнения. (см. 86)
- •88. Перечислите правила личн.Гигиены при работе в зоне р-активного загрязнения.
- •89. Назовите принципы зонирования территорий, подвергшихся радионуклидному загрязнению.
- •90) Виды радиоактивных отходов и методы их обезвреживания.
Радиология и радиобиология. Предмет и задачи с/х радиобиологии и связь с другими науками.
Радиология — раздел медицины, изучающий применение ионизирующих излучений для диагностики (радиодиагностика) и лечения (радиотерапия) различных заболеваний, а также заболевания и патологические состояния, возникающие при воздействии ионизирующих излучений на организм человека.
Радиобиология изучает закономерности и механизмы действия ионизирующего излучения на биоорганические вещества, вирусы, бактерии, клетки, ткани, целостные организмы, популяции, биогеоценозы, их сообщества и биосферу в целом.
Открытия и обобщения в области радиобиологии, большой экспериментальный материал, полученный за сравнительно короткое время, легли в основу радиационной медицины, прогнозирования радиационной опасности. Они широко используются также в генетике, молекулярной биологии, экологии, сельском хозяйстве и т. д.
На основе эффектов биологического действия ионизирующей радиации радиобиология рассматривает и ведет разработку прикладных вопросов радиобиологии в виде радиационно-биологической технологии (РБТ) в животноводстве, ветеринарии и других отраслях сельского хозяйства в направлении стимуляции хозяйственно полезных качеств у сельскохозяйственных животных, в том числе птиц, под действием малых доз внешнего облучения, стерилизации ветеринарных биологических (вакцины, сыворотки и др.) и лекарственных препаратов (витамины, антибиотики и т. д.), биологических тканей, полимерных изделий, шовных и перевязочных материалов, консервирования пищевых продуктов и обеззараживания сырья животного происхождения (шерсть, кожа, пушнина и т. д.) и отходов сельскохозяйственного производства (навозные стоки) и т. д.
Наряду с этим радиобиология ведет разработку и использование методов меченых атомов в животноводстве и ветеринарии для изучения физиологии и биохимии животных, диагностики болезней и с лечебной целью, в селекционно-генетических исследованиях и т. д.
Важнейшими практическими задачами радиобиологии являются:
обучение методам контроля и прогнозирования радиоактивных загрязнений продуктов животноводства и кормов (радиометрия, дозиметрия и защита от излучений),
проведение комплекса организационных и специальных мероприятий при ведении животноводства в условиях радионуклидного загрязнения внешней среды,
рациональное использования загрязненной радионуклидами продукции растениеводства и животноводства,
проведение комплекса мероприятий по диагностике, лечению и профилактике радиационных поражений сельскохозяйственных животных,
применение радионуклидов и радиационной биотехнологии в ветеринарии и животноводстве.
Таким образом, радиобиология нацелена на решение актуальной гуманитарной задачи обеспечения комфортной и безопасной среды обитания человека в условиях реальных и потенциальных радионуклидных загрязнений.
Элементы ядерной физики. Строение атома. Физическая характеристика элементарных частиц, входящих в состав атома
Все в природе состоит из веществ. Вещество — это любая совокупность атомов и молекул, находящихся в определенном агрегатном состоянии.
Вещества бывают простые и сложные. В состав простых веществ входят атомы только одного элемента. Сложные вещества, или химические соединения, содержат атомы нескольких элементов.
Атом — мельчайшая частица химического элемента, которая является носителем его химических свойств (от греч.
atomos — неделимый, термин предложил древнегреческий ученый Демокрит, IV в. до н. э.).
В природе только инертные газы обнаруживаются в виде атомов, так как их внешние оболочки замкнутые; все остальные вещества существуют в виде молекул.
Атом любого элемента можно разделить на субатомные (элементарные) частицы, и в этом случае он утратит свойства, характерные для данного элемента. К элементарным частицам относят электроны, протоны, нейтроны, мезоны, нейтрино и ряд других.
Модели атома:
1911 г. Э. Резерфорд - планетарная модель атома. Согласно этой модели в центре атома расположено
положительно заряженное ядро с диаметром 10–13...10–12 см. Вокруг ядра вращаются по эллиптическим орбитам электроны, образующие электронную оболочку атома.
1913 г. Н. Бор усовершенствовал эту модель (квантовая теория Бора). Согласно этой теории электроны в атоме могут занимать не любое положение, а только определенный уровень (1, 2, 3 и т. д.), т. е. энергия электрона в атоме не может меняться непрерывно, а изменяется скачкообразно, т. е. дискретно. Переход электрона с одного уровня на другой совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Основные положения своей теории Бор сформулировал в виде постулатов (утверждения без доказательств):
электроны вращаются вокруг ядра по определенным (стационарным) круговым орбитам, не излучая при этом энергии.
излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
на разных энергетических уровнях электрон имеет разную кинетическую энергию (чем дальше от ядра, тем она больше) и энергию связи с ядром (чем дальше от ядра, тем она меньше).
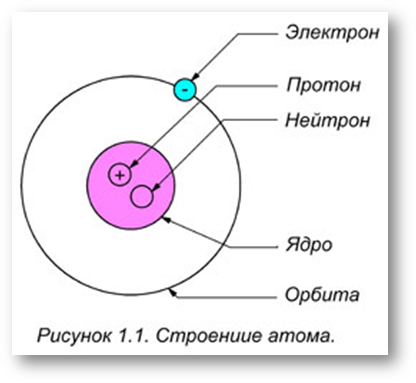
Электронная оболочка. В зависимости от энергии, которая удерживает электроны при вращении вокруг ядра, они группируются на той или иной электронной орбите. Иначе электронную орбиту называют уровнем или слоем. Число слоев у различных атомов неодинаковое. В атомах с большой атомной массой число орбит достигает семи. Их обозначают либо цифрами: 1, 2, 3, 4, 5, 6, 7, либо буквами латинского алфавита: K, L, M, N, О, Р, Q.
Число электронов в каждом слое строго определенное. Так, K-слой имеет не более двух электронов, L-слой — до 8, M-слой — до 18, N-слой — 32 электрона и т. д. Число электронов на орбите определяется по формуле 2n2, где
n — номер электронного уровня.
Ядро атома. Ядро атома состоит из двух типов частиц: протонов и нейтронов, связанных между собой огромными
силами. Протоны и нейтроны имеют общее название нуклоны (ядерная частица от греч. nucleus — ядро); они в ядре
могут превращаться друг в друга. Ядро атома имеет положительный заряд, носителем которого является протон. Положительный заряд ядра в атоме уравновешивается отрицательным зарядом электронов, вращающихся на разных
орбитах атома (рис. 3).
Протон р — устойчивая элементарная частица с массой покоя, равной 1,00758 а. е. м. (1,6725-10–24 г), которая примерно в 1840 раз больше массы покоя электрона. Протон имеет один элементарный положительный электрический заряд, равный заряду электрона. Атом водорода представляет собой ядро, содержащее один протон, вокруг которого вращается один электрон. Если «сорвать» этот электрон, то оставшаяся часть атома и будет протоном. Поэтому протон часто определяют как ядро атома водорода. Каждый атом любого элемента содержит в ядре определенное число протонов, которое постоянно и определяет в основном химические свойства элемента: так, в ядре атома серебра
их 47, в ядре урана — 92. Число протонов в ядре Z называют атомным номером или зарядовым числом; оно соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
Нейтрон п — электрически нейтральная частица, масса покоя которой равна 1,00898 а. е. м. (1,6749-10–24 г), т. е. она так же, как и у протона, примерно равна 1 а. е. м. Вследствие своей электрической нейтральности нейтрон не отклоняется под действием магнитного поля, не отталкивается атомным ядром и, следовательно, обладает
большой проникающей способностью, что создает серьезную опасность как фактор биологического действия излучения.
Число нейтронов, находящихся в ядре, дает в основном только физическую характеристику элемента, так как в разных ядрах одного и того же химического элемента может быть далеко не одинаковое число нейтронов (от одного до десяти).
В ядрах легких устойчивых элементов число протонов относится к числу нейтронов как 1:1. Чем дальше расположен элемент в периодической системе элементов Д. И. Менделеева (начиная с 21-го элемента — скандия), тем больше в
его атомах число нейтронов по сравнению с протонами, тем более атом неустойчив. В самых тяжелых ядрах число нейтронов в 1,6 раза больше числа протонов. Например, ядро урана 238U содержит 92 протона и 146 нейтронов (число нуклонов равно 238).
Диаметр ядра атома равен примерно 10–13...10–12 см и составляет 0,0001 диаметра всего атома. Однако практически
вся масса атома (99,95...99,98%) сосредоточена в его ядре. Масса электронной оболочки незначительна, поэтому масса ядра почти совпадает с массой атома. В настоящее время массы атомов измерены с большой точностью (до шестого и седьмого десятичных знаков) с помощью современных масс-спектрометров.
Суммарное число протонов и нейтронов в ядре называют массовым числом и обозначают буквой А (или М). Число нейтронов N в ядре равно разности между массовым числом и атомным номером Z элeмeнтa: N = A – Z.
При обозначении атомов обычно пользуются символом элемента, которому принадлежит атом, и указывают слева
вверху массовое число А, а внизу — атомный (порядковый) номер Z в форме индексов A , Z X где Х — символ элемента. Например, ядро углерода 12 6 C содержит 12 нуклонов, из них 6 протонов; ядро натрия 23Na имеет 23 нуклона, из них 11 протонов и т. д. Порядковый номер Z иногда опускают, так как символ элемента вполне определяет его место в периодической системе.
