
Белки, функционирующие в неполярном (липидном) окружении, например, белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Ковалентные связи
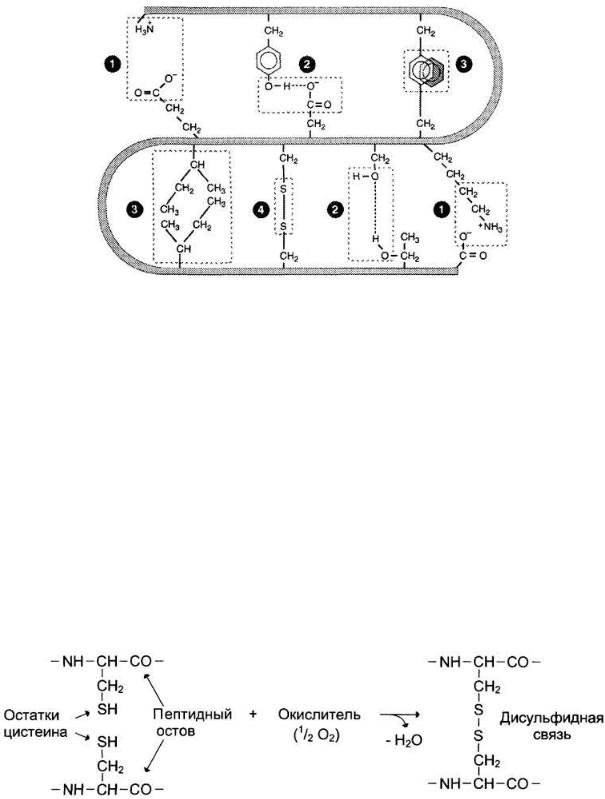
Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SН-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов
Образование дисульфидной связи в белках.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют конформацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Конформационная лабильность белков
Белки обладают конформационной лабильностью — склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке.
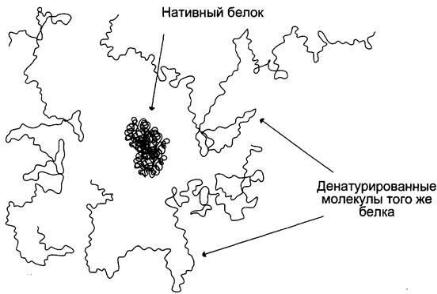
Денатурация белков
Денатурация - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется.
Факторы, которые вызывают денатурацию белков
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
• высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
•интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
•органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям.
•кислоты и щелочи, изменяя pH среды, вызывают перераспределение связей в молекуле белка;
•соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SН), изменяя их конформацию и активность;
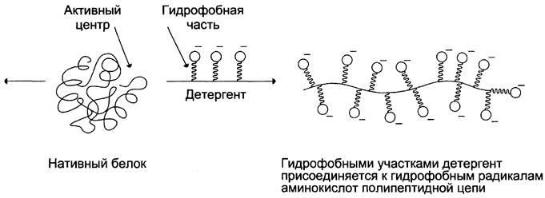
•детергенты — вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными). Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, что изменяет конформацию белков. Денатурированный под действием детергентов белок обычно остаётся в растворённом виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла:
Обратимость денатурации (ренативация белков)
Долгое время считалось, что процесс денатурации белков необратим. Однако оказалось, что некоторые очищенные и денатурированные белки способны в опытных условиях восстанавливать конформацию при удалении денатурирующих агентов.
Ренативация рибонуклеазы
В начале 60-х г. XX века обнаружили, что процесс денатурации белков может быть обратимым. Это открытие было сделано при изучении денатурации рибонуклеазы — фермента, расщепляющего связи между нуклеотидами в РНК. Рибонуклеаза —
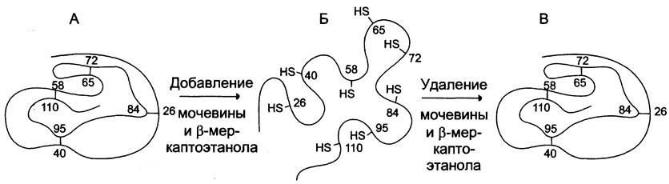
глобулярный белок, содержащий одну полипептидную цепь, состоящую из 124 аминокислотных остатков. Его конформацию стабилизируют 4 дисульфидные и множество слабых связей.
Обработка рибонуклеазы β-меркаптоэтанолом (формула β-меркаптоэтанола — НО- СН2-СН2- SН) приводит к разрыву дисульфидных связей и восстановлению SН-групп цистеиновых, остатков, что нарушает компактную структуру белка. Добавление 8 М раствора мочевины или 6 М раствора гуанидинхлорида, вызывающих разрыв слабых связей в белке и образование новых водородных связей с денатурирующими агентами, приводит к образованию случайным образом свёрнутых полипептидных цепей рибонуклеазы, лишённых ферментативной активности, т. е. к денатурации фермента. Денатурирующие агенты не разрушают первичную структуру белка.
Однако если путём диализа очистить рибонуклеазу от денатурирующих агентов и β- меркап-тоэтанола, ферментативная активность белка постепенно восстанавливается. Этот процесс называется ренатурацией, или ренативацией белка. Сульфгидрильные группы денатурированного фермента под действием кислорода воздуха окисляются, в результате вновь возникают 4 дисульфидные связи, характерные для нативной структуры белка. Из 105 возможных способов связывания восьми SН-групп остатков цистеина реализуется только один вариант, характерный для нативной конформации белка:
Возможность ренативации впоследствии была доказана и для других белков, в частности миоглобина. Сохранность первичной структуры белка — необходимое условие для восстановления его конформации. На основании этих опытов был выведен фундаментальный принцип молекулярной биологии: аминокислотная последовательность белков определяет их конформацию и специфическую функцию.
Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
Специфические белки - шапероны (от франц. shaperon — няня), участвующие в защите клеточных белков от денатурирующих воздействий, относят к белкам теплового шока (БТШ) и в литературе часто обозначают как HSP (от англ. heat shock protein). При действии различных стрессовых факторов (высокая температура, гипоксия, инфекция, УФО, изменение pH среды, изменение
молярности среды, действие токсичных химических веществ, тяжёлых металлов и т. д.) в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков. В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Установлено, что кратковременные стрессовые воздействия увеличивают выработку БТШ и повышают устойчивость организма к длительным стрессовым воздействиям. Так, кратковременная ишемия сердечной мышцы в период бега при умеренных тренировках значительно повышает устойчивость миокарда к длительной ишемии, вызванной стенокардией или закупоркой сосудов сердца тромбом. В настоящее время перспективными исследованиями в медицине считают поиски фармакологических и молекулярно-биологических способов активации синтеза БТШ в клетках. Шапероны выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул.
Доменная структура белков
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Доменом называют часть пептидной цепи, образующей как бы самостоятельную глобулу, причем на одной пептидной цепи может быть два или больше доменов. Домены в одном белке могут быть одинаковыми или различными как по структуре, так и по функции. Часто домен по своей структуре и свойствам сходен с отдельным глобулярным белком, имеющим самостоятельную третичную структуру. Благодаря доменной структуре белков облегчается формирование третичной структуры.
Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1.Количество протомеров в структуре олигомерных белков
Всостав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).
Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа — 4 протомера; фермент

внутренней мембраны митохондрий цитохромоксидаза — 13 протомеров, а глутаминсинтетаза — 12 протомеров:
Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок. Комплементарность протомеров
«Узнавание» и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Специфичность связывания контактных участков определяется их комплементарностью. Комплементарность — пространственное и химическое соответствие взаимодействующих поверхностей. Впадины и выступы на поверхности одной молекулы должны совпадать с выступами и впадинами на поверхности другой молекулы, как два куска неровно разорванной бумаги. Кроме того, функциональные группы радикалов аминокислот на одной контактирующей поверхности должны образовывать слабые химические связи с радикалами аминокислот на другой поверхности:
В области контактных поверхностей обычно содержится много гидрофобных радикалов аминокислот, в результате объединения которых формируется гидрофобное ядро олигомерного белка. Гидрофильные радикалы могут образовывать водородные и ионные связи.
Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены.
СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
Особенности функционирования олигомерных белков на примете гемоглобина
Структура и функции миоглобина
Миоглобин— глобулярный белок, гемопротеин, содержит простетическую группу
— гем, прочно связанную с белковой частью, имеет только одну полипептидную цепь из 153 аминокислот (апомиоглобин). Содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, O2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
Строение миоглобина
Гем — молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть гема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в
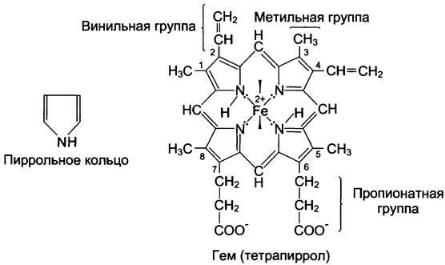
составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В геме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fе2+, находящимся в центре молекулы:
Апомиоглобин — белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 α-спиралей (от А до Н). Спирали, начиная с N-конца, содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву α-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
Связывание гема с апомиоглобином
Гем присоединяется к белковой части в углублении между двумя α-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца гема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях pH, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости гема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в геме может образовывать 6 координационных связей, 4 из которых удерживают Fе2+ в
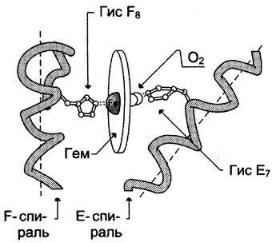
центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fе2+ и атомом азота имидазольного кольца Гис F8:
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда — O2 к миоглобину.
Аминокислотное окружение гема создаёт условия для довольно прочного, но обратимого связывания O2 с Fе2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fе2+ в Fе3+. Трёхвалентное железо в составе гема не способно присоединять O2.
Структура и функции гемоглобина
Гемоглобины — родственные белки, находящиеся в эритроцитах человека и позвоночных животных, выполняют 2 важные функции:
-перенос O2 из лёгких к периферическим тканям;
-участие в переносе СO2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
От способности гемоглобина насыщаться O2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями O2 и интенсивность метаболизма. С другой стороны, O2 — сильный окислитель, избыток поступления O2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина — его способность регулировать сродство к O2 в зависимости от тканевых условий.
Гемоглобины так же относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
1. Гемоглобины человека
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А — основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β(2α2β).
Гемоглобин А2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
Гемоглобин А1с — гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2  2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F — фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 y-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
2. Строение гемоглобина А
Строение протомеров гемоглобина
Конформация отдельных протомеров гемоглобина удивительно напоминает конформацию миоглобина, несмотря на то, что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка. Протомеры гемоглобина, так же состоят из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и «карман» для связывания гема. Соединение гема с глобином (белковой частью) аналогично таковому у миоглобина — гидрофобное окружение гема, за исключением 2 остатков Гис Е7 и Гис
