
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные билеты СГМУ
.pdfБилет 1 1 бикарбонатная буферная система, состав и механизм
2 условия получения коллоидных систем
3 термодинамическая система, гомогенная, гетерогенная, открытые, закрытые, изолированные
4 Изоэлектрическая точка белка находится в рН=8, какой заряд приобретёт белок если его поместить в раствор с рН=3
1 Бикарбонатный буфер.
Он составляет 53 % буферной ёмкости и представлен: Н2СО3 NaHCO3 Соотношение 1 : 20 Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия. В случае накопления кислот в крови уменьшается количество НСО3 - и происходит реакция: НСО3 - + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2 При увеличении щелочности крови концентрация НСО3 - увеличивается: Н2СО3 + ОН- ↔ НСО3 - + Н2О. Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным
2 
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Конденсационные методы основаны на образовании новой фазы в условиях пересыщенного состояния веществ; при этом система из гомогенной превращается в гетерогенную. Виды конденсационных методов:
1)физические процессы, протекающие при охлаждении системы: кристаллизация (образование твердой фазы в жидком растворе); конденсация (превращение паров в жидкость); десублимация (переход из газовой фазы в твердую).
2)химические процессы (реакции обмена, окисления, гидролиза и др.)
3 Термодинамическая система – это любой материальный объект, отделѐBнный от окружающей среды реальной или воображаемой поверхностью раздела, Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Гомогенная система – система, состоящая из одной фазы.
Гетерогенная система – система, состоящая из двух или большего числа фаз.
4 pH=pI=8, pI>pH |
(если pI<pH, то -) |
8>3 «+» |
|
Билет 2
1) молекулярность элементарного акта реакции.порядок реакции .примеры
2)коагуляция
3)координационнай теория
4)по уравнению реакции определить знак энтрапии
1 Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции. По молекулярности различают мономолекулярные, бимолекулярные, тримолекулярные реакции
Порядок реакции — это число, равное сумме показателей степени концентраций реагирующих веществ в уравнении скорости.
1)Реакции нулевого порядка (n=0).
2)Реакции первого порядка ( n=1).
3)Реакции второго порядка ( n=2).
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
2 Коагуляция - процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет седиментационную устойчивость. Коагуляция самопроизвольный процесс, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии. Факторы коагуляции: Коагуляция возникает под действием разнообразных внешних воздействий. К ним относятся: изменение температуры; действие электрического и электромагнитного полей; действие видимого света; облучение элементарными частицами; механическое воздействие; добавление электролитов и др. Процесс коагуляции имеет две стадии: скрытую и явную.
На скрытой стадии происходит формирование коллоидного раствора гидроксидов и образование микрохлопьев.
А затем на явной стадии процесса образуются крупные хлопья размером 1—3 мм, которые, обладая высокой сорбционной способностью, могут дополнительно извлекать примеси из воды.
Коагуляция электролитами происходит при сравнительно невысокой концентрации добавляемого электролита. Коагуляцию вызывают все электролиты, так как при введении их в коллоидную систему происходит сжатие диффузного слоя, снижение ζ-потенциала, что приводит к разрушению коллоидной системы. Минимальная концентрация электролита, вызывающая за данный промежуток времени определённый видимый эффект коагуляции, называется порогом коагуляции (γ) или критической концентрацией. Эта величина служит сравнительным критерием агрегативной устойчивости дисперсной системы. Порог коагуляции принято выражать в моль/л.
Коагуляцию вызывает ион противополжного знака заряду коллоидной частицы: для положительных – анион, для отрицательных – катион, вводимого в систему электролита.
Правило Шульце-Гарди
Коагулирующее действие иона тем выше, чем выше его заряд.
При увеличении заряда иона на единицу, порог концентрации уменьшается на один порядок
порог коагуляции определяется уравнением: γ = С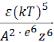
где С – константа, зависящая от числа зарядов катиона и аниона; k – константа Больцмана;
е – заряд электрона, Т – температура (в К),
ε – диэлектрическая проницаемость раствора, А – константа вандерваальсова притяжения; Z – величина заряда иона.
Если применяется смесь электролитов, то механизм коагуляции осложняется. Происходит смещение адсорбционного равновесия, которое сопровождается перераспределением ионов двойного слоя и
изменением порога коагуляции. Наблюдаемые при этом явления можно свести к 3 следующим: антагонизм, синергизм, аддитивность.
1)Аддитивность- коагулирующее действие смеси равно общей сумме коагулирующих эффектов составляющих её электролитов.
2)Антагонизм- действие одного электролита ослабляется при добавлении другого. 3)Синергизм-действие одного электролита усиливается при добавлении другого.
113. Кинетика коагуляции.
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции V – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы.
V = -  где
где
c – концентрация частиц; t – время.
Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна. Степень коагуляции α:
α = где
где
где Z – общее число столкновений частиц в единицу времени;
Zэф – число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени. -Если α = 0, коагуляция не происходит, золь агрегативно устойчив.
-Если α = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
-Если 0 ‹ α ‹ 1, то идет медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
3 Главная валентность - валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности.
Побочная валентность – валентность, в результате проявления которой и образуется комплексное соединение.
Центральные атомы или комплексообразователи - атомы стремящиеся равномерно окружить себя ионами или молекулами, являясь центром притяжения.
Лигандами - ионы или молекулы, непосредственно связанные с комплексообразователем. Посредством главной валентности присоединяются ионы-лиганды, а посредством побочной валентности – ионы и молекулы.
Координация - притяжение лиганд к комплексообразователю Координационное число - число лиганд комплексообразователя
Число координационных мест, занимаемых лигандом около комплексообразователя, называется его
координационной ёмкостью или дентатностью
Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу.
Билет 3 1. Фосфатный буфер (состав и механизм)
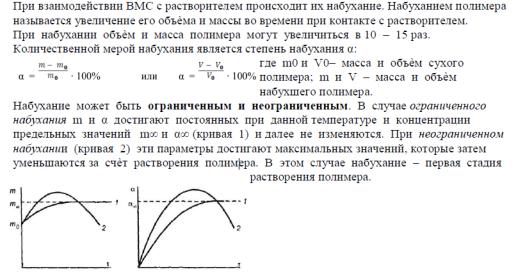
2 закон Вант-Гоффа для осмотического давления (математическое выражение, формулировка) 3 степень набухания. Факторы влияющие
4 Приготовить 200 г 0,01% раствора NaCl. Будет ли он физиологическим?
1 Фосфатный буфер
Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-.
Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1. Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию.
Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, происходит их нейтрализация ионами НРО4 2- : Н + + НРО4 2- ↔ Н2РО4 1- Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, они нейтрализуются ионами Н2РО4 1-: ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5.
2 Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процесс диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя.
Вант-Гофф пришел к выводу, что величину осмотического давления можно вычислять по следующей формуле:
πосм= СRT, где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура.
3
4 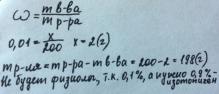
Билет 4
1.Закон разбавления Оствальда (формулировка и математическое выражение)
2.Реакции гомогенные, гетерогенные, простые и сложные (Все виды сложных) с примерами.
3.Ориентация ПАВ в поверхностном слое. Правило Дюкло-Траубе.
4.Назвать комплексное соединение

1 Степень диссоциации определяется константой диссоциации (Кд) и концентрацией (с) слабого электролита в растворе.
Закон разбавления Оствальда: с разбавлением раствора слабого электролита степень диссоцииации увеличивается и наоборот.
Закон разбавления Оствальда для слабого бинарного электролита:
При очень низкой степень диссоциации (а<1%) принимают , что 1-а=1. Тогда:
Кд=а2 с => a=√ Kд/c
2 В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах. Микрогетерогенные реакции – это реакции происходящие в коллоидных системах.
Простыми называют реакции, протекающие в одну стадию. Сложными называют реакции, протекающие в несколько стадий. Выделяют следующие виды сложных реакций:
1)параллельные: протекание нескольких процессов с участием одних и тех же веществ;
2)последовательные: конечные продукты образуются через ряд промежуточных продуктов,
3)сопряженные: протекание одной реакции инициирует осуществление второй;
4)цепные: протекающие через ряд регулярно повторяющихся элементарных стадий--,
3 Правило Дюкло-Траубе.
В гомологическом ряду жирных кислот с увеличением длины углеводородного радикала на одну -СН2 группу поверхностная активность возрастает в 3 - 3,5 раза
Принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа втягивается в воду-полярную фазу, а неполярный радикал выталкивается в неполярную фазу. Образуется
мономолекулярный слой:
-малые концентрации ПАВ. При малых концентрациях ПАВ, углеводородные радикалы (R), вытолкнутые в воздух, «плавают» на поверхности воды, затем, по мере роста концентрации ПАВ, они начинают подниматьс
я.
-умеренные концентрации
-насыщенный адсорбционный слой. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом Ленгмюра» из вертикально ориентированных молекул ПАВ.
Билет 5 1 Способы выражения концентрации растворов
2 Адсорбция на границе жидкость-газ, уравнение Гиббса, изотерма адсорбции 3 Первый закон Рауля 4 Задача на порог коагуляции с портала
1 1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= 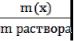 Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
См= 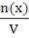 Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.

1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества); 0,1М – децимолярный раствор; 0,01М – сантимолярный раствор; 0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество мольэквивалентов вещества, содержащегося в 1 л раствора.
СN= 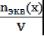 Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
Титркол во грамм растворенного вещества содержащегося в 1 мл раствора.
2Уравнение Гиббса: Г= - / * / с - молярная концентрация растворённого вещества в растворе. Г – поверхностная адсорбция.
Т – температура, при которой происходит адсорбция. R – газовая постоянная.
Δσ/Δc – изменение поверхностного натяжения раствора при изменении концентрации на С.
1.Если Г › 0, т.е. концентрация растворенного вещества в поверхностном слое больше, чем в объёме раствора, то ‹ 0. Адсорбция будет положительной. В этом случае растворенное вещество накапливается на границе раздела: σ на границе понижается. Это характерно для ПАВ.
2.При добавлении веществ более полярных, чем растворитель (ПИВ), σ увеличивается, а Г ‹ 0. Ионы этих соединений взаимодействуют сильнее с молекулами воды, чем молекулы воды друг с другом. Поэтому значительная часть ионов увлекается внутрь объема раствора. Оставшиеся на поверхности ионы создают силовое поле, тем самым повышая σ.
3.Есть вещества, которые не изменяют σ, Г=0, адсорбция отсутвует. Их называют (ПНВ).
Из графика следует, что по мере увеличения концентрации вещества адсорбция возрастает вначале резко, а затем всё медленнее и медленние, приближаясь к некоторой величине предельной адсорбции Г∞. Поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
3
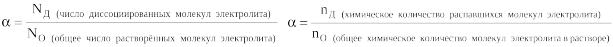
Билет 6 1.Теория электролитической диссоциации.Степень диссоциации электролитов
2.эндергонические и экзергонические процессы организма 3.Хроматография.Виды,суть процесса и применение
1 Электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
Вода представляет собой слабый амфотерный электролит:
Н2О ↔ Н+ + ОН-
или, более точно:
2Н2O ↔ H3O+ + OH-
Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10-7 моль/ л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение
[H+] + [OH-] = 10-14
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
рН = - lg[H+]
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе:
Сильными электролиты в растворах полностью распадаются на ионы Слабые электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде.
Степень диссоциации электролитов зависит от температуры раствора и его концентрации.
2 Экзергонические процессы – химические реакции, в результате которых уменьшается энергия Гиббса и система совершает работу.
Эндергонические процессы – химические реакции, в результате которых возрастает энергия Гиббса и над системой совершается работа.
3 Хроматография – метод анализа и разделения смеси веществ, основанный на их различной адсорбции. Хроматография подразделяется:
1)Адсорбционная - основана на различной адсорбции разделяемых веществ.
2)Распределительная - основана на различии в растворимости и распределения веществ между двумя несмешивающимися жидкостями.
3)Ионообменная - по обмену ионами между раствором и адсорбентом 4)Хемосорбционная – основана на различии в константах химической реакции.
5)Молекулярно-ситовая – основана на разделение смеси веществ с различным размером молекул. Колоночная хроматография — осуществляется пропусканием исследуемого раствора через стеклянную трубку, заполненную порошкообразным поглотителем.
Бумажная хроматография - метод, основанный на распределении веществ между подвижной и неподвижной жидкими фазами.
Тонкослойная хроматография - основанный на различной скорости перемещения компонентов смеси в плоском тонком слое сорбента при их движении в потоке подвижной фазы.
Билет 7
1.Белковый буфер - механизм и состав
2.Методы очистки коллоидных,имущественная почка
3.Второй закон термодинамики
4.Задача на буферную ёмкость.
1 Белковый буфер
Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием.
Pt – COOH - белок-кислота Pt – COONa – белок-соль

При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется. При увеличении щелочных продуктов они взаимодействуют с
Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O
Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется.
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие.
2 Диализ. Коллоидная система наливается в сосуд, который отделен от другого сосуда полупроницаемой мембраной. В результате диффузии низкомолекулярные примеси переходят во внешний раствор. Диализ ведут при повышенном давлении во внутренней камере. Материал, прошедший через мембрану, называется диализат.
Ультрафильтрация -это процесс, заключающийся в том, что жидкость не фильтруется самопроизвольно, а под давлением «продавливается» через полупроницаемую перегородку. Этот метод называют иногда сухим диализом, в том смысле, что с другой стороны мембраны нет растворителя.
Электродиализ - процесс диализа, ускоряемый действием электрического тока.
Фильтрация основана на способности коллоидных частиц проходить через поры обычных фильтров. Диализ почек — это наиболее используемый способ в медицинской практике. Он необходим в том случае, если нужно быстро очистить кровь больного от шлаков и токсинов. Также принцип работы искусственной почки используется в качестве замещающего метода очистки крови при нарушении функций почечных структур. Основной принцип работы искусственной почки в виде гемодиализа реализован с помощью пропускания крови через мембрану с мелкими ячейками. Они достаточны для прохождения сквозь них основных клеток крови. Но при этом ячейки мембраны не пропускают молекулы токсинов и кристаллических веществ.
3 Второй закон термодинамики (второе начало термодинамики): Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды.
ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0
Для химической реакции изменение энтропии ΔS0=∑νi S0i прод - ∑νi S0i исх
Энтропия (S) -мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу.
Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру. Энтропия – экстенсивная
функция. Энтропия системы равна сумме энтропий составных частей. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода.
Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль*К = 1 э.е.
Больцман постулировал, что энтропия связана с термодинамической вероятностью логарифмической зависимостью
S = k ln W |
уравнение Больцмана |
k – константа Больцмана: |
k = 1,38∙10-23 Дж/градус; |
W – число микросостояний, с помощью которых можно реализовать данное макросостояние: W=P1 ;
Р – вероятность того, что система находится именно в этом микросостоянии.
Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными.
При наличии неравновесных промежуточных состояний процесс считают термодинамически необратимым.
Билет 8 1)белки, как полиэлектролиты. Изоэлектрической состояние. Помещение белка в кислотную и щелочную среду.
2)классификация комплексных соединений
3)факторы влияющие на скорость реакции и константу диссоциации 4)мицелла
1 Полиэлектролитами называются ВМС, способные в растворе диссоциировать с образованием высокомолекулярного иона. Все высокомолекулярные полиэлектролиты растворяются в полярных растворителях.
Важнейшими представителями полиэлектролитов являются белки. Молекулы белков построены на основе аминокислот и содержат основные группы –NH2 и кислотные группы –СООН:Таким образом, как в кислой, так и в щелочной среде молекулы белка обладают нескомпенсированным зарядом разного знака. Регулируя рН белкового раствора, можно добиться перевода белка в изоэлектрическоесостояние. Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором еѐB положительные и отрицательные заряды взаимно скомпенсированы. Молекулу белка в изоэлектрическом состоянии можно считать нейтральной, хотя в ней имеются ионизированные группы.
Изоэлектрическая точка белка (ИТБ) – это значение рН, при котором белок переходит в изоэлектрическое состояние.
В изоэлектрическом состоянии свойства растворов белков резко меняются: при этом они имеют, например, наименьшую вязкость, плохую растворимость, что связано с изменением формы макромолекул.
При значении рН, близком к изоэлектрической точке, разноименно заряженные группы – (NH3)+и СОО‾ притягиваются друг к другу и макромолекула закручивается в спираль. При смещении рН среды от изоэлектрической точки одноимѐ/нно заряженные группы отталкиваются и цепь выпрямляется. Молекулы ВМС в развѐBрнутом состоянии придают раствором более высокую вязкость, чем молекулы ВМС, свѐBрнутые в спираль или клубок.
Для нахождения изоэлектрической точки полипептида (белка) необходимо:
1.Измерить подвижность полипептида при нескольких разных значениях рН;
2.Построить график зависимости подвижности от рН;
3.Графически найти значение рН, соответствующее нулевой подвижности
Значение изоэлектрической точки может помочь при составлении схемы выделения белка, поскольку растворимость белка минимальна при рН = рI
2 По заряду комплексного иона различают:
•катионные [Cu(NH3)4]2+
•анионные [Co(NO3)6]3-
•нейтральные [Pt(NH3)Cl2]0
По характеру лигандов различают:
акво- [Сu(H2O)4]SO4 аммино-[Cu(NH3)4]SO4 ацидо- К2[Cu(Cl)4]
гидроксо-K2[Cu(OH)4]
По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы.
3 Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов.
Билет 9
1.Буферный раствор, буферная емкость +формула, зона буф.действия.
2.Способы защиты коллоид.растворов. биолог.смысл
3.Зависимость скорости от времени(закон Вант Гофа)
4.Приготовить 100мл раствора из 0,1М NaCl
1 Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:

•Кислотные т.е. состоящие из слабой кислоты и ее соли (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного основания кислота
СН3СООNa → Na+ + CH3COO-
•Основные, т.е. состоящие из слабого основания и его соли (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток сопряженной кислоты Основание
NH4Cl → Cl- + NH4+
Буферная ёмкостьЭто способность буферной системы противодействовать изменению рН среды. Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия. Она равна рН = рКа ± 1 Буферная ёмкость (В) выражается количеством мольэквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
2 Коллоидная защита — это предохранение коллоидных растворов от коагуляции и, следовательно, повышение их устойчивости добавлением небольших количеств высокомолекулярных веществ (белков, крахмала, агар-агара и др.), так называемых защитных веществ. Коллоидная защиту используют при изготовлении устойчивых коллоидных препаратов серебра (колларгол), ртути, серы и других, применяемых в медицине. .
Коллоидная защита играет существенную роль в физиологических процессах. Содержание кальция карбоната и фосфата в крови значительно превышает их растворимость в воде. Отложению этих солей препятствуют защитные вещества крови, которые не позволяют коллоидным частицам нерастворимых
