
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Термодинамика
.pdfэнергия Гиббса биологического окисления вещества, стандартная энергия Гиббса реакции?
18.Поясните понятие экзергонических и эндергонических процессов, протекающих в организме, принцип энергетического сопряжения.
11
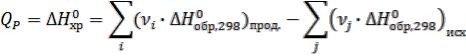
Приложение 3: Тренировочный тест
1)Термодинамика изучает:
а) взаимосвязь теплоты и энергии; б) скорость протекания химических процессов;
в) свойства основных классов химических соединений;
2)Энтропия - это… а) теплосодержание участников реакции;
б) способность совершать работу; в) мера неупорядоченности в системе;
3)Первый закон термодинамики описывает:
а) энтропию термодинамической системы; б) связь между внутренней энергией, теплотой и работой; в) динамическую вязкость веществ.
4)Самопроизвольно протекают процессы, сопровождаемые: а) уменьшением энергии; б) уменьшением энтропии; в) увеличением энтропии.
5)Закрытая система характеризуется:
а) отсутствием обмена веществом и энергией; б) отсутствием обмена энергией; в) отсутствием обмена веществом;
Ответы: 1а, 2в, 3б, 4в, 5в
Приложение 4: Ситуационные задачи
1) Вычислите тепловой эффект реакции
4 НСl(газ) + О2(газ) = 2 Н2О(газ) + 2 Сl2(газ)
при 298 К и Н0обр. НСl(газ) = -92,30 кДж/моль, Н0обр. Н2О(газ) = -241,84 кДж/моль.
2) Вычислите тепловой эффект реакции 3 С2Н2 (газ) = С6Н6 (жид) при 298 К и
Н0сгор. С2Н2 (газ) = -1299,63 кДж/моль, Н0сгор. С6Н6 (жид) = -3267,70 кДж/моль.
12
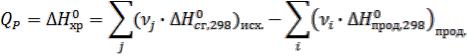
3) Вычислите изменение энтропии при 298 К (ΔS0298) для реакции
4 НСl(газ) +О2 (газ) = 2 Н2О(газ)+ 2Сl2(газ) ,
если S0298 (H2O(газ)) = 188,8 Дж/(моль·К); S0298 (Сl2 (газ)) = 233,0 Дж/(моль·К); S0298 (HCl(газ)) = 186,7 Дж/(моль·К); S0298 (O2 (газ)) = 205,3 Дж/(моль·К).
|
S 0 |
= i Si0 прод |
- i Si0 исх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
4) Для химической реакции вычислить |
|
изменение |
энергии Гиббса |
G0298, |
|||||||||||||||||||||||||||||||
используя стандартные значения энергии Гиббса |
|
G0f, 298 и используя |
Н0298 |
||||||||||||||||||||||||||||||||
и S0298. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
G |
0 |
|
|
= ( |
|
G |
0 |
|
|
) |
|
|
− ( |
|
G |
0 |
|
) |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
298, х. р |
|
|
|
i |
|
|
f |
,298 кон |
|
|
j |
|
f ,298 исх |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
или |
|
|
− 298 S |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
= H |
0 |
|
|
0 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298, х. р. |
|
|
|
|
|
298 |
|
|
|
|
|
|
298 |
|
|||||||
H |
0 |
= ( |
|
H |
0 |
|
|
) |
|
|
− ( |
|
H |
0 |
|
|
) |
|
|
, |
|
|
|
|
|
|
|||||||||
298 |
i |
f ,298 |
кон |
j |
f ,298 |
исх |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
S |
0 |
= ( |
|
|
S |
0 |
|
) |
|
|
− ( |
|
S |
0 |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
298 |
i |
|
298 |
кон |
j |
298 |
исх |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
13
Задачи для решения на занятии.
1)Вычислите тепловой эффект следующей реакции С3Н8(газ)= 2 Н2 (газ) + С3Н4 (газ) при 298 К и
Н0обр. С3Н4(газ) = 192,10 кДж/моль, Н0обр. С3Н8(газ) = -103,90 кДж/моль.
2) Вычислите S0298 для реакции N2 + 3H2 = 2NH3, если
S0298 (N2) = 191,5 Дж/моль К;
S0298 (H2) = 130,6 Дж/моль К;
S0298 (NH3) = 192,5 Дж/моль К.
3) Вычислите тепловой эффект реакции СН4 (газ) + Н2О(газ) = 3 Н2 (газ) + СО(газ) при 298 К и Н0обр. СН4 (газ) = -74,85 кДж/моль; Н0обр. Н2О(газ) = -241,84 кДж/моль; Н0обр. СО(газ) = -110,50 кДж/моль.
4) Вычислите тепловой эффект реакции С2Н2 (газ) + СО(газ) + Н2О(жид) = СН2=СН–СООН (жид) при 298 К и Н0сгор. С2Н2 (газ) = -1299,63 кДж/моль; Н0сгор. СО (газ) = -282,96 кДж/моль;
Н0сгор. СН2=СН–СООН (жид) = -1370,18 кДж/моль.
5) Вычислите тепловой эффект реакции СН4 (газ) + СО2 (газ) = 2 Н2 (газ) + 2 СО(газ) при 298 К и Н0обр. СН4 (газ) = -74,85 кДж/моль; Н0обр. СО2 (газ) = -393,51 кДж/моль; Н0обр. СО(газ) = -110,50 кДж/моль.
6) Вычислите тепловой эффект реакции
РСl5 (газ) = PCl3 (газ) + Сl(газ) при 298 К и
Н0обр. PCl5 (газ) = -369,45 кДж/моль; Н0обр. PCl3 (газ) = -277,0 кДж/моль.
14
Интернет-экзамен: ТЕРМОДИНАМИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1.Неверно, что согласно второму началу термодинамики тепловой эффект
обратной реакции больше теплового эффекта прямой реакции.
2. |
Al2O3 (к) + 3 H2 = 2Al (к) + 3 H2O (ж) Н0298 = 818,6 кДж и G298 = 870,1 кДж |
|
|
следовательно, эта реакция – Эндотермическая и при стандартных |
|
|
условиях протекает в обратном направлении. |
|
3. |
Для нахождения |
Н0298 по реакции: 3С2Н4 (г) = С6Н6 (ж) + 3Н2 (г) используется |
|
формула: Н0298 = |
Н0298 С6Н6 (ж) – 3Δ Н0298 С2Н4 (г) |
4.Энтальпия образования фтора (Δ Нф) при стандартных условиях равна 0
кДж/моль.
5. |
Для нахождения Н0298 реакции |
|
|
|||
|
4HCN(г) + 5O2 (г) = 2H2O(ж) + 4CO2 (г) + 2N2 (г) следует воспользоваться |
|
||||
|
формулой: |
|
|
|
|
|
|
Н0298 = 2 |
|
Н0298 Н2О(ж) = 4 |
Н0298СО2 (г) - 4 |
Н0298 HCN(г) |
|
6. |
Повышение давления смещает равновесие в сторону продуктов для реакции |
|||||
|
ВаО(к) + СО2(г) = ВаСО3(к). |
|
|
|
||
7. |
Согласно |
|
уравнению |
гомогенной |
химической |
реакции |
|
2НI → 2H2 + O2, H < 0, для смещения равновесии в сторону продуктов |
|||||
|
необходимо уменьшить температуру. |
|
|
|||
8. |
Для |
увеличения |
выхода |
продуктов |
реакции |
|
|
2Pb(NO3)2 (тв) |
2 PbO(тв)+4 NO2(г)+О2 (г), H > 0 необходимо повысить |
||||
|
температуру. |
|
|
|
|
|
9. |
Уравнение константы равновесия гетерогенной химической реакции 2H2S(г) |
|||||
|
+ SO2 (г) 2S(к) + 2H2O(г) имеет вид: |
|
|
|||
|
К = [H2O]2 / [H2S]2 · [SO2] |
|
|
|
||
15
