
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
24. Уравнение Нернста для электродного потенциала и гальванического элемента.
Электрод – система, состоящая из контактирующих проводников первого рода и второго рода, на межфазной границе которых возникает двойной электрический слой.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются электродными потенциалами.
Причиной возникновения электродного потенциала является переход некоторого количества металла в раствор в виде положительно заряженных ионов как результат взаимодействия металла с диполями воды:
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимсть выражается уравнением Нернста (здесь F – постоянная Фарадея, Кл/моль, n – заряд иона, – активность потенциалопределяющих ионов металла в растворе, моль/л):
В уравнении Нернста φ0 – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина φ0 есть мера способности окисленной формы элемента или иона принимать электроны, то есть восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма находится концентрация ионов в растворе.
Для того чтобы, можно было сравнить электродные потенциалы, возникающие в различных электродах, необходимо выбрать точку отсчета. За такую точку приняли потенциал водородного электрода, величину которого считают равной 0. На основе этого, построен ряд стандартных электродных потенциалов металлов (ряд активности металлов).
В качестве условно-нулевого потенциала выбран потенциал стандартного водородного электрода: Н+ | (H2)Pt, в котором давление продуваемого водорода равно 1 атм, а активность ионов водорода в растворе равна 1.
Электродная реакция:
Гальванические элементы – это системы, состоящие из двух электродов, в которых энергия химических реакций превращается в электрическую энергию.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых протекают эти процессы, называются анодами.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут эти процессы, получили название катодов.

25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
Гальванические элементы – это системы, состоящие из двух электродов, в которых энергия химических реакций превращается в электрическую энергию.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых протекают эти процессы, называются анодами.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут эти процессы, получили название катодов.
Электродвижущая сила (ЭДС) гальванического элемента – максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента. Если реакция протекает в стандартных условиях, то есть, если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом ЭДС называется стандартной электро-
движущей силой E0.
ЭДС гальванической цепи представляет собой разность потенциалов катода и анода:
Е = φк - φа
Биметаллические элементы – системы, состоящие из двух различных электродов.
Примером такого гальванического элемента является медно-цинковый гальванический элемент (Даниэля-Якоби).
Гальванический элемент Даниэля-Якоби состоит из двух электродов, которые находятся в растворах собственных ионов, в частности, из медной пластинки, погруженной в раствор СuSO4 и цинковой пластинки, погруженной в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга перегородкой.
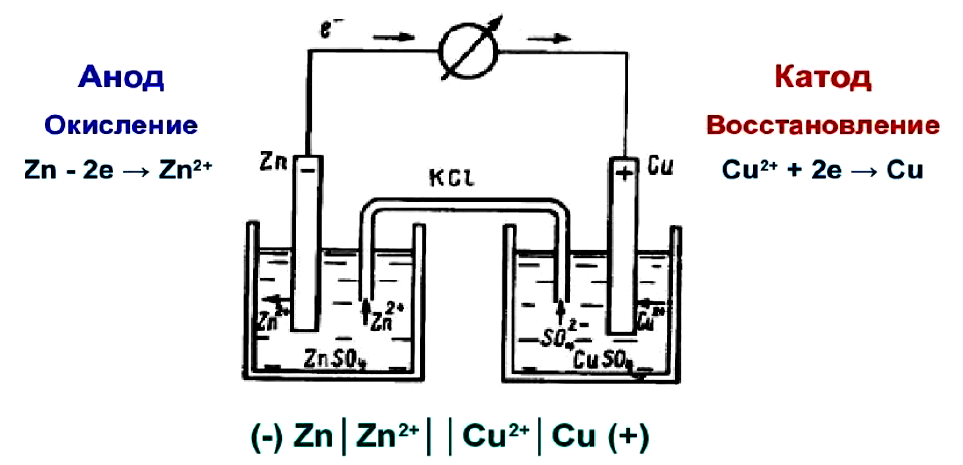
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного, поэтому при замыкании внешней цепи электроны будут переходить с цинкового электрода на медный. Таким образом, цинковый электрод будет анодом, так как на нем проходит процесс окисления цинка, а медный электрод будет катодом, так как на нем происходит восстановление меди. Растворы ZnSO4 и CuSO4 связаны «солевым мостиком». Солевой мостик – это стеклянная U-образная трубочка, наполненная агар-агаром, набухшим в насыщенном растворе КСl.
Анод: Zn – 2ē → Zn2+ – процесс окисления.
Катод: Cu2+ + 2ē → Cu – процесс восстановления.
Zn + Cu2+ → Zn2+ +Cu – суммарная химическая реакция.
Вследствие протекания этой реакции в гальваническом элементе возникает движение электронов во внешней цепи, то есть электрический ток. Поэтому суммарная реакция в гальваническом элементе называется токообразующей.
При схематической записи гальванического элемента границу раздела между проводником первого рода и проводником второго рода изображают одной вертикальной чертой, а границу раздела между проводниками второго рода – двумя чертами:
(Анод) Zn | Zn2+ | | Cu2+ | Cu (Катод).
Анод записывается слева, а катод справа.
Уравнение для расчета стандартной ЭДС будет выглядеть следующим
образом:
![]()
