
- •1. Элементы неравновесной термодинамики
- •Б). Производство энтропии в неравновесной системе
- •В). Производство энтропии в линейных необратимых процессах
- •Примеры необратимых процессов в линейном представлении.
- •Г). Вариационный принцип наименьшего рассеяния энергии в стационарных процессах
- •Д). Принцип минимума производства энтропии
Методы и подходы неравновесной термодинамики, используемые при проведении анализа микро- и нанотехнологий и структур.
Теоретические сведения: «Методы и подходы неравновесной термодинамики, используемые при проведении анализа микро- и нанотехнологий и структур»
1. Элементы неравновесной термодинамики
а). Энтропия и необратимость физико-химических процессов
Термодинамическая система, находящаяся в равновесном состоянии, является «статичной», поскольку для нее не существует представления об ее эволюции во времени. Считается, что система когда-то перешла в это равновесное состояние из неравновесного состояния, при котором она была динамической системой и обладала «силами», которые приводили к различным изменениям ее состояния в части материального состава и структуры, и при этом постепенно подводили к ее закономерному финалу – термодинамическому равновесию. Эту тенденцию движения к состоянию равновесия можно избежать, если с помощью определенных внешних сил искусственно поддерживать систему в состоянии, далеком от термодинамического равновесия.
В неравновесной термодинамике понятия «сила» или «обобщенная сила» распространяется на все виды воздействия, включая и обычные механические силы. Эти силы, обусловленные наличием градиентов термодинамических параметров (концентрации, давления, химического или электрического потенциала и т.д.) могут поддерживать в системе постоянный приток или отток вещества и энергии. Таким образом, эти силы образуют потоки энергии или вещества, которые, в конце концов, истощают сами силы, их породившие. Все градиенты со временем постепенно исчезают (если не поддерживаются искусственным образом), и система достигает окончательного состояния термодинамического равновесия. Например, источник движущей силы в виде температурного градиента между двумя точками в объеме вещества порождает перенос какого-то количества теплоты Q из горячей части системы в холодную. Этот поток теплоты увеличивает температуру холодного участка за счет охлаждения горячего участка, что постепенно приводит систему к состоянию теплового равновесия.
Наличие сил и потоков в неравновесной системе означает, что эта система неоднородна по своему составу и что в ней происходят различные физико-химические процессы. Поэтому в наиболее общем случае состав и все соответствующие переменные системы изменяются в пространстве и во времени. Возникает вопрос, каким же образом в неравновесных системах могут быть определены интенсивные параметры (подобные температуре или давлению), если они являются функцией координат и, вообще то, введены в рассмотрение исходя из представлений о равновесном характере системы. Эти трудности могут быть преодолены, если воспользоваться представлением о локальном равновесии системы. В этом случае, вся макроскопическая система условно расчленяется на совокупность большого количества локальных подсистем (остающихся по своей сути макроскопическими объектами) таким образом, что можно считать, что каждая отдельная подсистема находится в состоянии термодинамического равновесия (т.е. внутри ее термодинамические параметры сохраняют неизменное значение).
Примем допущение, что все выводы
равновесной термодинамики могут быть
применены к локально определяемым
параметрам небольшого элементарного
объема. Локальные переменные принято
относить к единице массы вещества. Но
удобнее перейти к переменным, соотнеся
их к объему системы. Тогда, если
![]() — парциальная масса на единицу объема
(парциальная плотность)
— парциальная масса на единицу объема
(парциальная плотность)
![]() -го
компонента, то полная плотность
-го
компонента, то полная плотность
![]() ,
удельная энтропия
,
удельная энтропия
![]() и удельная внутренняя энергия
и удельная внутренняя энергия
![]() ,
(отнесенные к единице объема среды)
определяются выражениями [5]:
,
(отнесенные к единице объема среды)
определяются выражениями [5]:
|
|
|
(1.а) |
|
|
|
(1.б) |
|
|
|
(1.в) |
где
![]() и
и
![]() - соответственно удельные энтропия и
внутренняя энергия единицы объема
компонента вещества
- соответственно удельные энтропия и
внутренняя энергия единицы объема
компонента вещества
![]() - типа.
- типа.
Согласно принятой гипотезе, относительно правомерности использования принципа локального равновесия применительно к термодинамической системе в целом, параметры локальных подсистем, определяемые с помощью выражений (1), по своей природе становятся аналогичными обычным параметрам, характеризующих равновесное состояние термодинамической системы. Таким образом, для каждого малого объема неравновесной термодинамической системы, его локальная энтропия может быть связана с локальной энергией и парциальной массой соотношением, которое является частным случаем известного уравнения Гиббса:
|
|
|
(2) |
где
![]() - химический потенциал единицы объема
компонента вещества
- химический потенциал единицы объема
компонента вещества
![]() - типа.
- типа.
Согласно выражению (1.б) общая энтропия
термодинамической системы, имеющей
объем
![]() ,
будет равна:
,
будет равна:
|
|
|
(3) |
Выше был продемонстрирован общий подход теоретического анализа неравновесной системы. Если термодинамическая система является пространственно-неоднородной по какому то либо термодинамическому параметру, то необходимо предварительно определить функцию распределения для этого параметра, а затем проводить интегрирование выражения (3) по всему объему термодинамической системы.

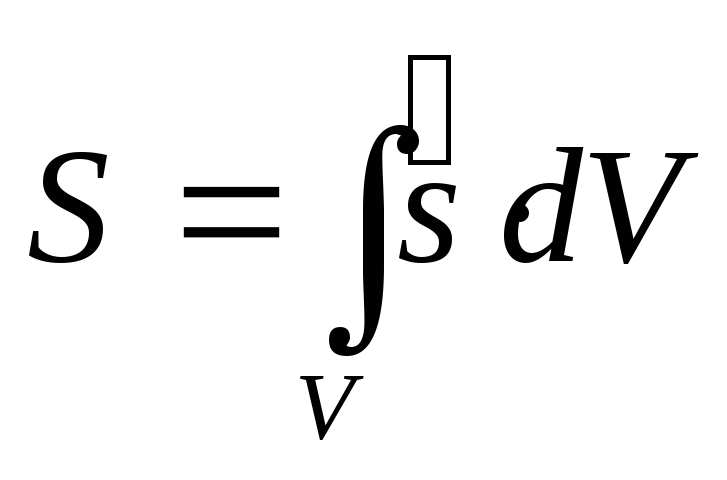 .
.