
аминокислоты
.docxТЕСТ
1. К аминокислотам относятся органические вещества, содержащие связанные друг с другом функциональные группы:
1) NH2 и CHO
2) NH2 и COOH
3) NO2 и COOH
4) NH2 и ОН
2. Используя аланин и глицин, сколько можно получить дипептидов?
1) 1
2) 2
3) 3
4) 4
3. Глицин образует сложный эфир в результате взаимодействия с:
1) гидроксидом натрия
2) бромводородом
3) этанолом
4) аминоуксусной кислотой
4. 2-аминопропановая кислота и аланин являются:
1) структурными изомерами
2) геометрическими изомерами
3) гомологами
4) одним и тем же веществом
5. Число изомерных аминокислот состава C4H9O2N равно:
1) 3
2) 4
3) 5
4) 6
6. Аланин не взаимодействует с веществом:
1) кислород
2) гидроксид натрия
3) хлорид натрия
4) хлорводородная кислота
7. 3-хлор-2-аминопропановая кислота НЕ реагирует с:
1) NH3
2) C2H5OH
3) Hg
4) Са
8. Пептидная связь образуется в результате реакции:
1) гидролиза
2) этанолиза
3) полимеризации
4) поликонденсации
9. Составьте уравнения реакций:
CH3COOH → CH2Cl COOH → NH2 CH2COOH
1)+хлор
2)+аммиак
10. При получении трипептида из аминоуксусной кислоты выделилось 36 г воды. Какая будет масса полученного трипептида?
1)188
2)190
3)189
4)191
11. Назовите аминокислоту: H2N – CH2 – CH2 – CH2 – COOH
1) 4-аминобутановая кислота
2) 4- аминопропановая кислота
3) β-аминомасляная кислота
4) 1- аминопропановая кислота
12. В водном растворе аминокислоты не взаимодействуют с:
1) НСl
2) NaOH
3) KNO3
4) C2H5OH
13. Укажите реагенты, которые взаимодействуют с аминоуксусной кислотой по аминогруппе:
1) НСl
2) NaOH
3) Mg
4) CH3OH
14. Получить аминокислоту нельзя:
1) из производных карбоновых кислот
2) при восстановлении нитропроизводных ароматических кислот
3) из сложных эфиров
4) гидролизом полипептидов
15. Сколько изомеров имеет аминокислота состава С4H9NO2
1) 3
2) 4
3) 6
4) 5(с кислотой)
16. Какие кислоты являются заменимыми:
1) валин
2) серин
3) тирозин
4) аланин
17. Какие кислоты являются незаменимыми:
1) лизин
2) глицин
3) валин
4) серин
18. Осуществите превращение по схеме:
Бутанол-1 → бутаналь → бутановая кислот→ 2-хлорбутaновая кислота → аминокислота. Назовите полученную аминокислоту.
1)окисление
2)серебряное зеркало
3)хлор
4)аммиак
Получили:2-аминобутановаякислота
19. Определите строение сложного эфира аминокислоты с алканолом, если массовая доля атомов азота в эфире 15,73%. Назовите его.
20. Глицин и аланин являются:
1) одним и тем же веществом
2) структурными изомерами
3) гомологами
4) пространственными изомерами
21. Сравните растворимость трех пентапептидов при рН=7. Расположите их в порядке возрастания гидрофильных свойств:
а) лей – фен – иле – гли – вал;
б) глу – асп – сер – фен – иле;
в) арг – лиз – тре – гис – цис;
1) а → б → в; 2) б → а → в; 3) в → а → б; 4) б → в → а
22. Расположите элементы структуры белковой молекулы в той последовательности, в которой они возникают при синтезе белка и формировании его нативной конформации.
Формирование α-спиралей и β-складчатых участков.
Образование пептидных связей.
Образование гидрофобных, водородных и ионных связей между радикалами аминокислот.
1) 2→3→1;
2) 2→1→3
3)3→1→2
4) 1→3→2
23. Напишите структурную формулу пентапептида следующего строения:
Гис – Глу – Про – Фен – Сер.
24. Взаимодействие субъединиц в олигомерном белке и белков с лигандами обусловлено принципом ...
25. Аминокислоты серин, тирозин и треонин, согласно классификации по химической природе радикала, относятся к … и …аминокислотам и при формировании третичной структуры могут образовывать … связи.
26. Аспарагиновая и глутаминовая аминокислоты, согласно классификации по химической природе радикала, относятся к … … аминокислотам и при формировании третичной структуры могут образовывать … связи с радикалами следующих аминокислот …, …, … .
27. Назовите данный трипептид:
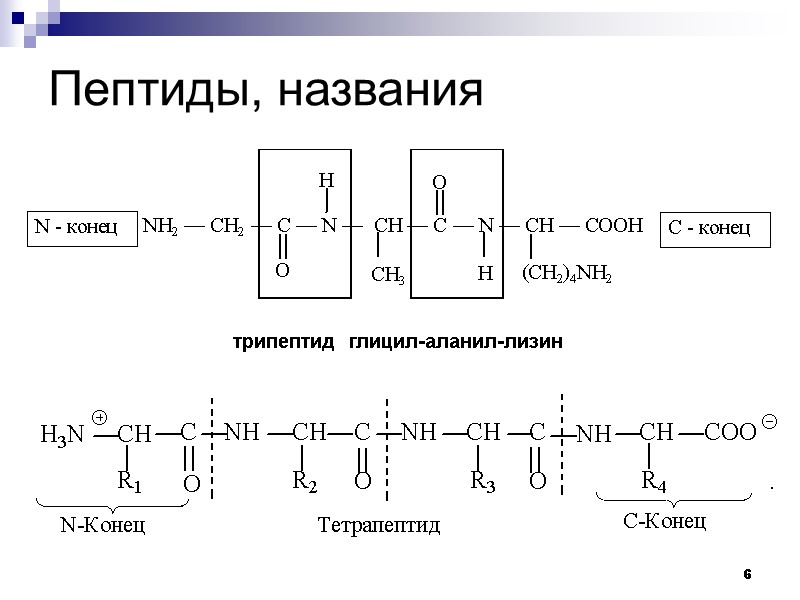
Гли-ала-лиз
28.Назовите данный трипептид:
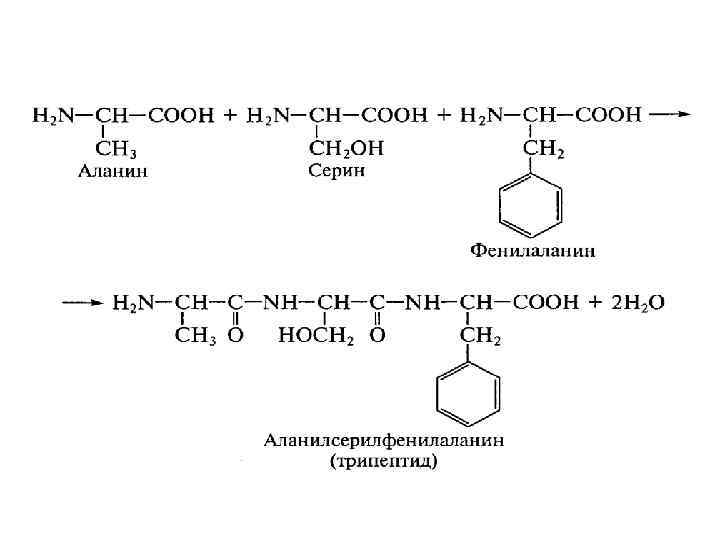
Аланин-серин-фенил-аланин
29.Назовите данный трипептид:
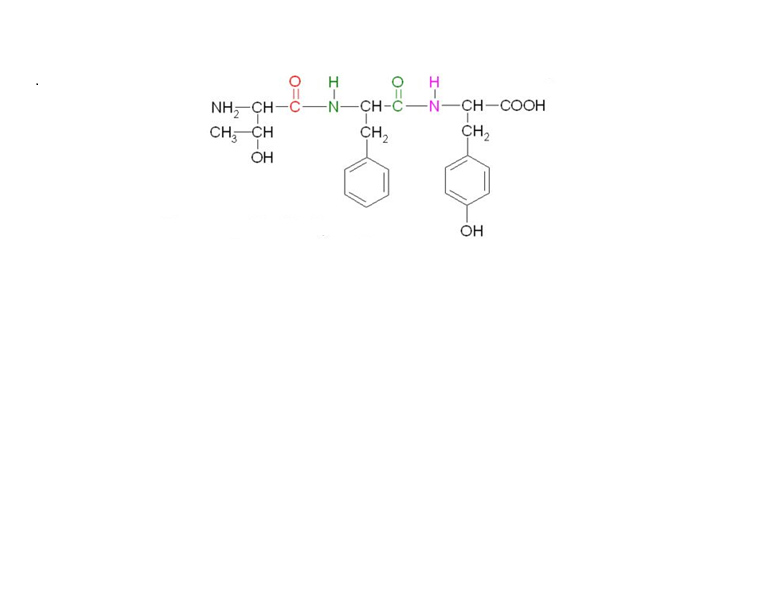
Треонил-фенилаланин-тирозин
30. Подберите к каждой из аминокислот соответствующее свойство радикала (подберите к буквам соответствующие цифры, например: А-1, Б-2):
1.Триптофан. |
A – гидрофильный, |
2.Аспарагиновая кислота. |
положительно заряженный.5 |
3.Цистеин. |
Б – гидрофильный, 2 |
4.Лейцин. |
отрицательно заряженный. |
5.Аргинин. |
В – гидрофильный, незаряженный.3,6 |
6.Серин. |
Г – гидрофобный.1,4 |
31. Разные уровни структурной организации белков стабилизированы определёнными типами связей (подберите к буквам соответствующие цифры, например: А-1, Б-2, 3, 4):
1. Ковалентные связи между карбоксильными и аминогруппами радикалов аминокислот. |
|
2. Связь между α- амино- и α-карбокси-группировками аминокислот. |
A2 – Первичная структура. |
3. Связь между радикалами цистеина. |
|
4. Водородные связи между пептидными группировками. |
Б4 – Вторичная структура. |
5. Водородные связи между радикалами аминокислот. |
В1,3,5,6 – Третичная структура. |
6. Гидрофобные взаимодействия радикалов аминокислот. |
|
32. Дан фрагмент пентапептидной цепи: серил-лизил-лейцил-цистеил-валин. Выберите аминокислоты, которые могут участвовать в образовании (подберите к буквам соответствующие цифры, например: А-1, Б-2, 3 ,4):
|
1. Серин. |
А 1,4– Водородной связи. |
2. Лизин. |
Б 2– Ионной связи. |
3. Лейцин. |
В3,5 – Гидрофобного взаимодействия. |
4. Цистеин. |
|
5. Валин. |
33. Какие из перечисленных факторов могут изменять конформацию белковой молекулы (подберите к буквам соответствующие цифры, например: А-1, Б-2, 3 ,4):
А1,3,5 – регулировать биологическую активность белков; |
|
|
|
Б2,4 – вызывать денатурацию белка.
|
|
|
|
|
34. Кислые белки характеризуются:
преобладанием дикарбоновых аминокислот;
равным соотношением диаминомонокарбоновых и моноаминодикарбоновых аминокислот;
преобладанием диаминомонокарбоновых кислот;
состоит из моноамино- и монокарбоновых кислот.
35. Белки характеризуются:
амфотерными свойствами;
отсутствием специфической молекулярной организации;
сохранением структуры молекулы при кипячении;
неспособностью кристаллизоваться.
36. Первичная структура белка – это:
конфигурация полипептидной цепи;
способ укладки полипептидной цепи в определенном объеме;
порядок чередования аминокислот в полипептидной цепи;
количественный состав аминокислот в полипептидной цепи.
37. Вторичная структура – это:
альфа-спираль, бета-складчатость и аморфные участки;
конфигурация полипептидной цепи;
образование протомера;
способ взаимодействия нескольких протомеров в пространстве.
38. Третичная структура белка – это высшая ступень организации для:
олигомерных белков;
мономерных белков;
доменных белков;
порядок чередования аминокислот в полипептидной цепи.
39. Связи, стабилизирующие α-спираль:
водородные;
гидрофобные;
пептидные;
ионные.
40. Четвертичная структура – это:
пространственная укладка протомера;
пространственная укладка нескольких протомеров;
α-спираль и β-структура;
образование доменов.
41. Нативные свойства олигомерных белков проявляются при формировании:
α-спирали;
четвертичной структуры;
β-структуры;
третичной структуры;.
42. Взаимодействие субъединиц в олигомерном белке осуществляется за счет:
всех типов связей;
только ковалентных связей;
только гидрофобных связей;
ионов металлов.
43. Нативные свойства мономерных белков проявляются при формировании:
α-спирали;
четвертичной структуры;
третичной структуры;
вторичной структуры.
44. Обратимая денатурация белка происходит при:
длительном нагревании;
действии сильных кислот;
кратковременном воздействии спирта; ?
добавлении солей тяжелых металлов.
45. При денатурации белка происходит:
изменение пространственной организации молекулы;
связывание ионогенных групп;
разрыв α-спирали
сохранение конформации белка.
46. Необратимая денатурация происходит при:
высаливании;
кратковременном воздействии спирта;
действии сильных кислот;(серная конц)
воздействии постоянного электрического поля.
47. Какой заряд имеет белок в изоэлектрической точке?
положительный;
отрицательный;
заряда не несет;
любой.
48. Укажите суммарный заряд в нейтральной среде для тетрапептида
глицил-аспарагил-лизил-гистидин:
положительный;
отрицательный;
заряда не несет;
нейтральный.
49. Укажите аминокислоты, радикалы которых имеют при pH=7.0 отрицательный заряд:
лизин;
серин;
треонин;
глутаминовая кислота;
аргинин;
аспарагин.
50. О чём позволяет судить биуретовая реакция:
о наличии белков в биологической жидкости;
о первичной структуре белка;
о наличии аминокислот в белке;
о функциях белков.
51. Из приведённых ниже аминокислот выберите те, радикалы которых могут участвовать в образовании водородных связей:
аспарагиновая кислота;
глицин;
глутаминовая кислота;
серин;
валин;
лизин;
гистидин.
52. Выберите пары аминокислот, способные образовывать связи при формировании третичной структуры белка:
серин, аланин;
аланин, валин;
глутамин, аспарагиновая кислота;
цистеин, цистеин;
гистидин, аспарагиновая кислота;
фенилаланин, аргинин;
цистеин, аланин;
глутаминовая кислота, лизин.
53. Чем определяется растворимость белка в водной среде:
ионизацией белковой молекулы;
гидратацией белковой молекулы при растворении;
формой молекулы белка;
наличием в структуре гидрофильных аминокислот;
54. Что происходит с белком при денатурации:
уменьшение растворимости;
изменение степени гидратации;
осаждение;
сохранение нативной структуры;
изменение молекулярной массы;
потеря биологических свойств.
55. Какие из перечисленных ниже факторов могут вызвать денатурацию белка:
температура выше 600С;
взаимодействие с лигандом (субстратом, эффектором-регулятором, кофактором);
отщепление части полипептидной цепи при действии протеолитических ферментов;
значительные изменения pH;
изменение модификации белков (присоединение фосфатной, метильной или ацетильной группировки к молекуле белка);
действие солей тяжёлых металлов;
действие солей щёлочноземельных металлов.
56. Лактамы – это……. Применяют для ……
1) циклические амиды карбоновых кислот; для получения полимеров;
2) β-лактамные антибиотики; для антибиотикотерапии;
3) вещества, которые ингибируют β-лактамазы; для разрушения β-лактамных антибиотиков.
4) органические вещества, содержащие карбонильную группу и несколько гидроксильных групп; участвуют в построении АТФ, ДНК и РНК.
57. Дикетопиперазины – это…
1) пятичленные карбоциклические соединения, производные имидазола.
2) шестичленные гетероциклические соединения, производные пиперазина.
3) шестичленные гетероароматические соединения, производные оксазолов.
4) шестичленные ароматические соединения, производные пиридина.
58. Аминокислоту можно получить при гидролизе:
1) глицилглицина;
2) фенилацетата;
3) этилбензоата;
4) пропил изоцитрата.
59. Кто впервые доказал, что аминокислоты соединяются в белках кислотно-амидными связями (-СО-NH-)
1) Фишер
2) Либих
3) Данилевский
4) Мульдер
5) Самнер
60. Аминокислоты широко используют в:
1) медицине
2) сельском хозяйстве
3) пищевой промышленности
4) металлургии
