
- •18. Влияние катализатора на скорость химической реакции.
- •19. Химическое равновесие. Принцип Ле-Шателье.
- •20. Основы химической термодинамики. Энтальпия системы.
- •21. Понятие об энтропии.
- •22. Соотношение между величиной изменения энергии Гиббса и величинами энтальпии и энтропии реакции.
- •23. Дисперсные системы. Коллоидные растворы.
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •24. Растворимость веществ.
- •25.Состав растворов. Способы выражения состава растворов.
- •26. Основные положения теории электролитической диссоциации.
- •27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •30. Обменные реакции в растворах электролитов.
- •31. Условия образования и растворения осадков.
- •32. Диссоциация воды. Константа диссоциации, ионное произведение воды.
- •33. Гидролиз солей. Механизм гидролиза.
- •34. Окислительно-восстановительные реакции. Основные типы окислительно-восстановительных реакций.
- •35. Принцип электронного баланса.
- •36. Метод полуреакций.
27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
Электролиты – вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты – вещества, растворы или расплавы которых не проводят электрический ток.
Диссоциация – распад соединений на ионы.
Степень диссоциации – отношение числа продиссоциированных на ионы молекул к общему числу молекул в растворе.
Диссоциация электролита количественно характеризуется степенью диссоциации. Степень диссоциации a – это отношение числа молекул, диссоциированных на ионы n., к общему числу молекул растворенного электролита N:
a = n/N * 100%
a – доля молекул электролита, распавшихся на ионы.
Степень диссоциации электролита зависит от многих факторов: природы электролита, природы растворителя, концентрации раствора, температуры.
28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
Согласно теории Дебая — Гюккеля, сильные электролиты полностью диссоциированы на ионы. Однако свободному движению частиц в жидкости препятствуют электростатические силы, действующие между ионами. В растворе, так же как и в кристалле, каждый ион окружен ионами противоположного знака, так называемой ионной атмосферой, которая перемещается вместе с центральным ионом и ограничивает его подвижность. В результате электропроводность раствора сильного электролита оказывается меньше той величины, которая должна быть, если бы все ионы могли беспрепятственно перемещаться в электрическом поле. Следовательно, создается впечатление, что в растворах сильных электролитов число свободных ионов меньше, чем их общая (аналитическая) концентрация. Поэтому для характеристики сильного электролита вводится понятие эффективной (т. е. проявляющей себя в действии) концентрации ионов, называемой также активностью а. Эта величина аналогична концентрации свободных гидратированных ионов (согласно теории электролитической диссоциации)
Суть диссоциации сильных электролитов заключается в том, что они диссоциируют полностью, необратимо:
AB = A+ + B-.
Истинная степень диссоциации сильных электролитов равна всегда 100 % (1,0 доли ед. ).
В растворах сильных электролитов ионов очень много (особенно при повышенных концентрациях). Отсюда две особенности растворов сильных электролитов:
• расстояния между ионами очень малы, иногда всего в 2-3 раза больше, чем в кристаллической решетке;
• количество ионов электролита соизмеримо с количеством молекул воды, и поэтому не все ионы могут быть гидратированы молекулами воды.
Кажущаяся степень диссоциации учитывает активные ионы, принявшие участие в физических и химических процессах.
Истинная степень диссоциации сильных электролитов всегда равна 1,0, кажущаяся степень диссоциации возрастает с повышением температуры раствора и понижением концентрации раствор
29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
Кислота – соединение, образующее пи диссоциации в водном растворе из положительных ионов только ионы водорода Н+.
Свойства кислот: взаимодействие с основаниями с образованием солей;взаимодействие с некоторыми металлами с выделением водорода;изменение цвета индикаторов, в частности, вызывать красную окраску лакмуса;кислый вкус.
Любая кислота при диссоциации дает выделение водорода. Поэтому все свойства, объясняются присутствием гидратированных ионов водорода. Именно они дают красную окраску лакмусовой бумажки.
H2SO3 ⇆ 2H+ + SO32-, CH3COOH ⇆ H+ = CH3COO-.
Основания – соединения, образующие при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН-.
Свойства оснований: взаимодействие с кислотами с образованием солей; изменение цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса); «мыльный» вкус.
КOH ⇆ К++ OH- , Сa(OH)2 ⇆ Сa2++ 2OH-, NH3·H2O ⇆ NH4++ OH-.
Соли – соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательные ионы кислотных остатков.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы.
Например:
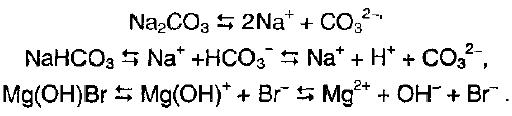
В соответствии с этим делят: Средние соли (Na2CO3);Кислые соли (NaHCO3);Основные соли (Ca(OH)Cl).
