
- •Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
- •Основные понятия химии
- •Основные стехиометрические законы.
- •4. Важнейшие классы и номенклатура неорганических веществ.
- •5. Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
- •6. Строение электронных оболочек атомов.
- •7. Периодический закон и периодическая система элементов.
- •8. Периодичность свойств химических элементов.
- •9. Природа химической связи. Основные типы химической связи.
- •10. Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
- •11. Свойства ковалентной связи. Степень окисления атома.
- •12. Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
- •13. Основы метода валентных связей и метода молекулярных орбиталей.
- •14. Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие
- •15. Кристаллическое, жидкое и аморфное состояние веществ.
- •16. Скорость химических реакций. Константа скорости и ее физические свойства
- •17. Влияние температуры на скорость химических реакций. Основные положения теории активации Аррениуса.
- •18. Катализ. Влияние катализаторов на скорость химических реакций.
- •19. Необратимые и обратимые реакции. Принцип Ле Шателье.
- •20. Дисперсные системы и их характеристика. Коллоидные растворы
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •21. Растворение как физико-химический процесс.
- •22. Растворимость веществ. Состав растворов.
- •23. Основные положения теории электролитической диссоциации.
- •24. Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26. Константа диссоциации слабых электролитов. Закон разбавления Оствальда
- •27. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28. Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29. Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30. Гидролиз солей. Количественные характеристики гидролиза.
- •31. Теория окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
- •32. Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33. Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34. Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •35. Основные положения координационной теории. Строение комплексного соединения.
- •36. Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37. Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •38. Галогены. Общая характеристика элементов. Особенности фтора. Свойства простых веществ галогенов.
- •39. Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40. Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41. Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42. Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •43. Вода. Клатраты. Вода как растворитель. Вода в природе и ее роль в жизнедеятельности организмов. Пероксид водорода.
- •44. Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45. Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •52. Фосфорные удобрения. Сложные минеральные удобрения.
- •1. Мышьяк
- •2. Сурьма
- •3. Висмут
- •54.Общая характеристика элементов iva группы. Способность
- •56.Кислородсодержащие соединения углерода. Оксиды углерода.
- •57. Угольная кислота и ее соли. Временная жесткость воды и
- •57.Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59.Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
20. Дисперсные системы и их характеристика. Коллоидные растворы
Дисперсными системами называются гетерогенные системы, в которых одно вещество распределено в другом в виде частиц различных размеров.
Любая дисперсная система состоит по меньшей мере из двух частей — дисперсной фазы в виде совокупности мельчайших частиц вещества и дисперсионной среды, в которой распределена дисперсная фаза. Размеры частиц дисперсионной фазы (кристалликов, капелек, пузырьков) отличаются степенью дисперсности, величина которой прямо пропорциональна размеру частиц.
Классификация дисперсных систем
1. По степени дисперсности различают грубодисперсные системы (взвеси) с размером частиц более 100 нм и тонкодисперсные (коллоидные) с размером частиц от 1 до 100 нм.
Взвесь — смесь веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе во взвешенном (не осевшем) состоянии.
Коллоидный раствор – это гетерогенная система, в которой граница раздела фаз может быть обнаружена только оптическим микроскопом. Предельным случаем тонкодисперсных систем являются истинные растворы.
Истинный раствор – это гомогенная однофазная система, в которой нет поверхности раздела, с размером частиц менее 1 нм, т.е. она состоит из отдельных ионов и молекул.
Можно сравнить: дисперсионная среда похожа на растворитель, а дисперсная фаза – на растворенное вещество.
2. По интенсивности взаимодействия частиц дисперсной фазы и дисперсионной среды дисперсные системы делятся на две группы: лиофильные и лиофобные.
Лиофильные системы характеризуются тем, что молекулы дисперсионной среды в значительной степени взаимодействуют с частицами дисперсной фазы (сольватируются), образуя вокруг нее оболочку. Эти системы характеризуются низким значением поверхностного натяжения и имеют предельно высокую дисперсность. К таким системам относятся растворы ВМС (например, желатин, целлюлоза, крахмал и т.д.).
Лиофобные системы не образуют сольватной оболочки из дисперсионной среды вокруг частиц дисперсной фазы. В таких системах взаимодействие между частицами различных фаз значительно слабее. Значение межфазного поверхностного натяжения велико, вследствие чего система проявляет тенденции к самопроизвольному укрупнению частиц дисперсной фазы. Такие системы образуют неорганические и органические вещества плохо растворимые в данной среде.
3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
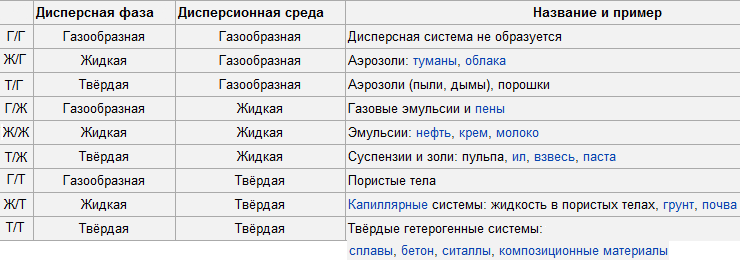
Пути образования дисперсной системы:
Конденсационный – связан с зарождением новой фазы в перенасыщенной исходной фазе. Эта перенасыщенная исходная фаза впоследствии становится дисперсной средой.
Диспергационный – осуществляется при значениях поверхностного натяжения ниже некоторого критического значения.
Возможно образование дисп. системы в результате химической реакции в гомогенной среде. При этом продукты реакции при данных условиях находятся в агрегатном состоянии, отличном от материнской фазы.
21. Растворение как физико-химический процесс.
Раствор– это однородная смесь переменного состава, состоящая из растворяемого вещества, растворителя и продуктов их взаимодействия.
Раствор, в котором данное вещество при определённой температуре больше не растворяется, называется насыщенным, а раствор, в котором это вещество ещё может растворяться, ненасыщенным.
Растворы бывают концентрированными и разбавленными. Если в определённом объёме раствора содержится мало растворённого вещества, то такой раствор называется разбавленным, а если много – концентрированным. Однако совсем не обязательно, чтобы концентрированный раствор был насыщенным, а разбавленный – ненасыщенным. Например, если в 1 л раствора содержится 1 кг сахара, то понятно, что такой раствор будет очень концентрированным, но растворимость сахара настолько велика, что он может в данном растворе ещё растворяться, поэтому данный раствор является ненасыщенным. Или если в 1 л раствора содержится всего 1,5·10– 3г аргентум хлорида, который больше не растворяется, то этот раствор из-за плохой растворимости AgCl уже будет насыщенным, но очень разбавленным, так как растворённого вещества в растворе содержится очень мало.
Кристаллогидраты
Если растворитель – вода, то продукты присоединения молекул воды к частицам растворяемого вещества называются гидратами, а процесс их образования –гидратацией.
Гидраты – очень неустойчивые соединения, и при выпаривании воды из раствора они легко разрушаются. Однако некоторые гидраты могут удерживать воду даже в твёрдом кристаллическом состоянии, например CuSO4·5H2O – медный купорос (купрум (II) сульфат пентагидрат), FeSO4·7H2O – железный купорос (феррум (II) сульфат гептагидрат), Na2SO4·10H2O – глауберова соль (натрий сульфат декагидрат) и др. Такие вещества называюткристаллогидратами. Кристаллогидратами является большинство природных минералов. Много веществ получают в чистом виде в форме кристаллогидратов
