
Король А. В. / Лекции Король А. В. / Лекция 6
.pdf
Лекция 6 Основы термодинамики
6.1Внутренняя энергия
Любая т/д система характеризуется внутренней энергией U:
U= энергия хаотического движения молекул + энергия взаимодействия молекул
Квнутренней энергии не относятся: кинетическая энергия движения тела как целого и его потенциальная энергия во внешних полях.
Внутренняя энергия – функция т/д состояния системы, т.е. в каждом состоянии система обладает определенной U.
Следовательно: |
|
|
U не зависит от того, каким образом система пришла в дан- |
P |
|
2 |
||
ное состояние; |
При переходе системы из одного состояния ("1") в другое |
|
состояния ("2") изменение внутренней энергии определяется |
|
только разностью значений внутренней энергии этих состояний |
1 |
и не зависит от пути перехода: |
|
∆U = U2 U1: |
V |
6.2Число степеней свободы
Число ст. св. = числу координат, определяющих положение системы = числу независимых движений системы
(a)Молекула одноатомного газа материальная точка (3 координаты: (x; y; z)).
=) 3 ст. св. поступательного движения (вдоль X; Y; Z).
(b)Молекула двухатомного газа 2 материальных точки (6 координат: (xj; yj; zj) где j = 1; 2).
=) 6 ст. св. = 3 ст. св. поступательного движения
+2 ст. св. вращательного движения
+1 ст. св. колебательного движения
Z  (a)
(a)
Y
X
(b)
(c) Молекула трехатомного газа 3 материальных точки (9 координат: (xj; yj; zj) где j = 1; 2; 3).
=) 9 ст. св. = 3 ст. св. поступательного движения
+3 ст. св. вращательного движения
+3 ст. св. колебательного движения
(c) |
А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 41
Общий случай – n-атомная молекула
число ст. св. = 3n = iпост +iвращ + iкол
|{z}
|
|
|
|
8 |
|
=3 |
|
|
|
|
0 |
для n = 1; |
|
|
|
|
|
< |
||
где |
i |
вращ |
= |
2 |
для n = 2; |
|
|
|
3 |
для n 3: |
n |
iвращ: |
iкол = 3: iпост |
Для жёстких молекул колебательным движением пренебрегается:
=) число ст. св. жёстких молекул = iпост + iвращ:
Для многих газов колебательными степенями свободы можно пренебречь вплоть до температур T 103 K.
(Объяснение этого явления даётся в рамках квантовой механики.)
Пример: Найти число степеней свободы молекулы спирта C2H5OH.
Число атомов: n = 9. =) число ст. св. = 3n = 27.
Из них: iпост = 3, iвращ = 3, iкол = 27 6 = 21.
6.3Закон Больцмана о равномерном распределении энергии по степеням свободы
Ранее получали связь средней энергии поступательного движения с температурой (см. Лекцию 5):
"пост m0 v2 = 3kT:
2 2
Поскольку ни одна из поступательных степеней свободы не имеет преимущества, то
vx2 = vy2 = vz2 =) |
1 |
2kT = средней энергии каждой пост. ст. своб. |
Более общее утверждение (можно строго доказать):
Закон Больцмана о равномерном распределении энергии по ст. св.:
для системы, находящейся в состоянии т/д равновесия, на каждую поступательную и вращательную степени свободы приходится (в среднем) кинетическая энергия, равная kT=2, а на каждую колебательную степень свободы – энергия, равная kT .
Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится не только кинетическая энергия, но и потенциальная (т.к. атомы внутри молекулы взаимодействуют), причем
кин. энергия = пот. энергия = kT2
А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 42
Таким образом, средняя энергия движения молекулы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
"пост |
|
= |
iпост |
kT |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
iвращ2 |
|||||||
|
|
|
|
|
|
|
|
|
|
i |
|
|
> |
|
"вращ |
|
= |
|
|
|
|
kT |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
" |
= " |
пост |
+ " |
вращ |
|
+ " |
кол |
|
|
kT; |
где |
> |
|
|
|
|
|
|
|
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
> |
|
" |
кол |
|
|
= i |
кол |
kT |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
< |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
i = iпост +iвращ + 2iкол: |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
> |
|
|
|
|
|
|
|
|
|
|
|
|
Для жестких молекул |
i |
кол |
= 0 = i = i |
пост |
+ i |
: |
|
|
|{z} |
|
|
|
|
|
||||||||||||
|
|
) |
|
вращ. |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
В идеальном газе потенциальная энергия взаимодействия молекул равна нулю, поэтому |
||||
внутренняя энергия газа, содержащего N частиц, определяется средней энергией дви- |
||||
жения его молекул: |
|
|
|
|
i |
N i |
m i |
i |
(6.1) |
U = N " = N 2 kT = |
NA 2RT = |
2RT = |
2 RT: |
|
6.4 Первое начало термодинамики
I-е начало термодинамики – это закон сохранения и превращения энергии в термодинамических процессах.
Внутреннюю энергию системы можно изменить двумя способами:
(1) Совершая над системой работу
(напр., сжимая газ в цилиндре с помощью поршня увеличиваем T и, =), U);
(2) Сообщая системе теплоту
(напр., нагревая газ в герметичном сосуде).
Рассмотрим произвольную замкнутую, макроскопически |
P |
|
|
|
COCT. 2 |
||
неподвижную систему, не находящуюся во внешних сило- |
|
||
|
(U2) |
||
вых полях и проанализируем с энергетической точки зре- |
|
|
|
ния равновесный процесс перехода системы из какого-либо |
|
COCT. 1 |
|
начального состояния 1 (с внутренней энергией U1), в дру- |
|
||
|
(U1) |
||
гое состояние 2 (с внутренней энергией U2). |
|
|
|
|
V |
||
|
|
||
Опыт показывает: |
|
|
|
Изменение внутренней энергии системы ∆U = U2 U1 |
в таком процессе равно разности |
||
между количеством теплоты Q, полученным системой, и работой A, совершенной системой |
|||
против внешних сил ∆U = Q A или Q = ∆U + A. |
|
|
|
I-е начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил: Q = ∆U +A.

А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 43
I-е начало термодинамики в дифференциальной форме: Q = A + dU.
Здесь: dU (полный дифференциал) - бесконечно малое изменение внутренней энергии системы, A – элементарная (бесконечно малая) работа, Q – бесконечно малое количество теплоты.
A и Q не являются полными дифференциалами.
Дело в том, что внутренняя энергия системы является однозначной функцией состояния системы. Отсюда следует, что при совершении системой произвольного процесса,
в |
результате которого она совершает переход Сост1 |
! |
Сост2, изменение внутренней энергии |
||||||||
|
|
|
2 |
|
|
|
|
|
|||
∆U = |
|
1 dU сводится к разности U2 |
U1 значений вн. энергии в конце и начале процесса. |
||||||||
Т.о., |
величина ∆U не зависит от способа перехода из Сост1 в Сост2 |
||||||||||
|
∫ |
|
|
12 A и теплота Q = 12 Q являются функция- |
|||||||
Напротив, совершаемая работа A = |
|||||||||||
ми процесса |
Сост1 |
! |
Сост2 |
. Как следтствие, A и Q не могут быть |
|||||||
|
|
|
|
, т.е. способа перехода |
∫ |
|
|
|
|
∫ |
|
представлены в виде разностей каких-то значений, соответствущих начальному и конечному состояниям.
Все величины входящие в первое начало термодинамики могут быть как положительными, так и отрицательными:
Если к системе подводится теплота, то Q > 0; если теплота отводится, то Q < 0.
Если система совершает работу над внешними телами, то A > 0, если же внешние силы совершают работу над системой, то A < 0.
Если система, совершая процесс возвращается в начальное состояние (т.н. круговой процесс), то ∆U = 0. Следовательно, в круговом процессе Q = A.
Отсюда следует невозможность вечного двигателя I-го рода: невозможен периодически действующего двигатель, совершающего б´ольшую работу, чем сообщенная ему извне теплота: A > Q.
6.5 |
Работа газа |
|
|
|
|
Найдем работу, совершаемую газом при изменении его объема. |
|
S |
|
|
|
|
|
P |
|
|
|
Пример: газ, находящийся под поршнем в цилиндрическом сосуде. |
|
dl |
|
|
|
|
|
|
|
|
|
Расширяясь, газ передвигает поршень на расстояние dl, и про- |
P |
|
|
|
|
изводит элементарную работу |
|
|
|
||
|
A = F dl = P Sdl = P dV: |
|
|
|
|
Полная работа, совершаемая газом при V1 ! V2: |
dA=PdV |
|
|
||
|
V |
|
|
||
|
|
|
|
|
|
|
A = ∫V1 2 P dV: |
V |
dV |
V |
V |
Результат интегрирования определяется характером зависимости P (V ). |
1 |
|
2 |
||
|
|
|
|
||
Графически, абсолютное значение jAj работы совершаемой при V1 |
! V2 |
равно |
|||
А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 44
площади под кривой P = P (V ) ограниченной участком от V = V1 до V = V2.
{
При этом:
A > 0 если V1 < V2 (расширение)
A < 0 если V1 > V2 (сжатие)
6.6Теплоемкость
Теплоемкость C = отношение количества тепла Q, полученного телом, к соответствующему приращению dT его температуры:
С= dQT ; [C] = Дж/К:
Удельная теплоемкость Cу = количеству теплоты, необходимому для нагревания 1 кг вещества на ∆T = 1К:
1 Q
Cу = m dT ; [Cу] = Дж/(кг К):
Молярная теплоемкость C = количеству теплоты, необходимому для нагревания 1 моля вещества на ∆T = 1К:
C = |
1 Q |
[C ] = Дж/(моль К): |
|||
|
|
|
|||
dT |
|||||
|
|
||||
Связь молярной и удельной теплоёмкостей: C = Су.
Везде далее рассматривается молярная теплоемкость для 1-го моля: = 1. Индекс у C опускаетсятся.
Теплоемкость зависит от процесса, происходящего с телом.
Наиболее часто используемые теплоемкости:
CV – теплоемкость при постоянном объеме (т.е. в изохорическом процессе); CP – теплоемкость при постоянном давлении ( в изобарическом, процессе).
6.6.1Вычисление CV и CP для идеального газа
Используя понятие теплоемкости, запишем I-е начало термодинамики в виде:
CdT = Q = A + dU:
Рассмотрим это равенство при V = const и P = const
Если V = const, то A = pdV = 0 и Q = dU. Учитывая, что U = iRT=2 (см. ф. (6.1)),
получаем:
|
Q |
|
|
|
|
|
|
|
|
dU |
|
|
iR |
|
|
=3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CV = |
dT |
|
V =const |
= |
dT |
= |
|
2 |
где i = iпост +iвращ + 2iкол: |
|||||||||||||
Если P = |
|
|
|
|
, то |
|
|
|
|
|
|
|
|
|
|
|
|
|{z} |
||||
|
|
const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
dU |
|
|
|
|
|
|
|
|
pdV |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CP = dT |
|
|
|
|
+ |
|
|
|
dT |
|
|
|
|
= CV + R |
||||||||
|
P =const |
|
|
|
P =const |
|||||||||||||||||
| |
|
|
|
|
{z |
|
|
|
} |
|
| |
|
|
|
{z |
|
|
} |
|
|||
= |
|
|
|
|
|
V |
|
=R |
т.к. |
|
|
|
|
|
||||||||
|
|
iR=2=C |
|
|
|
|
|
|
|
pdV =RdT |
|
|||||||||||

А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 45
Следовательно:
CP = CV + R – уравнение Майера.
Неравенство CP > CV справедливо для любых тел. Его смысл: дополнительное тепло при P = const идет на совершение работы при расширении.
Отношение теплоёмкостей CP =CV = называется показателем адиабаты (или, коэффициентом Пуассона).
|
|
i |
|
|
CP |
|
i + 2 |
|
||
Для идеального газа: |
CV = |
|
R |
= |
= |
= |
: |
|||
2 |
||||||||||
|
|
|
||||||||
{ |
CP = CV + R |
) |
|
CV |
|
i |
|
|||
При T 103 K колебательными степенями свободы можно пренебречь. Поэтому, для жестких молекул:
(a) для одноатомного газа: |
i = 3 |
=) |
= 5=3; |
(b) для 2-x–атомного газа: |
i = 5 |
=) |
= 7=5; |
(c) для 3-x-атомного газа: |
i = 6 |
=) |
= 8=6: |
6.6.2Зависимость теплоемкости от температуры
Проведенное выше рассмотрение предсказывает:
CV = 2i R — не зависит от T !!
Однако, эксперимент показывает, что CV |
# при T #. |
||||||||||||||
Например, для 2-x атомной молекулы (i = 3 + 2 + 2 1 = 7), |
|||||||||||||||
вместо CV = 7R=2 получается: |
|
|
|
|
|
|
|
|
|
7 |
R |
||||
|
|
iпост |
|
|
|
3 |
|
|
|
2 |
|||||
|
|
|
|
|
|
|
|
|
|||||||
T 10 K : |
|
|
|
|
|
|
|
|
|
|
|||||
CV = |
|
|
|
R = |
|
R |
|
|
|
5 |
R |
||||
2 |
|
2 |
|
|
|||||||||||
|
|
|
|
2 |
|||||||||||
2 |
|
iпост + iкол |
|
5 |
3 |
|
|||||||||
T 10 K : |
CV = |
|
|
|
|
|
|
|
|
R = |
|
R |
|
|
R |
|
|
|
|
|
|
|
|
||||||||
|
|
|
2 |
|
|
|
2 |
|
2 |
||||||
T 103 K : |
|
i |
7 |
|
|
|
|
|
|
|
|
|
|||
CV = |
|
R = |
|
|
R |
|
|
|
|
|
|
|
|
||
2 |
2 |
|
|
|
|
|
|
|
|
||||||
CV |
|
|
|
50 |
500 |
5000 |
T (K) |
т.е. происходит "замораживание" колебательных (при T 103 K) и вращательных (при T 102 K) степеней свободы.
Объяснение такому поведению CV (T ) можно дать только в рамках квантовой теории.
6.7Применение I-го начала термодинамики к изопроцессам
Изопроцесс – равновесный процесс, при котором один из основных параметров состояния сохраняется постоянным.
А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 46
6.7.1Изохорный процесс, V = const
P –V диаграмма процесса – изохора — прямая ? оси V . dV = 0 =) A = P dV = 0.
Применяя I-е начало термодинамики:
Q = dU = CV dT
=) Q = ∆U = CV (|T2 {z T1}) = CV ∆T
=∆T
P |
(a) |
P
1
P
2
V V
6.7.2 Изобарный процесс, P = const
P V диаграмма – изобара – прямая ? оси P . Используя P V = RT , находим:
∆U = CV ∆T
V |
|
|
|
|
|
|
|
|
|
|
|
|
A = ∫V1 |
2 pdV = p ( |
V2 V1)= R ∆T |
|
|
||||||||
|
|
|
|
|
|
|
||||||
=∆V |
P |
|
||||||||||
) |
|
V |
| {z |
} |
|
V |
|
∆T |
||||
= Q = A + C |
|
∆T = (R + C ) ∆T = C |
|
|||||||||
|
|
|
| |
|
|
|
|
} |
|
|
||
|
|
|
={zP |
|
|
|
||||||
|
|
|
|
|
|
|
C |
|
|
|
|
|
P |
(b) |
P
A
V |
V |
V |
1 |
2 |
При расширении: нагревание (∆T > 0) и A > 0, при сжатии: охлаждение (∆T < 0) и A < 0.
6.7.3Изотермический процесс, T = const
PV диаграмма – изотерма – гипербола P / 1=V .
dT = 0 =) dU = CV dT = 0 |
P |
|
(c) |
||||
|
|
|
|||||
=) Q = A =) Q = A |
|
P |
|
|
|||
|
|
|
|
|
|
|
|
Теплота и работа: |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||
|
V2 |
|
V2 |
V |
P |
|
|
|
|
2 |
|
|
|||
Q = A = |
∫V1 |
pdV = RT |
∫V1 |
dV |
|
A |
|
= RT lnV2 = RT lnP1 : |
|
|
|
||||
|
|
V1 |
P2 |
|
V |
V |
V |
|
|
|
|
|
1 |
2 |
|
При расширении A > 0, при сжатии A < 0. |
|
|
|
||||
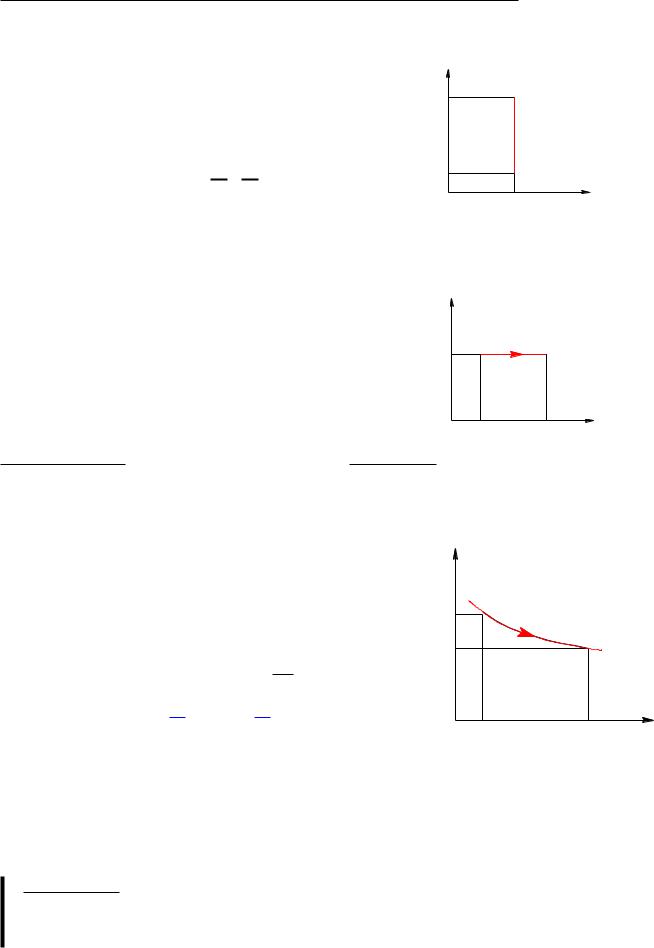
6.8Адиабатический процесс
Адиабатический процесс – процесс, в котором отсутствует теплообмен ( Q = 0)
между системой и окружающей средой.
В реальности, должно выполняться неравенство:
∆t
∆t – длительность процесса,
– характерное время, необходимое для теплообмена.

А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 47
Уравнение адиабатического процесса |
|||||||
Применяя I-е начало термодинамики: |
|||||||
|
|
|
|
|
=) |
iR |
|
dU + A = 0 |
|
dT = P dV |
|||||
2 |
|||||||
Используя ур-ие Менделеева-Клапейрона, можно получить: |
|||||||
|
dP |
|
dV |
=) P V = const – ур-ие адиаб. проц. |
|||
|
|
= |
|
|
|||
|
P |
|
V |
||||
= CP =CV |
> 1 – показатель адиабаты (коэффициент Пуассона). |
||||||
Эквивалентные |
формы записи ур-ия адиабатического процесса: |
|
P V = const |
=) T V 1 = const |
=) P 1 T = const |
|
RT=V |
V = RT=P |
|
P =|{z} |
|{z} |
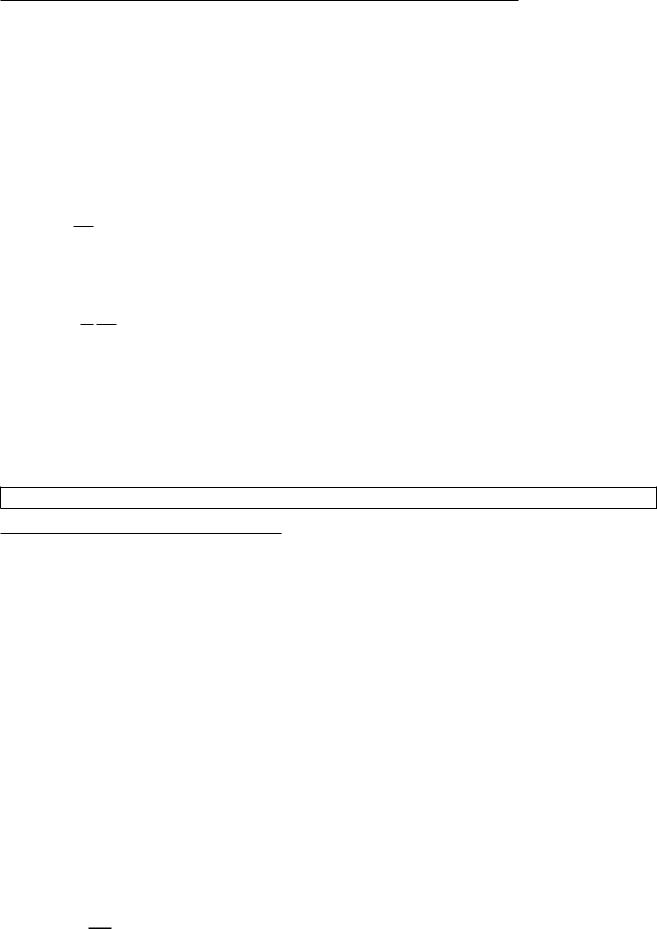
P V диаграмма адиабатического процесса (= aдиабата)
P V = const =) P / V1 — адиабата
Адиабата идет круче изотермы (P / 1=V ) т.к. > 1.
Это объясняется тем, что при адиабатическом сжатии увеличение P газа обусловлено не только уменьшением его V , но и повышением T .
Работа при адиабатическом изменении объема.
Из I-го начала термодинамики: A = |
dU = |
RdT |
|||||
|
P |
V1 |
|
|
V1 |
1 |
|
=) A = R(T2 T1) = |
1 |
|
[1 |
( |
|
) |
] |
|
1 |
V2 |
|||||
P |
|
|
|
T=CONST => P 1/V |
|
|
P 1/Vγ |
|
P1 |
|
|
P2 |
|
|
V1 |
V2 |
V |
Сплошная линия — адиабата |
||
Последнее равенство получено с использованием ур-ия адиабатического процесса.

А.В. Король. "Молекулярная физика и термодинамика". Лекция 6 48
6.9Политропный процесс
Политропным называется процесс, в котором теплоемкость C остается постоянной.
Исходя из I-е начала термодинамики можно вывести уравнение политропы, т.е. взаимосвязь давления и объёма газа в политропическом процессе:
P V n = const; где |
n = |
C |
CP |
– показатель политропы. |
|
|
|||
|
|
C |
CV |
|
Рассмотренные выше изохорный, изобарный, изотермический и адиабатический процессы – это частные случаи политропного процесса.
При C = 0 получаем n = (=) политропа = адиабата);
При C = 1 получаем n = 1 (=) политропа = изотерма);
При C = CP получаем n = 0 (=) политропа = изобара);
При C = CV получаем n = 1 (=) политропа = изохора).
Литература: Т. И. Трофимова. "Курс Физики’, §§ 50-55.
