
- •Основные этапы развития биохимии. Место биохимии в системе медицинских наук. Значение биохимических знаний в клинической практике.
- •Аминокислоты: строение и функции. Строение и классификации аминокислот, входящих в состав белков. Физико-химические свойства аминокислот. Применение аминокислот в медицине.
- •Задачи биохимии:
- •2. Основные этапы развития биохимии. Место биохимии в системе медицинских наук. Значение биохимических знаний в клинической практике.
- •Период (середина 20 века по настоящее время):
- •Место биохимии в системе медицинских наук: Может, это то же самое, что связь бх с другими науками в предыдущем вопросе?
- •Биохимия 2. Строение и функции белков.
- •1. Белки: определение, характерные признаки. Развитие представлений о белковых веществах. Биологические функции белков.
- •Характерные признаки:
- •Развитие представлений о белковых веществах:
- •Биологические функции белков (с примерами):
- •2. Аминокислоты: строение и функции. Строение и классификация аминокислот, входящих в состав белков. Физико-химические свойства аминокислот. Применение аминокислот в медицине.
- •Функции аминокислот:
- •Строение и классификация аминокислот, входящих в состав белков:
- •1. Структурная классификация:
- •Редкие аминокислоты белков, это, например:
- •Электрохимическая классификация
- •Биологическая (физиологическая) классификация
- •Физико-химические свойства аминокислот:
- •В) Стереоизомерия аминокислот
- •Применение аминокислот в медицине:
- •3. Уровни структурной организации белковых молекул. Первичная молекула белка.
- •Характеристика пептидной группы:
- •Наследственные нарушения первичной структуры:
- •4. Уровни структурной организации белковых молекул. Вторичная структура белка: альфа-спираль, бета-структура, нерегулярные структуры. Супервторичные структуры белков.
- •Бета-структура (слоисто-складчатая):
- •Нерегулярные структуры:
- •Уровни структурной организации белковых молекул. Третичная и четвертичная структуры. Типы связей, участвующих в формировании этих структур. Доменная структура белков.
- •Связи в третичной структуре:
- •Функциональная роль:
- •7.Физико-химические свойства белков: амфотерные, буферные, коллоидные, осмотические. Высаливание. Денатурация. Свойства денатурированного белка. Ренатурация.
- •А) Амфотерные
- •Б) Буферные
- •В) Коллоидные
- •Г) Осмотические свойства
- •Ультрацентрифугирование
- •Электрофорез белков
- •ХроматографияИонообменая:
- •Б) Аффинная (хроматография по сродству):
- •9. Понятие о простых и сложных белках. Гистоны, альбумины, глобулины: характеристика и биологическая роль.
- •Альбумины:
- •Биологическая роль альбуминов (Из Звягиной):
- •Глобулины:
- •Биологическая роль глобулинов (по Звягиной):
- •Гистоны:
- •10. Особенности структурной организации фибриллярных белков на примере коллагена и эластина.
- •Эластин
- •11. Сложные белки: определение, классификация. Представления о гликопротеинах и протеогликанах. Гликопротеины: строение, свойства и функции.
- •Свойства гликопротеинов:
- •Биологические функции:
- •12. Сложные белки: определение, классификация. Фосфопротеины: характеристика и биологическая роль.
- •Биологическая роль:
- •13. Сложные белки: определение, классификация. Липопротеины: характеристика, биологические функции.
- •Биологические функции липопротеинов (по Строеву):
- •Сложные белки: определение, классификация. Гемпротеины: общая характеристика. Миоглобин: структура и функции.
- •Гемпротеины. Гемоглобин: структура и функции. Производные гемоглобина. Типы гемоглобина. Гликолизированный гемоглобин.
- •Выполняет 2 важные функции:
- •Производные гемоглобина:
- •Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
- •Гемоглобин Ривердейла – Бронкса.
- •16. Функционирование олигомерных белков на примере гемоглобина. Регуляция связывания кислорода с гемоглобином в тканях.
- •17. Нуклеопротеины, нуклеиновые кислоты: общая характеристика. Компоненты нуклеиновых кислот, строение и биологические функции. Физико-химические свойства нуклеиновых кислот.
- •Главные азотистые основания:
- •Азотистые основания способны к лактим – лактамной тауизомерии: (на примере урацила):
- •А это в качестве примера:
- •Например: атф – аденозин – 5′– трифосфат.
- •18. Структурная организация и функции днк. Хроматин. Репликация.
- •Структурная организация и биологические функции рнк. Структура т-рнк и участие в процессах трансляции. Рекогниция.
- •Псевдоуридиновая петля;
- •Роль тРнк в биосинтезе белка:
- •Структурная организация и биологические функции рнк: и-рнк, р-рнк. Трансляция. Структурная организация и биологические функции рнк:
- •Биохимия 3. Ферменты.
- •1. Общие представления о катализе, особенности ферментативного катализа (сходство и различие между ферментами и неферментными катализаторами).
- •«Чем выше энергия активации, тем выше барьер, и тем медленнее протекает реакция».
- •Особенности ферментативного катализа:
- •Б) Различия между ферментами и неферментными катализаторами:
- •2. Структурно-функциональная организация ферментов. Понятие об активном и
- •Функциональные группы активного центра:
- •Группы ферментов:
- •Функциональная роль:
- •Специфичность действия ферментов: виды, примеры и теории, их объясняющие. Виды специфичности ферментов (в порядке снижения специфичности):
- •Теории специфичности ферментов:
- •Механизм действия ферментов: энергетические изменения, этапы, молекулярные механизмы.
- •Молекулярные механизмы:
- •Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН, концентраций фермента и субстрата.
- •Зависимость скорости ферментативных реакций от:
- •Пример конкурентного ингибирования:
- •Фосфорилирование.
- •Глюкагон – инсулин - регулирующая система.
- •9. Единицы и методы измерения активности ферментов. Иммобилизованные ферменты.
- •Единица в системе си:
- •10. Классификация и номенклатура ферментов, основные положения.
- •Пример реакций:
- •Классификация и номенклатура ферментов, основные положения. Лиазы и изомеразы: характеристика, примеры ферментативных реакций.
- •Примеры реакций:
- •Примеры реакций:
- •Классификация и номенклатура ферментов, основные положения. Лиазы и изомеразы: характеристика, примеры ферментативных реакций.
- •Примеры реакций:
- •Примеры реакций:
- •Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов. Химическое строение пиридоксиновых коферментов и биотина: их биологическая роль (с примерами реакций).
- •1. Ионы металлов.
- •Входят в состав дегидрогеназ, участвуют соответственно в реакциях дегидрирования:
- •1. Участвуют в реакциях дегидрогенирования:
- •Декарбоксилирование α - кетокислот:
- •Общее представление о невитаминных коферментах.
- •Реакции с участием нуклеотидных коферментов:
- •Изоферменты: происхождение, биологическая роль, методы определения.
- •Кк (креатинкиназа) существует в виде 3 изоферментов, которые к тому отличаются электрофоретической подвижностью:
- •Подобным свойством обладает и лдг (лактатдегидрогеназа), имеющая 5 изоферментов:
- •20. Применение ферментов как аналитических реагентов при лабораторной диагностике (определение глюкозы, мочевой кислоты, холестерина,
- •Биохимия 4. Биологические мембраны.
- •1. Структурная организация мембран, строение и свойства основных компонентов мембран. Структурная организация мембран:
- •Липиды (фосфолипиды, сфинголипиды, гликолипиды) составляют до 45% массы мембран.
- •2. Липидный состав мембран – фосфолипиды, гликолипиды, холестерин. Белки мембран – интегральные, поверхностные, «заякоренные».
- •«Заякоренные» белки:
- •Общие свойства мембран: жидкостность гидрофобного слоя, поперечная асимметрия, избирательная проницаемость. Участие мембран в организации и регуляции метаболизма.
- •Механизмы переноса веществ через мембраны: простая диффузия, первично-
- •Такая проницаемость называется избирательной.
- •Вторично – активный транспорт:
- •Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем – аденилатциклазная система.
- •6. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем – инозитолфосфатная система.
- •7. Каталитические мембранные рецепторы на примере рецептора инсулина.
- •Введение в обмен веществ. Биохимия питания
- •2. Переваривание белков. Характеристика протеолитических ферментов, механизм активации, специфичность и условия действия.
- •4. Нарушения переваривания белков и транспорта аминокислот.
- •5. Диагностическое значение биохимического анализа желудочного и дуоденального сока.
- •8. Нарушения переваривания и всасывания жиров. Стеаторея.
- •9. Механизм переваривания углеводов в пищеварительном тракте. Характеристика амилолитических ферментов.
- •11. Нарушения переваривания и всасывания углеводов. Непереносимость дисахаридов, первичная и вторичная недостаточность лактазы, синдром мальабсорбции.
- •Биохимия 6. Энергетический обмен.
- •1. Фазы извлечения энергии из питательных веществ. Пировиноградная кислота и ацетил-КоА: пути образования и пути использования в организме. Значение этих процессов.
- •2. Окислительное декарбоксилирование пирувата: суммарное уравнение и последовательность реакций, строение пируватдегидрогеназного комплекса.
- •Цикл лимонной кислоты (цикл Кребса): последовательность реакций, характеристика ферментов.
- •4. Цикл лимонной кислоты (цикл Кребса): механизмы регуляции, функции. Анаплеротические реакции (реакции, пополняющие цитратный цикл).
- •Связь между общим путем катаболизма (окисление пирувата и ацетил-КоА) и митохондриальной цепью переноса электронов. Механизмы регуляции общего пути катаболизма.
- •Структурная организация и функции дыхательной цепи.
- •Виды фосфорилирования. Понятие о субстратном и окислительном фосфорилировании.
- •Механизм сопряжения тканевого дыхания и окислительного фосфорилирования. Трансмембранный электрохимический градиент как промежуточная форма энергии при окислительном фосфорилировании.
- •На уровне количества субстратов окисления;
- •Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого обмена.
- •Терморегуляторная функция тканевого обмена:
- •Токсичность кислорода: образование активных форм кислорода (супероксид – анион, перекись водорода, гидроксильный радикал), их значение. Механизмы их
- •Значение активных форм кислорода:
- •Прооксиданты и антиоксиданты:
- •Ферменты антиоксидантного действия (здесь же механизмы обезвреживания):
- •Неферментные антиоксиданты:
- •Биохимия 7. Обмен углеводов.
- •1. Основные углеводы животных, биологическая роль. Глюкоза как важнейший
- •Моносахариды:
- •Гомополисахариды.
- •2. Катаболизм глюкозы. Аэробный гликолиз – основной путь катаболизма глюкозы человека. Последовательность реакций.
- •Анаэробный гликолиз: энергетический баланс, распределение в организме и физиологическое значение анаэробного гликолиза.
- •5. Окисление внемитохондриального надн2: механизм, биологическая роль.
- •Глицеролфосфатный челночный механизм.
- •Малат - аспартатный челночный механизм.
- •6. Метаболизм экзогенного этанола, механизм его токсического действия.
- •Токсическое действие:
- •Побочные эффекты обезвреживания этанола:
- •7. Свойства и распространение гликогена как резервного полисахарида. Мобилизация гликогена: механизм, регуляция, биологическая роль. Различия мобилизации
- •Распространение:
- •Мобилизация гликогена (гликогенолиз):
- •Регуляция:
- •Различия мобилизации гликогена в печени и мышцах, тут же биологическое значение:
- •8. Свойства и распределение гликогена как резервного полисахарида. Биосинтез гликогена: механизм, регуляция.
- •Распространение:
- •Биосинтез гликогена (гликогенез).
- •Регуляция биосинтеза гликогена:
- •9. Биосинтез глюкозы (глюконеогенез): источники, механизм, биологическое значение.
- •10. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени: цикл Кори, глюкозо- аланиновый цикл. Аллостерические механизмы регуляции аэробного и анаэробного путей распада глюкозы и глюконеогенеза.
- •Цикл Кори (глюкозо – лактатный цикл).
- •Глюкозо – аланиновый цикл.
- •Аллостерические механизмы регуляции путей распада глюкозы и глюконеогенеза:
- •11. Пентозофосфатный путь превращения глюкозы: окислительная стадия (химизм), неокислительная стадия синтеза пентоз. Суммарные реакции, распространение и биологическое значение.
- •Окислительная стадия (фаза) - превращение глюкозо – 6 – фосфата до рибулозо – 5 – фосфата:
- •Неокислительная стадия (фаза) – рибулозо – 5 – фосфат превращается во фруктозо – 6
- •Фосфат:
- •12. Метаболизм фруктозы и его нарушения: эссенциальная фруктоземия, наследственная непереносимость фруктозы. Метаболизм фруктозы в норме Нарушения метаболизма фруктозы:
- •Наиболее характерные клинические проявления: гипогликемия, метаболический ацидоз, гипосфосфатемия, хроническая недостаточность функций печени, почек, гиперурикемия, рвота, боли в животе, диарея.
- •13. Метаболизм галактозы и его врожденные нарушения. Галактоземия. Метаболизм галактозы в норме.
- •При этом возникает галактоземия.
- •14. Нарушения обмена углеводов. Генетические детерминированные болезни
- •Печеночные гликогенозы.
- •Симптомы: гипогликемия, кетонемия, метаболический ацидоз, кетонурия, судороги, гипертриацилглицеролемия, гиперурикемия.
- •Д) Дефект киназы фосфорилазы (тип 9). Е) Дефектпротеинкиназы а (тип 10).
- •Мышечные гликогенозы.
- •Смешанные гликогенозы.
- •Обмен и функции липидов
- •1. Важнейшие липиды тканей человека. Резервные липиды (жиры) и липиды мембран (сложные липиды). Незаменимые факторы питания липидной природы.
- •2. Мобилизация жиров в жировой ткани (распад триацилглицеринов, глицерина): химизм, регуляция, биологическая роль.
- •4. Особенности окисления ненасыщенных и жирных кислот с нечетным числом углеродных атомов. Расчет энергетической ценности жирных кислот.
- •5. Синтез кетоновых тел, последовательность реакций, регуляция. Биологическая роль кетоновых тел. Кетонемия и кетонурия. Клиническое значение исследования крови и мочи на содержание кетоновых тел.
- •6. Депонирование жиров в жировой ткани: химизм, регуляция, биологическая роль. Транспортная форма эндогенных жиров. Ожирение, причины и последствия ожирения.
- •7. Биосинтез жирных кислот. Особенности биосинтеза ненасыщенных жирных кислот. Источники надф·н2. Гормональная и аллостерическая регуляция синтеза жирных кислот.
- •1. Изменение количества ферментов
- •9. Баланс холестерина в организме. Различные механизмы регуляции гмг-КоА-редуктазы. Роль липопротеинов в транспорте холестерина кровью.
- •10. Гиперхолестеринемия: причины, последствия. Семейная гиперхолестеринемия.
- •11. Синтез и функции желчных кислот. Энтерогепатическая циркуляция желчных кислот. Молекулярные механизмы желчнокаменной болезни.
- •12. Основные фосфолипиды (глицеролфосфолипиды) тканей человека: представители, пути биосинтеза, биологическая роль. Липотропные факторы.
- •13. Хиломикроны и лпонп: структура, локализация и механизм образования, особенности метаболизма.
- •14. Гипертриацилглицеролемия и гиперхиломикронемия: причины, изменения состава сыворотки крови. Генетические дефекты лп-липазы и апо-сii.
- •15. Лпнп и лпвп: структура, локализация и механизм образования, особенности метаболизма.
- •16. Молекулярные механизмы атеросклероза. Биохимические принципы лечения, роль омега-3 кислот в профилактике атеросклероза.
- •Обмен и функции азотсодержащих соединений
- •Общая схема источников и путей расходования аминокислот в тканях. Фонд свободных аминокислот. Динамическое состояние белков в организме.
- •Понятие об азотистом балансе. Белковый минимум. Азотистое равновесие. Положительный и отрицательный азотистый баланс.
- •Распад белков в тканях. Виды протеолиза. Протеосомы. Роль убиквитина.
- •Виды протеолиза:
- •4. Тканевой протеолиз. Классификация протеолитических ферментов. Функции тканевых протеиназ. Характеристика катепсинов.
- •Классификация протеолитических ферментов:
- •По структуре активного центра все протеиназы делят на 4 класса:
- •Посттрансляционный процессинг белков: частичный протеолиз, присоединение небелковых компонентов, модификация аминокислот, формирование
- •Пути распада аминокислот до конечных продуктов. Дезаминирование аминокислот, его виды. Прямое окислительное дезаминирование аминокислот, биологическая роль этих процессов.
- •А) Дезаминирование
- •Существуют 4 вида дезаминирования ак:
- •Особенности реакции трансаминирования:
- •Особенности непрямого окислительного дезаминирования:
- •Биологическое значение процесса:
- •8. Обмен безазотистого остатка аминокислот. Гликогенные, кетогенные и смешанные аминокислоты. Синтез глюкозы из аминокислот.
- •Дезаминирование биогенных аминов (серотонин, гистамин и др.).
- •Распад пиримидиновых оснований (урацила, тимина, цитозина).
- •Амидный азот глутамина используется для синтеза:
- •11. Биосинтез мочевины: локализация, химизм, биологическая роль. Диагностическое значение определения уровня мочевины в крови и моче. Нарушения синтеза и
- •12. Причины гипераммониемии. Механизм токсического действия аммиака. Биохимические подходы к лечению гипераммониемий.
- •Лечение гипераммониемии:
- •Малобелковой диеты
- •Введения кетоаналогов аминокислот в рацион
- •Стимуляция выведения аммиака в обход нарушенных реакций:
- •13. Синтез креатина и фосфокреатина: внутриклеточный перенос энергии с участием креатин – фосфата; биологическая роль процесса. Диагностическое значение
- •14. Заменимые и незаменимые аминокислоты. Биосинтез ряда заменимых аминокислот из метаболитов углеводного обмена и цикла Кребса, незаменимых аминокислот.
- •1. Биосинтез аминокислот из промежуточных продуктов распада углеводов:
- •16. Декарбоксилирование аминокислот и образование биогенных аминов (серотонина, гамк), их роль. Значение моно – и диаминооксидаз.
- •1. Синтез серотонина:
- •2. Синтез гамк (гамма – аминомасляной кислоты):
- •Значение моно – и диаминооксидаз: смотреть в 15 вопросе.
- •Синтез ацетилхолина, его роль и обезвреживание.
- •Синтез катехоламинов, их биологическая роль, пути инактивации. Предшественники катехоламинов и ингибиторы моноаминооксидаз в лечении депрессивных (аха-ха-ха) состояний.
- •Наследственные нарушения обмена фенилаланина и тирозина: фенилкетонурия, алкаптонурия, альбинизм.
- •1. Фенилкетонурия.
- •Алкаптонурия.
- •20. Метионин и s – аденозилметионин в реакциях трансметилирования (синтез креатина, адреналина, фосфатидилхолинов, метилирование днк и чужеродных соединений). Роль тгфк.
- •Синтез фосфатидилхолина из фосфатидилэтаноламина:
- •Синтез адреналина:
- •Тканевой обмен нуклеопротеинов. Распад нуклеопротеинов, нуклеиновых кислот, нуклеотидов, нуклеозидов. Окисление пуриновых в мочевую кислоту.
- •Радиоактивными изотопами азотистых оснований.
- •Распад нуклеозидов: гидролиз с образованием упентозы и нуклеотида
- •Биосинтез пуриновых нуклеотидов. Источники образования пуриновых оснований. Регуляция биосинтеза.
- •2 3. Биосинтез и распад пиримидиновых оснований. Биосинтез дезоксирибонуклеотидов и использование ингибиторов этого процесса в медицине.
- •24. Нарушения обмена нуклеотидов. Подагра: молекулярные механизмы развития и биохимические основы лечения (аллопуринол). Ксантурия. Оратацидурия.
- •2 5. Обмен гемпротеинов. Синтез гема и его регуляция. Нарушение синтеза гема (порфирии: общая характеристика).
- •26. Распад гемоглобина. Образование ♂Billy♂рубина и других желчных пигментов. Обезвреживание ♂Billy♂рубина. «Прямой» и «непрямой» ♂Billy♂рубин.
- •«Прямой» и «непрямой» билирубин (тут же и про обезвреживание):
- •27. Нарушения обмена ♂Billy♂рубина. Желтухи: гемолитическая, обтурационная, печеночно – клеточная.
- •Сравнительная характеристика желтух
- •28. Нарушения обмена ♂Billy♂рубина. Желтуха новорожденных, наследственные желтухи. Диагностическое значение определения билирубина и других желчных пигментов в крови и моче. А) Желтуха новорожденных.
- •Б) Наследственные нарушения метаболизма билирубина.
- •Биохимия 10. Биохимия витаминов
- •Витамины. История открытия и изучения. Классификация витаминов. Алиментарные и вторичные гиповитаминозы. Гипервитаминозы.
- •Классификация витаминов:
- •Алиментарные и вторичные гиповитаминозы:
- •Внешние причины гиповитаминозов (надеюсь, это про алиментарные гиповитаминозы):
- •Внутренние причины гиповитаминозов (надеюсь, тут имеются в виду вторичные гиповитаминозы):
- •2. Каротины и витамин а. Их химическая природа и биологическое значение. Участие витамина а в акте зрения. Признаки гипо- и гипервитаминоза а. Потребность и
- •Участие в фотохимическом акте зрения.
- •Антиоксидантная функция.
- •Витамин а принимает участие в гликозилировании полипептидных цепей:
- •Витамины д (д2 и д3), строение, биосинтез и механизм действия кальцитриола. Причины и проявления рахита и гипервитаминоза д. Медицинское применение витамина д.
- •Образование эргокальциферола:
- •Причины и проявления рахита и гипервитаминоза витамина d:
- •Приобретенный гиповитаминоз
- •Наследственный гиповитаминоз
- •Витамин е (токоферол), потребность, химическая природа, участие в обмене веществ. Признаки е-авитаминоза. Антиоксидантная функция токоферола, медицинское применение.
- •5. Витамин к (к1, к2), их химическая природа. Роль витамина к в свертывании крови. Медицинское применение. Викасол, химическое строение и использование.
- •Биохимические функции (тут роль в свертывании крови, короче):
- •6. Витамин в1 (тиамин), потребность, химическое строение. Механизм образования кофермента и участие в обмене веществ. Признаки в1-гиповитаминоза. Практическое значение витамина.
- •Механизм образования кофермента:
- •Участие в обмене веществ:
- •Коферментные формы и участие в обмене:
- •Дегидрогеназ:
- •Пантотеновая кислота: химическая природа, коферментные формы, участие в обмене веществ, практическое применение.
- •Коферментные формы и участие в обмене:
- •Ниацин (никотиновая кислота), химическое строение. Коферментные формы и участие в обмене. Признаки гиповитаминоза и возможность образования
- •Витамин в6 (пиридоксин). Химическое строение. Коферментные формы и их участие в обмене веществ. Признаки гиповитаминоза. Потребность и медицинское применение витамина.
- •11. Фолацин и витамин в12, потребность. Химическая природа. Образование коферментов, их биохимические функции и взаимосвязь в регуляции обмена.
- •Химическая природа:
- •Образование коферментов, их биохимические функции и взаимосвязь в регуляции обмена:
- •Связь кобаламина с фолацином:
- •Признаки недостатка витаминов:
- •Потребность:
- •Медицинское применение:
- •Антивитамины в12 свинец замещает кобаламидные коферменты. Используется как противоопухолевыйе и антибактериальные препараты для снижения синтеза бека и нуклеотидов в микроорганизме
- •Связь между витамином с и биофлавоноидами:
- •Практическое применение:
- •Аскорбиновая кислота
- •Биофлавоноиды (Витамин р)
- •13. Витаминоподобные вещества: биотин, метилметионин, карнитин. Химическое строение, физиологическое действие. Проявления авитаминоза.
- •Б) Метилметионин (витамин u (от лат. Ulcus- язва), антиязвенный фактор) Химическое строение:
- •В) Карнитин (витамин Вт) Химическое строение:
- •Биохимия крови
- •1.Основные функции крови.
- •Форменные элементы крови: представители и биохимические особенности клеток крови.
- •Белки крови. Характеристика основных представителей белковых фракций сыворотки крови. Изменение белкового состава при некоторых патологических состояниях.
- •Физиологические белки крови. 3 вопрос
- •Острофазовые белки крови, кардиомаркеры и онкомаркеры: характеристика их основных представителей и использование в диагностике.3вопрос
- •Небелковые азотсодержащие вещества крови. Остаточный азот крови. Азотемии.
- •Биохимия мышц
- •Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин. Молекулярная структура миофибрилл.
- •Характеристика небелковых азотсодержащих (экстрактивных) веществ мышечной ткани.
- •3. Саркоплазматические белки: миоглобин, его строение и функции. Особенности энергетического обмена в мышцах, креатинфосфат.
- •Специальные реакции субстратного фосфорилирования
- •2) Миокиназная реакция.
- •Гликолиз, гликогенолиз.
- •Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия. Биохимические изменения при патологии мышц:
- •Биохимия нервной системы
- •1. Химический состав нервной ткани.
- •2. Энергетический обмен в нервной ткани: значение аэробного распада глюкозы.
- •3. Нейромедиаторы: функции катехоламинов, гамк, ацетилхолина, серотонина, глутамата, глицина, гистамина.
- •4. Нарушение обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
- •Биохимия почек
- •Механизм образования мочи в различных отделах нефрона.
- •Регуляторно-гомеостатическая, обезвреживающая, внутрисекреторная функции почек.
- •Характеристика компонентов мочи в норме и при патологии (белки, небелковые азотистые вещества, безазотистые компоненты).
- •Основы биохимической диагностики заболеваний почек.
- •Биохимия печени
- •Функция печени: биосинтетическая, желчеобразовательная и депонирующая.
- •Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой и серной кислотами.
- •Особенности обмена аминокислот, белков и других азотсодержащих веществ в печени.
- •Особенности обмена углеводов и липидов в печени. Роль печени в обмене углеводов:
- •Энзимодиагностика заболеваний печени и поджелудочной железы. Биохимия соединительной ткани
- •Коллаген: особенности аминокислотного состава, первичной и пространственной структуры.
- •Й этап
- •Й этап
- •Особенности строения и функции эластина. Особенности строения эластина:
- •Биохимия межклеточного матрикса. Гликозамингликаны и протеогликаны: строение и функции. Роль глюкуроновой кислоты в организации межклеточного матрикса.
- •4. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль в межклеточных взаимодействиях. Структурная организация межклеточного матрикса.
- •5. Патология соединительной ткани: причины, проявления, биохимическая диагностика.
- •Днк технологии в медицине
- •1. Днк технологии в медицине: использование рекомбинантных днк, методов пцр и пдрф. Гення терапия
- •2. Механизмы генетческой изменчивости. Полиморфизм белков.
- •Полиморфизм белков.
- •3. Ингибиторы матричных биосинтезов и их использование в качестве лекарств. Ингибиторы матричных биосинтезов
- •Использование днк-технологий в медицине
Особенности реакции трансаминирования:
1. Это циклический процесс, все стадии которого катализируются одним ферментом – трансаминазой данной пары кислот:
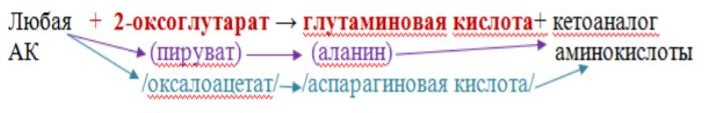
В цикл вступают, таким образом, одна АК и одна из кетокислот, чаще 2 – оксоглутарат.
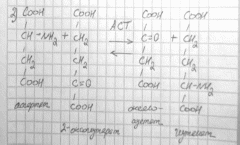
 Если
в качестве акцептора выступают пируват
или оксалоацетат, то NH2 – группы с
образующихся
соединений
переходят
на
2
–
оксоглутарат.
Если
в качестве акцептора выступают пируват
или оксалоацетат, то NH2 – группы с
образующихся
соединений
переходят
на
2
–
оксоглутарат.
Стадия: Окислительное дезаминирование – в нее вступает образовавшийся глутамат. Эта стадия проходит в митохондриях.

Особенности непрямого окислительного дезаминирования:
Все стадии данного процесса обратимы, поэтому весь цикл может протекать и в
прямом, и в обратном направлении (трансреаминирование (не реанимирование) – синтез АК из аммиака и альфа-кетокислот).
Это главный путь удаления азота у аминокислот.
Скорость этого процесса можно регулировать.
Биологическое значение процесса:
Трансаминирование обеспечивает синтез новых аминокислот из числа заменимых, из них также могут синтезироваться кетокислоты.
Непрямое окислительное дезаминирование является наиболее важным, т.к. именно таким путем дезаминируются большинство аминокислот живого организма, что
обусловлено, тем, что фермент глутаматдегидрогеназа активнее, чем оксидазы АК.
Определение трансаминаз и глутаматдегидрогеназы: В норме соотношение активности АСТ (АсАТ) и АЛТ (АлАТ) составляет 1,33±0,42 и называется коэффициентом де Ритиса.
При инфаркте миокарда увеличивается активность АсАТ, повышается коэффициент де Ритиса.
При поражении печени при циррозе, сывороточном гепатите и др. более выражено повышается активность АлАТ и снижается коэффициент АсАТ/АлАТ.
Увеличение активности ГлДГ наблюдают при острых поражениях печени (остром гепатите, раке печени, интоксикации и др.).
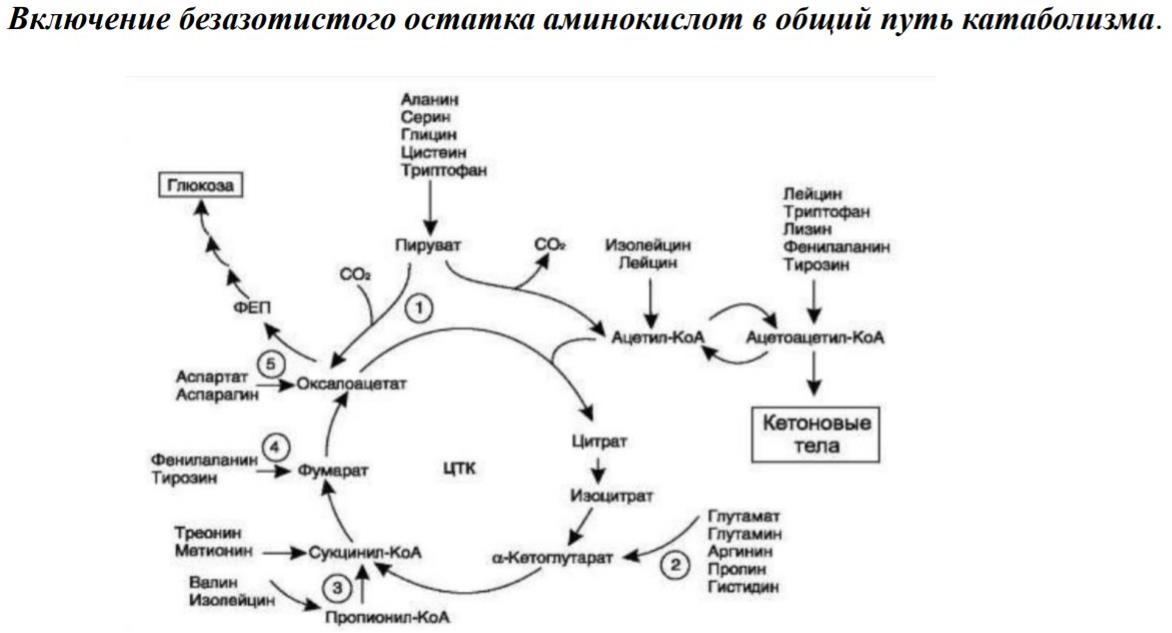
8. Обмен безазотистого остатка аминокислот. Гликогенные, кетогенные и смешанные аминокислоты. Синтез глюкозы из аминокислот.
Большая часть безазотистых остатков аминокислот превращается в пируват либо
 непосредственно,
либо
в
результате
более
сложного
пути,
превращаясь
вначале
в
один
из
метаболитов
ЦТК.
непосредственно,
либо
в
результате
более
сложного
пути,
превращаясь
вначале
в
один
из
метаболитов
ЦТК.
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма:
Пируват
Ацетил – КоА
альфа – Кетоглутарат
Сукцинил – КоА
Фумарат
Оксалоацетат
Аминокислоты подразделяются на:
 Гликогенные
–
это аминокислоты, которые превращаются
в пируват и промежуточные
продукты
ЦТК,
образуют
в
конечном
итоге
оксалоацетат
и
могут
использоваться
в
Гликогенные
–
это аминокислоты, которые превращаются
в пируват и промежуточные
продукты
ЦТК,
образуют
в
конечном
итоге
оксалоацетат
и
могут
использоваться
в
процессе глюконеогенеза. К гликогенным аминокислотам осносятся большинство
аминокислот, например, аланин, аспарагин, аспартат, глицин, серин, треонин, валин и т.д.
Кетогенные – это аминокислоты, которые в процессе катаболизма превращаются в ацетоацетат или ацетил – КоА и могут использоваться в синтезе кетоновых тел. К
кетогенным аминокислотам относят лейцин и лизин.
Глико – кетогенные (смешанные) аминокислоты – это аминокислоты, которые используются для синтеза глюкозы и кетоновых тел. К смешанным аминокислотам относятся тирозин, изолейцин, фенилаланин, триптофан.
Синтез глюкозы из аминокислоты: Большинство аминокислот являются гликогенными, то есть их углеродные скелеты в той или иной степени способны включаться в состав глюкозы.
9. Пути образования аммиака в организме.
Аммиак образуется в ходе следующих процессов:
Дезаминирование аминокислот.
