
- •2. Буферные системы
- •Респираторная компенсация
- •Почечная компенсация
- •1 Основные показатели кщс и газового состава крови
- •Первичные метаболические расстройства
- •Первичные респираторные расстройства
- •Респираторный ацидоз
- •Острый респираторный ацидоз
- •Хронический респираторный ацидоз
- •Причины респираторного ацидоза
- •Метаболический ацидоз
- •Респираторный алкалоз
- •Метаболический алкалоз
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ.
Содержание:
Общие понятия.
Буферные системы.
Компенсаторные механизмы.
1. Согласно определению Бренстеда-Лоури, кислоты – это вещества, диссоциирующие с образованием свободных ионов H+, т. е. являющиеся донором протона, а о снования – вещества, присоединяющие ионы водорода (акцепторы протона).
Сильными кислотами считаются кислоты, подвергающие полной диссоциации, необратимо и легко отдающие [H+], например, HCl. Слабые – частично диссоциирующие, обратимо отдающие [H+], например, H2CO3. Сила оснований, соответственно, определяется способностью активно связывать ионы водорода. Чем сильнее основание, тем больше оно снижает концентрацию [H+] в растворе, например, OH-. Классический пример слабого основания – HCO3-, присоединяющее ион водорода значительно слабее, чем OH-. В организме человека большинство химических соединений представлено слабыми кислотами и слабыми основаниями.
Главными регуляторами кислотно-щелочного равновесия являются углекислый газ и ионы водорода. Водород играет основную роль в образовании кислот и оснований, его концентрация должна находиться в строгих пределах, контролируемых организмом.
При отклонении количества ионов водорода от нормального возникают сбои в работе ферментных систем и функциональных белков, порой несовместимые с жизнью.
Некоторое количество [H+] образуется в результате метаболизма биологических веществ – углеводов, жиров и белков. Классический пример биосинтеза протонов – аэробный гликолиз:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Углекислый газ (CO2) фактически является потенциальной кислотой, и, хотя к нему не присоединён ион водорода, он является основным источником [H+]. СO2 вступает в реакцию с водой, образуя угольную кислоту - H2CO3, которая тотчас диссоциирует с образованием протонов:
CO2 + H2O → H2CO3
H2CO3→ H+ + HCO3-
Данная реакция будет двунаправленной, степень отклонения её зависит от концентрации конечных продуктов:
CO2 + H2O ↔ H2CO3 ↔H+ + HCO3-
Таким образом, при увеличении уровня углекислого газа реакция сдвигается вправо, что приводит к повышению количества водородных ионов.
Второстепенную роль в образовании [Н+] играет превращение двухвалентного железа в трехвалентное (соотношение окисленного и восстановленного гемоглобина):
2Fe++ + 1/2O2 + 2H+ ↔ 2Fe+++ + H2O
Реакция среды любого раствора зависит от количества ионов водорода в растворе. Количество [H+] в артериальной крови составляет 40 нэкв/л. Нормальные колебания концентрации ионов водорода не выходят за пределы 3 – 5 нэкв/л. Количество H+ выше 160 нэкв/л и ниже 10 нэкв/л является несовместимым с жизнью. Нормальные значения pH плазмы варьируют от 7,35 до 7,45.
|
pH |
[H+] нмоль/л |
|
6,80 |
158 |
|
6,90 |
126 |
|
7,00 |
100 |
|
7,10 |
79 |
|
7,20 |
63 |
|
7,30 |
50 |
|
7,36 |
44 |
|
7,37 |
43 |
|
7,38 |
42 |
|
7,39 |
41 |
|
7,40 |
40 |
|
7,41 |
39 |
|
7,42 |
38 |
|
7,43 |
37 |
|
7,44 |
36 |
|
7,50 |
32 |
|
7,60 |
25 |
|
7,70 |
20 |
|
7,80 |
19 |
|
8,00 |
10 |
2. Буферные системы
– биохимические комплексы, обеспечивающие постоянство pH путем отдачи либо присоединения ионов водорода. Буферные системы не удаляют H+ из организма, а «связывают» его своим щелочным компонентом до окончательного восстановления КЩС.
Буфер + H+ ↔ H Буфер
Водород взаимодействует с буфером, образуя слабую кислоту. Так как реакция является двунаправленной, то увеличение концентрации водорода вызывает смещение реакции вправо, уменьшение – влево.
В физиологических условиях организмом ежедневно продуцируется около 80 мэкв ионов водорода в составе нелетучих (фиксированных) кислот. К таким кислотам относятся серная, фосфорная, образующиеся в результате окисления тканевых белков и фосфолипидов, а также небольшое количество ацетоацетата и лактата, появляющиеся в результате неполного окисления углеводов и жиров.
Основными буферными системами являются:
-бикарбонатный буфер [H2CO3/HCO3-] Является основным буфером крови во внешнем пространстве (до 53% от всех буферных систем)
-гемоглобиновый буфер [HbH/Hb-] - 35% от общего количества, является внутриклеточным буфером
-белковый буфер [HPr/Pr-] - 7% от общего количества
-фосфатный буфер [H2PO4-/HPO4-] – 5% от общего количества. Действует преимущественно в костях и моче.
-аммиак/ион аммония [NH3/NH4+] –действует преимущественно в моче.
Буферные системы также делятся на внутриклеточные и внеклеточные. Около 60-70% от общего количества буферов организма приходятся на внутриклеточные, большинство из которых представлены внутриклеточными белками.
Любая буферная система организма состоит из двух частей
-слабой кислоты
-соли слабой кислоты, образованные сильным основанием.
Параметры буферных систем:
Диапазон буферного действия – это диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK. Так, для бикарбонатного буфера pK будет равно 6,1 ± 1.
Буферная ёмкость – это количество кислоты или основания, которое необходимо добавить в буфер, чтобы изменить pH на 1 ммоль/л на ед. pH. Зависит от молярной концентрации буферной системы и от величины pK.
Буферные системы не действуют каждая в отдельности, их работа происходит по принципу сохранения одинаковой концентрации ионов водорода во всех системах. При изменении в одной из буферных систем происходит изменение баланса остальных благодаря сдвигу ионов водорода между ними.
БИКАРБОНАТНЫЙ БУФЕР:
Бикарбонатный буфер представляет собой пару слабой кислоты H2CO3 и слабого основания - бикарбоната, а точнее его соли - NaHCO3.
Константа диссоциации бикарбонатного буфера (pK) равна 6,1. Это далеко от среднего значения pH, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3-) системами. Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3/NaHCO3 (CO2/HCO3-).
Допустим, в буферную систему попала сильная кислота, например, HCL, которая в водном растворе диссоциирует на H+ и Cl-. Имеющийся в бикарбонатном буфере HCO3- («летучий буфер») присоединяет ионы водорода с образованием H2CO3, который, в свою очередь, диссоциирует на воду и углекислый газ. Натрий из бикарбонатного буфера присоединяет оставшийся ион хлора. В целом данная реакция выглядит так:
1. NaHCO3 → Na+ + HCO3-
2. HCL → H+ + Cl-
3. H+ + HCO3- → H2CO3 → H2O + CO2
4. Na+ + Cl- → NaCl
В результате формируется больше угольной кислоты, что в свою очередь увеличивает продукцию углекислого газа и воды. Физиологический смысл этой реакции заключается в том, что поступившая сильная кислота HCl реагирует с HCO3-, превращаясь в слабую кислоту H2CO3. Угольная кислота диссоциирует на H2O и CO2. Избыток CO2 эффективно выводится легкими, причем снижение уровня HCO3- будет отражать количество добавленной кислоты.
Пример 1.
Если количество соляной кислоты будет равно 5 ммоль/л, то количество оставшегося бикарбоната будет равно разности [HCO3-]норма и N, где N – количество добавленной кислоты, то есть: [HCO3-]остаток = 24 ммоль/л – 5 ммоль/л = 19 ммоль/л.
или
5 ммоль/л H+ + 24 ммоль/л HCO3- → H2CO3 → 5 ммоль/л CO2 + H2O + 19 ммоль/л HCO3-
Образовавшийся в ходе реакции CO2 при не нарушенной функции легких выделяется в атмосферу, так что величина PaCO2 не изменится. Помимо того, развивающаяся при ацидозе гипервентиляция будет приводить к гипокарбии. Следовательно, бикарбонатный буфер эффективен для компенсации метаболического, но не респираторного, ацидоза.
Если во внеклеточную жидкость попадает сильное основание, например, NaOH, реакция будет следующей:
NaOH + H2CO3 → NaHCO3 + H2O
Физиологическая роль этой реакции заключается в образовании слабого основания NaHCO3 из более сильного NaOH.
Уменьшение количества H2CO3 в этом случае приводит к сдвигу реакции диссоциации угольной кислоты вправо:
CO2 + H2O → H2CO3 →H+ + ↑HCO3-
+ +
NaOH Na+
Сдвиг диссоциации H2CO3 вправо приводит к снижению количества CO2 в крови. Углекислый газ здесь расходуется на восстановление прежнего уровня угольной кислоты. Уменьшение CO2 приводит к снижению активности дыхательного центра, что вызывает гиповентиляцию. Гиповентиляция замедляет элиминацию углекислого газа, восстанавливая его прежние значения. Избыток образовавшегося бикарбоната эффективно выводится почками.
ГЕМОГЛОБИНОВЫЙ БУФЕР:
Гемоглобиновый буфер является вторым по значимости и мощности буфером после бикарбонатного.В отличие от бикарбонатного, в состоянии нейтрализовать как нелетучие, так и летучие кислоты. Окисленный гемоглобин ведёт себя как кислота, увеличивая концентрацию ионов водорода, а восстановленный (дезоксигенированный) – как основание, нейтрализуя H+. Таким образом, кислотно-основные свойства гемоглобина зависят от степени его оксигенации.
H+ + HbO2 ↔ HbH+ + O2
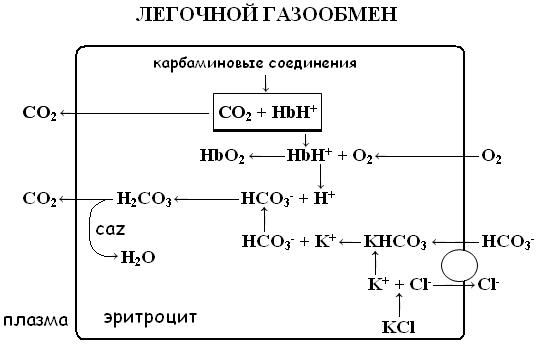
Увеличение концентрации ионов водорода вызывает смещение реакции вправо, снижая связывание кислорода с гемоглобином и облегчая его отдачу в тканях – эффект Бора (Bohr effect). При развитии ацидоза эффект Бора компенсирует дефицит кислорода в тканях путём увеличением его отдачи. Таким образом, буферная и транспортная функции гемоглобина находятся в тесной взаимосвязи (см. рис. 1).
В венозных капиллярах физически растворённый CO2 поступает в эритроциты из плазмы, где под действием фермента карбоангидразы (CAZ) вступает в связь с водой и образует угольную кислоту – H2CO3. Угольная кислота диссоциирует на бикарбонат и ион водорода. В эритроцитах бикарбонат соединяется с калием, образуя бикарбонатную соль:
HCO3- + K+ → KHCO3
При снижении концентрации бикарбоната в плазме процесс носит обратный характер, высвобождая HCO3-. Бикарбонат диффундирует обратно в плазму, а для поддержания электронейтральности и компенсации утечки анионов в эритроциты из плазмы поступают ионы Cl-.

В легочных капиллярах все происходит наоборот - ионы бикарбоната поступают в эритроциты, обмениваясь на Cl-.. Процесс обеспечивается работой протеинового обменника, обозначенного на рисунке 1 кругом. Обменное перемещение ионов хлора в эритроците называется хлоридным сдвигом Гамбургера.
Вошедшие в эритроциты ионы хлора соединяются с калием, образуя – KCl, сохраняя электронейтральное состояние клетки.
В легочных капиллярах поступивший в эритроциты бикарбонат соединяется с H+, образуя H2CO3. Образовавшийся в результате CO2 диффундирует в альвеолы, элиминируясь из организма с выдыхаемым воздухом.
Чем ниже сатурация гемоглобина венозной крови кислородом, тем больше в ней восстановленного гемоглобина, и, следовательно, концентрация бикарбоната и BE будет увеличена по сравнению со значениями артериальной крови.
ФОСФАТНЫЙ БУФЕР:
Фосфатный буфер играет главную роль в буферировании мочи и внутриклеточной жидкости.
Основные элементы фосфатного буфера – H2PO4 и HPO4-.
Механизм действия фосфатного буфера аналогичен работе бикарбонатной буферной системы: поступивший ион водорода от сильной кислоты соединяется с HPO4- образуя H2PO4. При добавлении в систему щелочи происходит обратная реакция с образованием HPO4- и H2O из H2PO4 и OH-.
Роль фосфатного буфера заключается в конверсии сильных щелочей и кислот в более слабые соединения.
pK фосфатного буфера равна 6,8, что ближе к среднему значению pH по сравнению с pK бикарбонатного буфера. Несмотря на то, что сила фосфатного буфера выше, чем у бикарбонатного, его роль в буферировании во внеклеточной жидкости невелика, так как общая концентрация фосфатов в крови составляет около 8% от концентрации бикарбоната.
В почках фосфатный буфер особенно важен, так как, во-первых, количество фосфатов в моче достаточно велико, а во вторых, pH канальцевой жидкости ниже, чем pH плазмы, приближаясь к pK фосфатной буферной системы.
Во внутриклеточной жидкости концентрация фосфатов выше, чем во внеклеточной, а pH внутри клетки несколько ниже, чем снаружи, что обеспечивает эффективность фосфатного буфера как внутриклеточного.
Компенсаторные механизмы:
Компенсаторные механизмы при нарушениях КЩС включаются последовательно в зависимости от мощности и эффективности буферной системы. Выделяют три основные физиологические системы, регулирующие баланс ионов водорода:
непосредственно буферные системы жидкостного компартмента организма;
дыхательная система (респираторный центр);
мочевыделительная система (почки).
Практически немедленно развивается действие бикарбонатного буфера в плазме, затем – в интерстициальной жидкости. Для полного развития действия внутриклеточных буферов необходимо несколько часов.
Время реагирования механизмов компенсации нарушений КЩС различно:
Внеклеточное буферирование: 10-15 минут. Осуществляется с помощью бикарбонатного буфера.
Внутриклеточное буферирование: 2-4 часа. Осуществляется преимущественно за счет гемоглобинового буфера.
Респираторная компенсация: 3-5 часов (максимальная – 12-24 часа).
Почечная компенсация: 6-8 часов начало (максимум – 5-7 дней).
