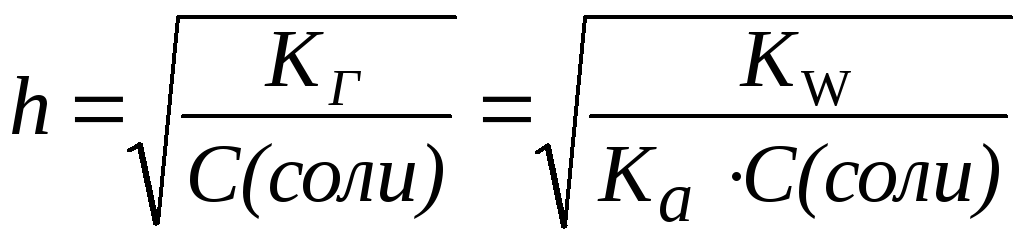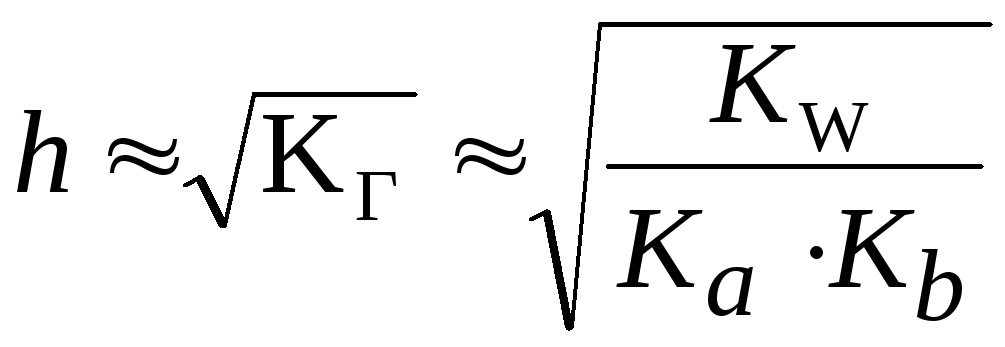- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Количественные характеристики гидролиза
Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (КГ) и степени гидролиза (h).
Константа гидролиза (KГ) это отношение ионного произведения воды (Kw) к константе диссоциации слабого основания или слабой кислоты, образующих данную соль.
Частное от деления одной постоянной величины на другую есть также величина постоянная. Поэтому KГ величина постоянная, которая характеризует способность соли подвергаться гидролизу. Значение KГ зависит от природы соли, температуры и не зависит от концентрации раствора.
1. Для солей типа NH4Cl:
|
|
(1) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2. Для солей типа CH3COONa:
|
|
(2) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу соли, образованные этой кислотой.
3. Для солей типа NH4CN:
|
|
(3) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
4. Для солей типа Na2CO3 (две ступени гидролиза):
|
|
(4) |
|
|
(4´) |
Так
как
![]() ,
следовательно,
,
следовательно,
![]() .
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
.
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
Степень гидролиза (h) отношение количества гидролизованной соли к общему количеству растворенной соли, обычно выражаемое в процентах.
Если,
например, в воде было растворено 2 моль
соли, а гидролизу подверглось 0,01 моль,
то
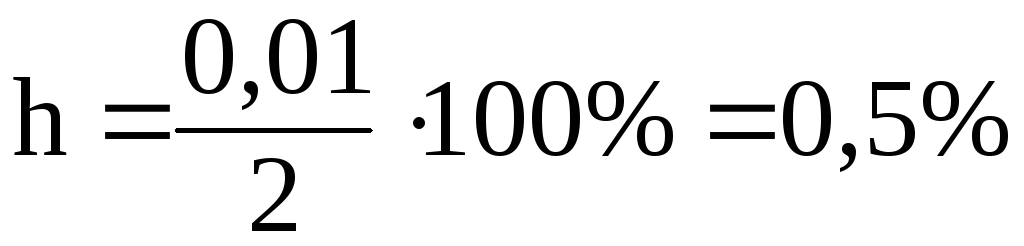 .
.
Степень гидролиза зависит от многих факторов:
1. В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах CH3COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(CH3COONa) 0,01%, a h(NaCN) 1,5%.
Это объясняется различной силой кислот, составляющих соли:
![]()
![]()
![]() .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем выше степень гидролиза.
2. Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, поэтому:
Чем выше температура, тем больше степень гидролиза.
3. Степень гидролиза зависит от концентрации раствора:
Чем меньше концентрация раствора соли, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1. Для солей типа NH4Cl:
|
|
(5) |
2. Для солей типа CH3COONa:
|
|
(6) |
3. Для солей типа NH4CN:
|
|
(7) |
Таким образом, степень гидролиза солей, образованных слабой кислотой и слабым основанием, практически не зависит от концентрации раствора соли.
Усиление и подавление гидролиза
Так
как в большинстве случаев процесс
гидролиза является обратимым, то изменяя
условия (температуру, концентрацию
растворов и др.), можно смещать равновесие
гидролиза в сторону его усиления (![]() )
или подавления (
)
или подавления (![]() ).
).
На основании изложенного материала можно сформулировать общие правила смещения гидролитического равновесия:
1. Если необходимо сместить равновесие в сторону возможно более полного разложения соли (т. е. увеличить степень гидролиза), то следует работать с разбавленными растворами и при высокой температуре.
2. Если необходимо, чтобы гидролиз протекал в как можно меньшей степени (т. е. степень гидролиза была бы минимальной), то работать следует с концентрированными растворами и на холоде.
Кроме того, можно добавлять к раствору избыток одного из образующихся при гидролизе продуктов (кислоты или щелочи).
Во многих случаях гидролиз это неприятное осложнение, возникающее при синтезе или при хранении водных растворов различных соединений.
Так, при получении сульфата меди CuSO4 в его кристаллы попадает примесь гидроксосульфата меди (CuOH)2SO4, образующегося в результате гидролиза:
2CuSO4 2HOH ⇄ (CuOH)2SO4 H2SO4
Для подавления гидролиза в раствор вводят небольшое количество серной кислоты.
Если вещество подвергается необратимому гидролизу, то его синтез и хранение осуществляют в неводных средах или в условиях, исключающих присутствие растворителей. Например, сульфид алюминия Al2S3 получают только путем непосредственного взаимодействия алюминия с серой.

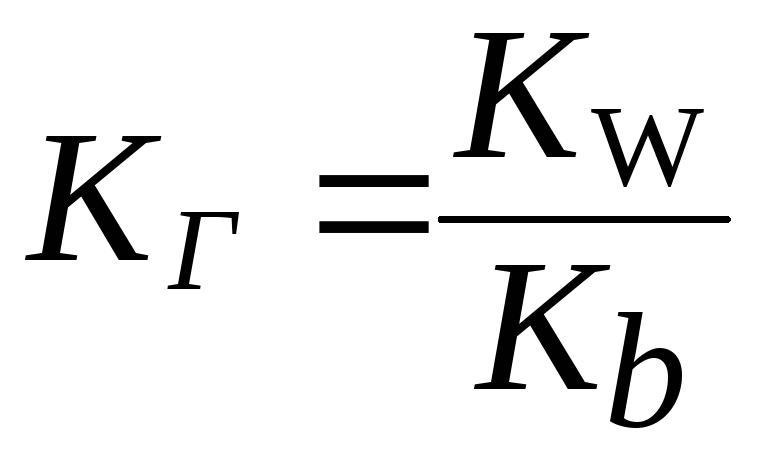 .
.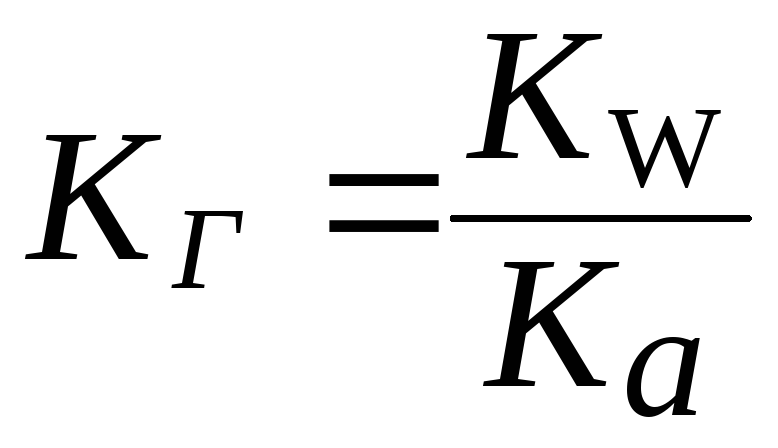 .
.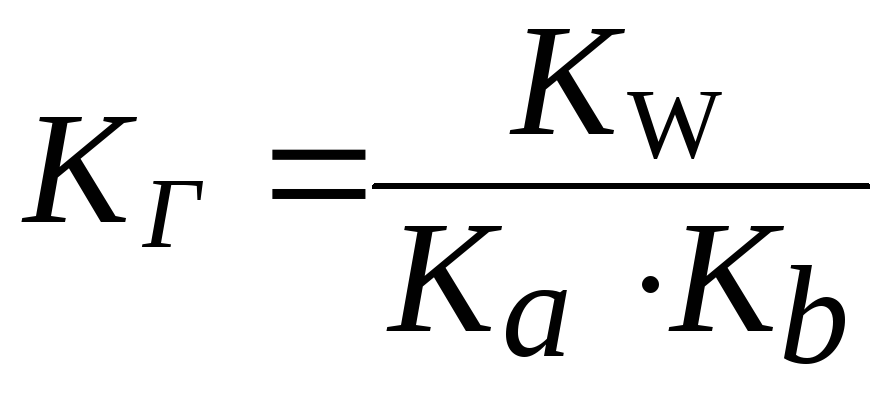 .
.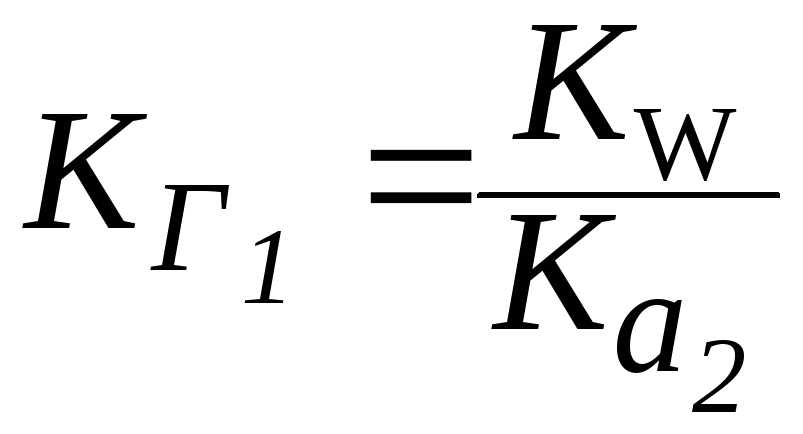

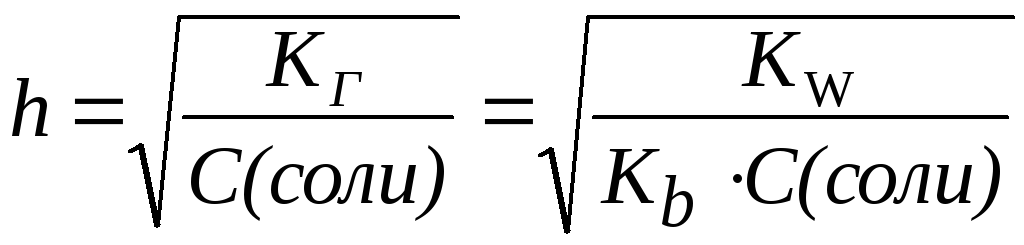 .
.