
7 Билет
Метод МО. Энергетические диаграммы гомоядерных молекул. Энергетически диаграммы для частиц: O2, C2, N2 (порядок, энергия, длина связи).
Необратимый гидролиз. Совместный гидролиз.
Цинк, кадмий. Химическая активность. Оксиды, гидроксиды, соли, комплексные соединения. Биологическая роль цинка.
(1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу.
В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов.
Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями.
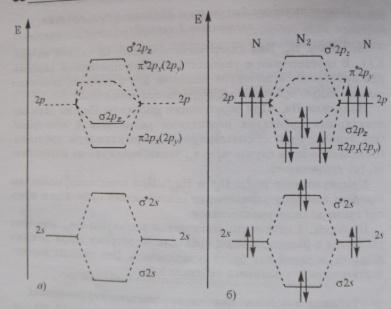
N2. Электроны 1s слоя участие в образовании химической связи не принимают, 8 орбиталей внешнего слоя 2х атомов азота комбинируются в 8 МО. На 2s и 2p орбиталях находится 10е. При образовании молекулы е заселяют орбитали с наиболее низкой энергией. Разрыхляющие орбитали П*2рх, П*2ру и 6*2рz остаются незаселенными, е 2s орбиталей, заполняя при комбинировании связывающую и разрыхляющую орбитали, фактически не образуют хим. Связи – это неподелынные электронные пары на атомах азота. Порядок связи в молекуле азота 3, энергия связи 940 кДж/ моль.
О2. Отличительная особенность - орбитали П*2рх, П*2ру и 6*2рz находится. Во внешнем слое 12 е, 10е заполняют 62s, 6*2s, 62pz, П2px, П2py. 2е должны быть на П*2px – П*2py.
Так
как энергии равны, то по правилу Хунда
е занимают обе орбитали, порядок связи
2. В молекуле 2 неспаренных е – она
парамагнитна. Е связи 494 кДж /моль.
(2)Гидролиз- обменное взаимодействие между ионами соли и водой
Особые случаи гидролиза. Необратимый гидролиз. Необратимый гидролиз известен только для некоторых солей — Cr2S3, A12S3 и др. В воде эти соли полностью разлагаются:
Cr,S3 + 6Н0Н -> 2Сг(0Н)3 + 3H2S.
К числу особых случаев гидролиза следует отнести и совместный гидролиз. Совместный гидролиз возможен в растворе двух или более солей. Условием для протекания этого типа гидролиза является гидролиз одной соли по катиону, а второй — по аниону:
А” + НОН НА + ОН", Ме+ + НОН МеОН + Н\
Образующиеся гидроксид-ионы и ионы водорода выводятся из сферы реакции в виде молекулы воды.
Этот тип — тип необратимого гидролиза. Он характерен для солей металлов со степенями окисления +3 и +2 (Fe3+, Ст3+. Си2*, Zn2+ и др.). Природа продуктов гидролиза определяется природой их солей. В случае солей металлов со степенями окисления +3 продуктами реакции является слабые основания и кислота:
CrCl3 + 3Na2C03 + 6Н20 -> 2Сг(ОН)3 + Н2С03 + 6NaCI
2А1С13 + 3Na2S + 6 Н20 = 2А1(ОН)3 + 6NaCl + 3H2S.
Если соль образована металлами со степенями окисления +2, то один из продуктов реакции — основная соль:
2CuC12 + 2Na2C03 + Н20 = (Cu0H)2C03 + СО, + 2NaCl.
(3). Цинк и кадмий сгорают в токе кислорода с образованием оксидов ЭО.С серой и галогенами цинк и кадмий реагируют только при нагревании. В ряду Zn-Cd-Hg химическая активность понижается, что подтверждается и значениями стандартных электродных потенциалов (табл. 5). Цинк и кадмий не взаимодействуют с водой, так как покрыты защитной оксидной пленкой. В растворах аммиака защитная пленка растворяется: Zn + 4NH3 +2Н20 = [Zn(NH3)4](OH)2 + H2t Цинк вытесняет водород из кислот и щелочей, кадмий — только из кислот: Cd +2НС1 = CdCl2 + Н2Т Zn +2КОН + 2Н20 = K2[Zn(OH)4] + Н2Т. Цинк и кадмий восстанавливают концентрированную серную кислоту до S02, а при нагревании — до H2S: 4Zn + 5H2S04 = 4ZnS04 + H2St +4H20 Cd + 2H2S04 = CdS04 + S02T + 2H20 Цинк и кадмий ведут себя по отношению к HN03 значительно активнее. Цинк, например, способен максимально восстанавливать очень разбавленную HN03: 4Zn + 10HN03 = 4Zn(N03)2 + NH4N03 +3H20 Цинк, кадмий и ртуть легко образуют сплавы как друг с другом, так и с другими металлами.Гидроксиды цинка и кадмия получают обменной реакцией соответствующих солей со щелочами. Zn(OH)2, Cd(OH)2 — малорастворимые, бесцветные соединения. Гидроксид цинка амфотерен с преобладанием основных свойств:Zn(OH)2 + 2Н+ = Zn2+ + 2Н20 Zn(OH)2 + 20Н = [Zn(OH)4]2 С увеличением радиуса катиона от Zn к Cd усиливаются основные свойства. Cd(OH)2 проявляет кислотные свойства только при длительном кипячении с концентрированной щелочью. Оба гидроксида растворяются в аммиаке с образованием комплексов: Э(ОН)2 + 4NH3 = [3(NH3)4]2+ + 20Н Гидроксиды ртути не получены в свободном виде, так как разлагаются с отщеплением воды из-за сильного поляризующего действия катионов ртути на гидроксид- ионы: Hg(N03)2 + 2NaOH = HgO + 2Н20 + 2NaN03 Hg2(N03)2 + 2NaOH = Hg20 + H20 + 2NaN03 В присутствии растворимых карбонатов соли цинка и кадмия полностью гидролизованы с выделением осадков основных солей: 2Э2+ + 2С032 + Н20 = (Э0Н)2С03 + С02 Электрическая проводимость растворов однотипных солей цинка, кадмия и ртути в ряду Zn-Cd-Hg уменьшается. Электрическая проводимость растворов обусловлена концентрацией ионов в растворе. В воде соли цинка ионизированы практически полностью, соли кадмия образуют аутокомплексы типа Cd[CdX3]2 и Cd[CdX4], Поэтому в растворах солей кадмия концентрация ионов, а вместе с ней и электрическая проводимость, меньше, чем в растворах аналогичных солей цинка. При добавлении аммиака к растворам солей цинка и кадмия образуются аммиачные комплексы состава [3(NH3)4]2+ или [3(NH3)2Cl2]. [Zn(NH3)2Cl2] — молекулярное соединение, имеющее тетраэдрическое строение; [Cd(NH3)2Cl2] — полимер с координационным числом кадмия 6.Цинк необходим животным для нормального роста, дыхания и кровеобразования.
(4) C(H+)=sqrt(Ka*Cm) C(H+)=10-5 моль/л pH=-lg[H+] =5
8билет
Метод молекулярных орбиталей (ММО). Порядок заполнения молекулярных орбиталей. Условия устойчивости молекул. Кратность связей в ММО.
Гидролиз солей. Степень и константа гидролиза. Факторы, влияющие на степень гидролиза солей.
Общая характеристика s-элементов I группы. Характер связи в соединениях. Химическая активность.
(1)Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу.
В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов. Волновые функции, описывающие состояние электронов в молекуле, называются молекулярными орбиталями. Принципы заполнения АО:
Принцип наименьшей энергии Правило Хунда(суммарное значение спинового квантового числа данного подслоя должно быть максимальным) Правило Паули(2 и более тождественные частицы не могут находиться в одном квантовом состоянии) Порядок заполнения должен быть таким, чтобы при данном числе электронов обеспечивалась минимальная энергия молекулярной системы. Первой заполняется орбиталь с наименьшей энергией. Орбитали располагаются в соответствии с порядком возрастания их энергии:
61s<61s*<62s<62s*<62pz<П2p=
П2p<
П*2p=<
П*2p<62pz*
Размещение электронов на связывающих
орбиталях стабилизирует молекулу,
заполнение разрыхляющих орбиталей,
наоборот, разрыхляет, делает менее
прочными связи в молекуле. Условия
устойчивости молекул: молекула будет
устойчива только тогда, когда сумма
электронов на связывающих орбиталях
превышают сумму электронов на разрыхляющих
орбиталях![]()
Pim = (neсв-ne*)/2
Pim > 0 молекула существует
(2) Гидролиз — обменное взаимодействие между ионами соли и водой.
В реакцию гидролиза вступают:
соли, образованные слабой кислотой и сильными основаниями (KN02, Na,P04, NaX03 и т. д.);
соли, образованные слабым основанием и сильной кислотой (NH4C1, CuCl2, ZnClj FeClj и т.д.);
соли, образованные и слабым основанием и слабой кислотой (NH4CN, (NH4)2S и т. д.).
1) Степень гидролиза.
2) Kг
(Кр) – константа гидролиза, выводимая
на основании закона действующих масс
применительно ионного уравн

Природа вещества.
Концентрация соли: степень гидролиза увеличивается с уменьшением концентрации соли, что связано с увеличением концентрации воды.Повышение температуры усиливает гидролиз, т.е. это процесс эндотремический.
Добавление кислот и оснований:

(3)Все s-элементы I группы проявляют устойчивую степень окисления +1.
Т.к. значения энергии ионизации низкие, проявляются сильные восстановительные свойства атомов. С увеличением порядкового номера усиливаются металлические свойства. В свободном состоянии s-элементы I и II группы-металлы серебристо-белого цвета. Щелочные металлы имеют рыхлую кристаллическую решетку, легкие, низкоплавкие, s-элементы химически активны. s-элементы I группы образуют с кислородом оксиды Э2О, пероксиды Э2О2, надпероксиды ЭО2(Э2О4) и озониды ЭО3. С ростом радиуса атомов при переходе от лития к цезию устойчивость пероксидов увеличивается, а оксидов – уменьшается. При взаимодействии с кислородом литий образует оксид: 4Li+O2 =2LiO2 натрий – пероксид:2Na+ O2 = Na2O2 элементы подгруппы калия – надпероксиды: K+ O2 =KO2 Озониды образуют только калий, рубидий, цезий:
K+ O3 =KO3 4KOH+4O2 = KO3 + O2 +2H2O Оксиды натрия и элементов подгруппы калия получают из пероксидов: Na2O2 + 2Na=2Na2O. Биологическая роль: тело животных и человека состоит частично из этих атомов, которые осуществляют многие процессы в организме.
(4) Ksp=S2 S=1.14*10-4моль/л V=m/(c*M)=2.895л
