
Лекция 5. Валентные возможности атомов химических элементов
.docxВалентные возможности атомов химических элементов.
Степень окисления.
Понятия С.О. и валентности и их существенное различие.
Атомы химических элементов в основном состоянии на внешнем энергетическом уровне могут иметь электроны спаренные и неспаренные.
Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны называются валентными. В первую очередь валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи. Далее объяснение учителя сопровождается составлением таблицы.
У s- и p-элементов валентные электроны расположены на s- и р-подуровнях внешнего энергетического уровня.
У d-элементов — на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергетического уровня.
У f-элементов — на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f-подуровень, третьего с края энергетического уровня.
Расположение валентных электронов элементов разных семейств
Семейства элементов |
Подуровни, на которых располагаются валентные электроны |
Энергетические уровни |
s-элементы |
s-подуровень |
внешний энергетический уровень |
р-элементы |
s- и р-подуровни |
внешний энергетический уровень |
d-элементы |
s-подуровень d-подуровень |
внешнего энергетического уровня предвнешний энергетический уровень |
f-элементы |
s-подуровень d-подуровень f-подуровень |
внешний энергетический уровень предвнешний энергетический уровень третий с края энергетический уровень |
Все валентные электроны определяют основные свойства элементов. Уровни, подуровни, на которых располагаются валентные электроны, называются валентными.
Учащиеся вместе с учителем составляют электронные и электронно-графические формулы s-, р-, d-, f-элементов в основном состоянии.
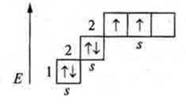
Литий (Li): +3; 3е-, 1s22s1; s-элемент, атом имеет один неспаренный s-электрон, валентность лития — 1.
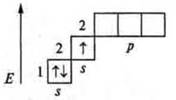
Фосфор (Р): +15; 15е-.
1s22s22p63s23p3; p-элемент.
Фосфор имеет пять валентных электронов — два спаренных s-электрона и 3 неспаренных р-электрона.
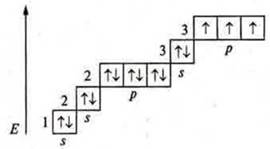
Марганец (Мn): +25; 25е-.
1s22s22p63s23p64s23d5; d-элемент.
Марганец имеет семь валентных электронов, два спаренных s- электрона и пять неспаренных d-электронов.
Однако следует помнить, что в первую очередь в реакцию вступают неспаренные электроны последнего энергетического уровня. В зависимости от заполнения последнего энергетического уровня химические элементы делятся на активные, если есть неспаренные электроны, и малоактивные, если есть парные — спаренные электроны. На основании строения атома в основном состоянии можно определить металличность и неметалличность элемента. Если на последнем энергетическом уровне электронов меньше, чем три — это металлический элемент; в нашем случае Li, Мn — металлические элементы; если электронов на последнем энергетическом уровне больше, чем четыре, это неметаллический элемент, в нашем случае это Р., следовательно, все s-, d-, f-элементы — это металлические элементы; а p-элементы могут быть и металлические, и неметаллические.
В ПСХЭ по диагонали от В к At все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению атома элементы, у которых на внешнем энергетическом уровне три или четыре электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
Таким образом, валентность элемента в первую очередь определяется количеством неспаренных электронов внешнего энергетического уровня. Однако: каким же образом атом углерода в основном состоянии С; +6; 6е-, 1s22s22p2, р-элемент, 2 неспаренных электрона (следовательно, его валентность — два) может проявить валентность четыре?
Известно, что если в атоме элемента имеются свободные орбитали, то в случае имеющейся энергии извне возможно распаривание парных электронов и переход электрона на свободную орбиталь. Атом в таком случае находится в возбужденном состоянии. В случае с атомом углерода на р-подуровне имеется свободная орбиталь. В возбужденном состоянии происходит переход одного s-электрона с 2s-подуровня на свободную орбиталь 2р-подуровня. Затрата Е равна 400 кДж/моль. Она компенсируется при образовании двух моль С—Н связей, выделяется 720 кДж/моль. что превышает энергию перевода атома углерода в возбужденное состояние на 320 кДж/моль.
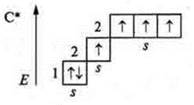
Вследствие чего в атоме углерода образуется четыре неспаренных углерода, валентность углерода равна четырем.
Чем же определяются валентные возможности атомов?
Валентные возможности атомов определяются числом неспаренных электронов в основном и в возбужденном состоянии.
Однако валентные возможности атомов могут определяться и числом пустых орбиталей, и числом неподеленных электронных пар.
Атом элемента, предоставляющий неподеленную электронную пару, называется атом-донор, атом-акцептор имеет свободные орбитали и предоставляет их неподеленным парам электронов.
Пример: Азот (N): +7, 7е-.
1s22s22p3; р-элемент.
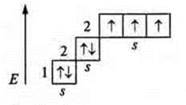
На внешнем энергетическом уровне в основном состоянии: пара спаренных s-элементов и три неспаренных p-электрона, валентность по количеству неспаренных электронов — три, а также атом азота — атом-донор, предоставляет неподеленную пару s-электронов. В основном состоянии атом азота проявляет валентность четыре.
Сделаем общий вывод о валентных возможностях атомов химических элементов.
Валентные возможности атомов определяются:
1) количеством неспаренных электронов в основном и в возбужденном состоянии;
2) наличием неподеленных пар электронов, и быть атомами-донорами;
3) числом пустых орбиталей, и быть атомами-акцепторами.
В качестве закрепления учащиеся выполняют задание: определить валентные возможности атомов а) фосфора; б) хлора в основном и в возбужденном состоянии.
Фосфор (Р): +15; 15е-.
![]()

В основном состоянии атом фосфора может проявить валентность:
— три — т. к. в атоме три неспаренных p-электрона;
— четыре — т. к. атом фосфора, атом-донор, может предоставить пару электронов для образования химической связи.
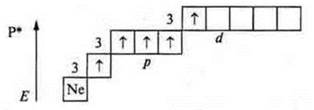
Если атом фосфора находится в возбужденном состоянии, то возможен переход s-электрона с подуровня 3s на подуровень 3d — на свободную орбиталь, вследствие чего в атоме появляются пять неспаренных электронов, что обеспечивает валентность атома фосфора — пять.
Хлор (Сl), +17, 17е-;
![]()
В основном состоянии валентность — один (один неспаренный p-электрон), хлор — атом-донор и может предоставить пары спаренных электронов и проявлять в основном состоянии валентность, равную один, два, три, четыре.
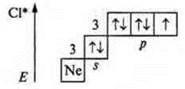
Первое возбужденное состояние — переход р-электрона (одного на 3d-подуровень): три неспаренных электрона — валентность — три; атом-донор — валентность — четыре, пять.
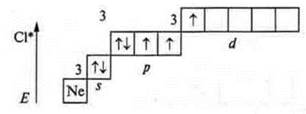
Второе возбужденное состояние — переход p-электрона (следующего с p-подуровня, на 3d-подуровень): пять неспаренных электронов — валентность — пять; атом-донор — валентность — шесть.
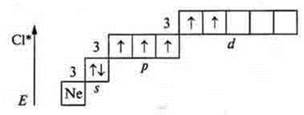
Третье возбужденное состояние — семь неспаренных электронов; валентность — семь.
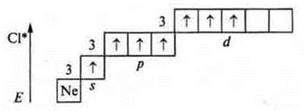
Максимальная валентность атомов химических элементов II периода всегда четыре, так как на II энергетическом уровне возможно открытие только четырех орбиталей: одной s- и трех р-; у элементов III периода возможно открытие 9 орбиталей — одной s-; трех р- и пяти d-. Они могут проявлять валентность до максимальной (9), однако известна только 8. (В дальнейшем мы узнаем конкретно, какие элементы и в каких соединениях имеют такую валентность.)
Как правило, валентность записывается римской цифрой у элемента в соединении.
Пример:
![]()
Однако у элементов в соединении определяется не только валентность, но и степень окисления. Одно ли это понятие?
Валентность атома — это количество общих электронных пар, которые данный атом образует с другими атомами в данном соединении, учитывая его валентные возможные, которые он проявил в данном соединении.
Степень окисления (С.О.) — условный заряд, который приобретает атом в соединении в случае смещения электронов от атома — положительный заряд и, наоборот, смещение электронов к атому — отрицательный заряд, если считать все связи в веществе ионными.
Если в соединении атом не проявляет валентность как донор, то степень окисления (С.О.) численно совпадает с валентностью.
Пример:

В образовании связи азот выступил как атом-донор. С.О. может быть минимальной (min), максимальной (шах) и промежуточной.
C.O.min определяется числом валентных мест в незавершенном энергетическом уровне для неметаллических элементов. У атома углерода C.O.mjn = -4, т. к. до устойчивости внешнего энергетического уровня атома углерода — до 8 электронов — число валентных мест четыре, у атома азота C.O.min = -3; кислорода C.O.min = -2.
Максимальная С.О. определяется числом электронов внешнего энергетического уровня s- и р-электронов (суммой), а также суммой s- и d-электронов для d-элементов.
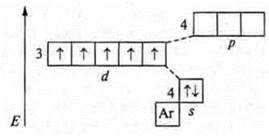
Пример: атом марганца — это d-элемент, металлический. У металлических элементов С.О. соответствует количеству электронов внешнего энергетического уровня.
Для металлических элементов s- либо +1, +2: s- и р- +3, +4 для d-элементов, Мn 4s23d5 минимальная, у марганца +2; максимальная сумма s- и d-электронов +7.
Промежуточные С.О. возможны от 0, +1, +2 +3 +4, +5, +6, +7. Однако устойчивыми считаются 0, +2, +4, +6, +7.
Определение С.О. элементов в соединениях.
а) бинарные соединения:
![]() —
определить
элемент более электроотрицательный, к
которому смещаются электроны, и его
минимальную С.О., в данном случае это
сера; min = -2.
—
определить
элемент более электроотрицательный, к
которому смещаются электроны, и его
минимальную С.О., в данном случае это
сера; min = -2.
Молекула всегда электронейтральна, следовательно произведение С.О. электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов.
2х = 6; х = 3. С.О. алюминия+3;
б) соединения более сложного состава:
![]() —
поставить
С.О. известных элементов, в данном случае
это кислород -2 и калий +1; неизвестный
элемент — х.
—
поставить
С.О. известных элементов, в данном случае
это кислород -2 и калий +1; неизвестный
элемент — х.
Далее так же, как и в бинарных соединениях.
(+1) · 1 + x + (-2) · 4 = 0;
+ 1 + x — 8 = 0; 1 + х = 8; х = +7.
По абсолютной величине верно х = +7.
1 + х = 8; х = 7; х = +7;
либо по схеме:
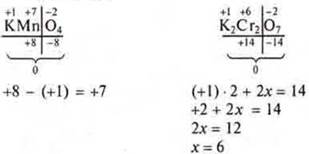
Если соединение с неполярной ковалентной связью — простое вещество, то С.О. равно 0.
![]()
В органических соединениях С.О. углерода определяется у каждого в отдельности, учитывая С.О. элементов, связанных с ним.
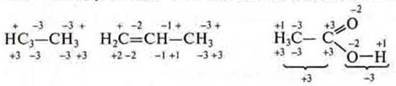
Углерод во всех соединениях четырехвалентен, однако С.О. имеет различные. Этот факт еще раз подтверждает то, что С.О. и валентность не одно и то же понятие.
