
8542
.pdf81
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ БЕЛКА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ГИДРОБИОНТОВ В ОТВЕТ НА
ИЗМЕНЕНИЕ СРЕДЫ ОБИТАНИЯ.
Общую концентрацию белка в гемолимфе, перивисцеральной жидкости и сыворотки крови беспозвоночных и позвоночных животных принято определять с помощью стандартных методов (метод Лоури, метод Брадфорд, спектрофотометрическое определение концентрации белка).
Принцип метода заключается в увеличении синтеза общего белка в плазме и перивисцеральной жидкости при стрессе, заболеваниях, нарушающих поддержание внутренней среды организма.
Для моделирования неблагоприятных условий окружающей среды гидробионтов (морских звезд, пресноводных моллюсков)
содержат в лабораториях в аквариумах, где экспериментально ухудшают УСЛОВИЯ содержания с целью стимуляции у них иммунозащитных реакций. В лабораторной работе предложен метод оценки динамики общей концентрации белка в перивисцеральной жидкости морских звезд в ответ на ухудшение условий содержания и ВВЕДение антигенов. Аналогичные эксперименты возможны и на пресноводных животных.
Для активации иммунозащитных реакций беспозвоночным животным вводят различные антигены, растворенные в стерильной профильтрованной морской воде. Контрольным группам вводят равный объем морской воды или оставляют животных интактными. Активация иммунного ответа у рыб происходит естественным образом — патогенными микроорганизмами при бактериальной инфекции у радужной форели и продуктами метаболизма паразитов при инвазии у морских рыб (наваги и трески). Для определения наличия патогенных микроорганизмов и паразитов у рыб проводят дополнительные исследования: бактериологические и паразитологические.
У морских звезд (пресноводных моллюсков), содержавшихся в условиях, приближенных к естественным, при введении различных антигенов в перивисцеральной жидкости общая концентрация белка не изменяется (рис. 2, белые столбики). Ухудшение условий содержания приводит к возрастанию концентрации общего белка в перивисцеральной жидкости гидробионтов. Наибольшее влияние на них оказывает пониженнная аэрация (черные столбики на рис. 2): у

82
опытных животных увеличивается количество белка независимо от природы вводимого антигена.
Оборудование, материалы и растворы:
исследуемая гемолимфа, целомическая жидкость или сыворотка крови; физиологический раствор; дистиллированная вода; стеклянные пробирки; автоматические пипетки на 100 – 1000 мкл; бумажные фильтры; фарфоровая ступка с пестиком; спектрофотометр или фотометр (КФК); антигены (бычий сывороточный альбумин (БСА), липополисахариды (ЛПС), эритроциты человека (ЭЧ) или барана (ЭБ)); культура клеток Saccharomyces cerevisiae, черная тушь, профильтрованная через нитроцеллюлозный фильтр с диаметром пор 45 мкм морская вода; аквариумы (100 л); бензин; компрессор для аквариумов; термометр для воды; лабораторные животные – морские звезды (10 шт. на аквариум).
Рис. 2. Общая концентрация белка в перивисцеральной жидкости морских звезд в зависимости от условий содержания и от введенного антигена.
Порядок выполнения лабораторной работы
1. Для определения концентрации белка спектрометрическим методом пробы исследуемых жидкостей развести профильтрованной через нитроцеллюлозный фильтр с диаметром пор 45 мкм морской водой до концентрации, попадающей в интервал чувствительности спектрофотометра или КФК. Определить оптическую плотность пробы при длинах волн 280 и 260 нм.
83
2.Рассчитать концентрацию белка в пробе по формуле:
С=1,45D280 – 0,74D 260, где С — концентрация белка в пробе (мг/мл), D280 и D260 - оптическая плотность пробы при длине волны 280 и 260 нм
соответственно; 1,45 и 0,74 — коэффициенты молярной экстинкции белков и нуклеиновых кислот при соответствующих длинах волн.
3. Морских звезд разделить на 4 группы и поместить в отдельные аквариумы.
4 В аквариум, где содержатся животные группы 1, добавить в качестве загрязняющего агента бензин (0,003%); в аквариуме, где содержатся животные группы 2, повысить температуру воды до 15оС; в аквариуме, где содержаться животные группы 3, уменьшить аэрирование воды; группа 4 – контроль.
5.Для стимуляции иммунных реакций животным каждой группы вводят любые антигены (БСА, ЛПС, ЭЧ или ЭБ, суспензию клеток S. cerevisial, черную тушь) или профильтрованную морскую воду.
6.Через 24 ч отобрать пробы перивисцеральной жидкости и провести сравнительный анализ концентрации общего белка у контрольных и экспериментальных животных.
7.В ответ на ухудшение условий обитания у морских звезд обнаруживается увеличение концентрации общего белка в перивисцеральной жидкости. Этого не происходит при введении антигенов различной природы, что свидетельствует об активизации иммунозащитных врожденных реакций организма.
Справочный материал
Приготовление и введение антигенов мидиям и морским
звездам
В качестве антигенов служат: бычий сывороточный альбумин (БСА), эритроциты человека (ЭЧ) или эритроциты барана (ЭБ), липополисахарид (ЛПС) из клеточных стенок грамотрицательных
бактерий Salmonella typhimurium, клетки Saccharomyces cerevisiae,
черная (китайская) тушь.
Растворы и суспензии антигенов готовят на физиологическом растворе или морской воде, которые стерилизуют фильтрованием через нитроцеллюлозный фильтр с порами диаметром 45 мкм.
Существует два принципиально различающихся способа введения антигена в организм мидии: с помощью шприца в полость тела (в области перикарда делают надпил) или в фильтруемый раствор. Во втором случае антиген определенной концентрации добавляют в воду аквариума (объем известен), где содержится определенное количество
84
моллюсков, чтобы можно было рассчитать, сколько антигена приходится на одно животное.
В экспериментах используют следующие дозы антигенов:
Антиген |
Концентрация |
|
|
Доза раствора |
|
|
|
|
на животное |
||
|
|
|
мидия |
морская |
|
|
|
|
|
|
звезда |
БСА |
Раствор, 8 мкг/мл |
|
0,2 |
мл |
1,2 мл |
|
Раствор, 80 мкг/мл |
|
0,2 |
мл |
1,2 мл |
|
|
|
|
|
|
ЭЧ или ЭБ |
Суспензия 200—500 |
млн |
0,2 |
мл |
1 мл |
|
кл./мл |
|
|
|
|
ЛПС |
Раствор, 100 мкг/мл |
|
0,2 |
мл |
1,2 мл |
|
|
|
|
|
|
Клетки |
Суспензия, 120 – 130 |
млн |
0,2 |
мг |
1,2 мл |
Saccharomyces |
кл/мл |
|
|
|
|
cerevisiae |
|
|
|
|
|
Черная |
0,1%-й раствор туши на |
0,1% |
- |
||
(китайская) |
аквариум |
|
|
|
|
тушь |
|
|
|
|
|
Перед введением раствора морскую звезду необходимо слегка обтереть сухой салфеткой. Следует помнить, что при сильном сдавливании луча звезды, особенно у основания, может произойти его автоампутация, что сделает животное непригодным для дальнейших экспериментов.
Раствор или суспензию антигена вводят в целом животного при помощи шприца в объеме, не превышающем 1 – 1,5 мл. Иглу вводят с аборальной стороны от второй трети луча на 5 – 10 мм в направлении центра под углом 30 – 50 о к поверхности тела. Ход иглы должен быть плавным, чтобы не повредить внутренние органы животного. После извлечения иглы нужно несколько минут подержать звезду вверх тем лучом, в который производилась инъекция, чтобы уменьшить вытекание жидкости.
85
Лабораторная работа № 17
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ЛИЗОЦИМА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ГИДРОБИОНТОВ В ОТВЕТ НА
ИЗМЕНЕНИЕ СРЕДЫ ОБИТАНИЯ.
Лизоцим — вещество, относящееся к группе ферментов (мурамидаза) и обладающее бактерицидным действием. Обнаруживается в различных тканях организма, особенно вовлеченных в воспалительный процесс. Лизоцим находится в больших количествах в яйцах птиц, в слюне, в нейтрофилах и макрофагах При их повреждении лизоцим поступает в окружающие ткани и плазму крови из неповрежденных макрофагов и лейкоцитов. Угнетает реакции отторжения трансплантации у кроликов и мышей. Он является неспецифическим фактором естественной резистентности организма.
Метод определения концентрации лизоцима часто используют для регистрации происходящего в организме воспаления, стресса или ухудшения условий среды обитания, так как при этих явлениях наблюдается нарастание его концентрации в сыворотке крови позвоночных или гемолимфе и целомической жидкости беспозвоночных животных по сравнению с нормой.
Принцип метода, лежащий в основе лабораторной работы, аналогичен предложенному в лабораторной работе № 7.
Для моделирования неблагоприятных условий окружающей среды гидробионтов (морских звезд, пресноводных моллюсков и др.) содержат в лабораторных аквариумах, где экспериментально ухудшают условия содержания с целью стимуляции у животных и иммунозащитных реакций (см. лабораторную работу № 7).
У морских звезд (пресноводных моллюсков), содержавшихся в условиях, приближенных к естественным, при введении различных антигенов в перивисцеральной жидкости увеличивается содержание лизоцима (рис. 3, белые столбики).
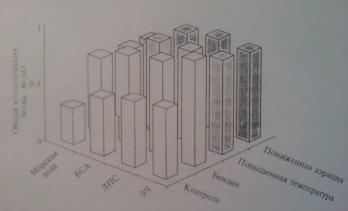
86
Рис.3. Концентрация лизоцима в перивисцеральной жидкости морских звезд в зависимости от условий содержания и от введения различных антигенов
При ухудшении условий содержания концентрация лизоцима в перивисцеральной жидкости гидробионтов возрастает. Наибольшее влияние на них оказывает пониженная аэрация (черные столбики): у опытных животных количество лизоцима увеличивается независимо от природы вводимого антигена.
Оборудование, материалы и растворы:
гемолимфа, целомическая жидкость или сыворотка крови; ацетоновый бактериальный порошок Micrococcus lysodeicticus (см. справочный материал к работе); эфир; натрий-фосфатный буфер; лизоцим; жидкая питательная среда МПБ; физиологический раствор; дистиллированная вода; стеклянная лабораторная посуда; бумажный фильтр; фарфоровая ступка с пестиком; спектрофотометр или КФК; антигены (БСА, ЛПС, ЭЧ); профильтрованная через нитроцеллюлозный фильтр с порами диаметром 45 мкм морская вода; аквариумы; бензин; компрессор для аквариумов; термометр для воды; лабораторные животные – морские звезды.
Порядок выполнения лабораторной работы |
|
1 Получить у преподавателя ацетоновый порошок |
Micrococcus |
lysodeicticus для построения калибровочной кривой. |
|
2.В 5 - миллиметровую кювету внести 1,5 мл полученной взвеси, 0,5 мл физиологического раствора и 1 мл стандартного разведения лизоцима. Смесь быстро размешать и измерить оптическую плотность раствора при длине волны 540 нм через 15 и 180 с на спектрофотометре или К.ФК.
3.Построить калибровочную кривую зависимости оптической плотности раствора от концентрации в нем лизоцима при стандартных разведениях.
87
4.Смешать исследуемую гемолимфу, целомическую жидкость или сыворотку крови с бактериальным ацетоновым порошком в натрийфосфатном буфере.
5.Провести измерение оптической плотности и определить концентрацию лизоцима в исследуемом образце по калибровочной кривой, построенной по стандартным разведениям лизоцима.
6.Морских звезд разделить на 4 группы и поместить в отдельные аквариумы.
7.В аквариум, где содержатся животные группы 1, добавить в воду
бензин в качестве загрязняющего агента (0,003 %); в аквариуме, где содержатся животные группы 2, повысить температуру воды до 15оС; в аквариуме, где содержатся животные группы 3, уменьшить
аэрирование воды; группа 4 — контроль. |
I |
8.Для стимуляции иммунных реакций животным каждой группы ввести антигены (БСА, Л ПС, ЭЧ) или профильтрованную морскую (речную) воду.
9.Через 24 ч отобрать пробы перивисцеральной жидкости и провести сравнительный анализ концентрации лизоцима у контрольных
иэкспериментальных животных.
10.Концентрация лизоцима в перивисцеральной жидкости морских звезд увеличивается в ответ на ухудшение условий среды обитания.
Справочный материал
Приготовление ацетонового порошка M. lysodeicticus и
построение калибровочной кривой
Бактериальную массу M. lysodeicticus, выросшую на жидкой питательной среде МПБ, дважды отмыть физиологическим раствором и один раз дистиллированной водой. Центрифугировать при 3 000g в течение 20 мин. Осадок ресуспендировать в дистиллированной воде и перенести в десятикратный объем ацетона. Взвесь поставить в холодильник (температура 1оС) на 2 ч, затем ее профильтровать через двухслойный бумажный фильтр, смоченный водой. Осадок промыть два раза холодным ацетоном и один раз эфиром. Полученную бактериальную массу высушить при комнатной температуре на воздухе и измельчить в ступке. Бактериальный ацетоновый порошок в количестве 50 мг смешать со 100 мл натрий-фосфатного буфера.
Приготовление натрий-фосфатного буфера
0,2 г Na2HP04 и 0,2 г NaH2P04 растворяют в 800 мл дистиллированной воды. При необходимости доводят рН до 6,2 paствором одной из солей той же концентрации. Доводят объем до 1 л.
88
Стандартные разведения лизоцима
Лизоцим в количестве 3 мг растворяют в 10 мл натрий-фосфатного буфера (концентрация 500 мкг/мл). Делают последовательные разведения лизоцима (12,5; 6,25; 3,13; 1,56 мкг/мл).
11. Сделать выводы.
89
Список литературы
1.Гигиенические требования к охране поверхностных вод. – СанПиН 2.1.5.980-00.
2.Руководство по методам гидробиологического анализа поверхностных вод и донных отложений/ под ред. В.А. Абакумова. – М.: Госкомгидромед, 1983.
3.Санитарно – микробиологический анализ питьевой воды. Методические указания. – М.: Федеральный Центр Госсанэпиднадзора Минздрава России, 2001.
4.Теппер Е.З. Практикум по микробиологии/ Е.З. Теппер (и др.). – М.: Колос, 1993.
5.Константинов А.С. Общая гидробиология. – М.: Высшая школа,1972.
6.Методы изучения состояния окружающей среды. – Вологда: Русь,1996.
7.Определители индикаторных видов – сапробионтов.
8.Унифицированные методы исследования качества воды. – М.: СЭВ, 1975.
9.Голубовская Э.К. Биологические основы очистки воды. – М.: Высшая школа, 1978.
10.Небел Б. Наука об окружающей среде. – Т.1. – М.:
Мир,1995.
11.Рекомендации по проведению гидробиологического контроля на сооружениях биологической очистки с аэротенками.
–М.: ЦБНТИ Минводхоза СССР, 1987.
12.Соловых Г.Н. Биотехнологическое направление в решении экологических проблем/ Г.Н. Соловых (и др.). – Екатеринбург: Ур. отд. РАН, 2003.
13.Химия воды и микробиология. – М.: Высшая школа,1995.
14.Унифицированные методы исследования качества вод.// Методы биологического анализа вод. – Ч. 1 – М.: СЭВ,
1976.
15. Козлов М.А. Школьный атлас-определитель беспозвоночных/ М.А. Козлов, И.М. Олигер. – М.: Просвещение,
1991.
16.Липин. В.Ф. Жизнь водоема. – М.: Учпедиздат, 1955.
17.Озера, болота, пруды, лужи и их обитатели: Практическое руководство. – М.: Муравей,1996.
90
18.Плавильщиков Н. Н. Определитель насекомых. – М.: Топикал, 1994.
19.Римский-Корсаков М.Н. Зоологические экскурсии/ М.Н. Римский-Корсаков, Б.Е. Райков. – М.: Топикал, 1994.
20.Растения и животные: Руководство натуралиста. – М.:
Мир, 1991.
21.Данилин И.А. Экспериментальное обоснование нового метода биотестирования пресноводных водоемов по содержанию белков металлотионеинов в органах и тканях двустворчатых моллюсков / И.А. Данилин (и др.)// Экология,
2002. - № 5.
22.Цихон – Луканина Е.Н. Трофология водных моллюсков. – М.: Наука, 1987.
23.Филенко О.Ф. Водная токсикология. – М.: Изд-во
МГУ, 1988.
24.Roesijadi G/ Metallotionein indication as a measure of response to metal exposure in aquatic animals// Enviton.Health. Perspect.,1994. – V.73.
25.Eaton D.L., Cherian M.G. Determination of metallotionein in tissues by cadmium-hemoglobin affinity assay //
Methods. Enzymol., 1991. – V. 205.
26.Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических веществ. – Женева: Всемирная организация здравоохранения, 1989.
27.Паушева З.П. Практикум по цитологии растений. – М.: Агропромиздат, 1988.
28.Биологическая дозиметрия по хромосомным аберрациям в культуре лимфоцитов человека. Методические рекомендации. – Обнинск: ИМР РАМН, 1979.
29.Авторское свидетельство 145530 (СССР) № 4096089/30-13. Способ определения степени загрязнения почв тяжелыми металлами. Н.Ф. Лапина и др., 1989.
30.Либберт Э. Физиология растений / пер с нем. Д.П. Викторова и Н.С. Гельмана. – М.: Мир,1976.
31.Методические указания. МВИ интегрального уровня загрязнения почвы техногенных районов методом биотестирования. РД 52.18.344-98. – М.: Федеральная служба России по гидрометеорологии и мониторингу окружающей среды, 1993.
