
Лекции_1 / Лекция 13
.docЛекция 13. Ферментативный катализ
Ферменты – катализаторы биологического происхождения, ускоряющие химические реакции, в том числе и процессы, необходимые для жизнедеятельности организмов. Практически все биохимические реакции, происходящие в живых организмах, являются каталитическими, т.е. ускоряются ферментами.
Ферменты отличаются от небиологических катализаторов более высокой активностью и исключительной специфичностью своего действия. Различают два основных типа ерментов:
а) чисто белковой природы;
б) белковой природы, но требующие для проявления каталитической активности соединения с низкомолекулярными органическими веществами – коферментами (в этом случае белковая часть фермента называется аноферментом).
В ряде случаев активность ферментов связана с наличием в их составе металлов, или иных ионов – т.н. оных кофакторов. В белковой молекуле фермента каталитические функции выполняют относительно небольшие участки молекулы, которые получили название активных центров. активный центр фермента представляет собой строго ориентированный в пространстве ансамбль белковых функциональных групп, способный к избирательной химосорбции молекул субстратов с образованием единого комплекса внутри которого происходят химические реакции.
Некоторые ферменты являются комплексами белка, причем РНК также участвуют в катализе. Примером может служить рибосома, сложный ансамбль многих белков и трех типов РНК. В 1986 году было обнаружено, что сама РНК может быть ферментом, что привело к пересмотр основных представлений биохимического катализа. Стало ясно, что фермент не обязательно является белком; другие виды биологических молекул, такие как углеводы, также обладают фрементативной активностью. В настоящее время синтезированы ферменты с каталитической активностью, превышающей природную.
Ферментативная кинетика
Роль ферментов как очень эффективных катализаторов хорошо иллюстрируется на примере разложения пероксида водорода:
2Н2О2 → Н2О + О2
Эта реакция в чистом водном растворе протекает очень медленно, но ее скорость значительно увеличивается в присутствии различных катализаторов. Увеличение скорости имеет типично первый порядок по концентрации катализатора. Она также может иметь приблизительно первый порядк по концентрации Н2О2. Однако, в случае разложения высоких концентраций Н2О2, ферментом каталазой, реакция имеет нулевой порядок по Н2О2. Это характерная черта реакций, катализируемых ферментами.
В табл. 1. приведены кинетические параметры для выражения скорости
![]()
Для сравнения в табл. 1 приведены скорости в экстраполированных условиях 1 М Н2О2 и 1 М катализатора. Для каталазы приведены максимальные скорости в расчете на 1 моль активного центра. Как видно из таблицы, скорость некатализируемой реакции соответствует разложению через 11 дней при 25 °С всего лишь 1 % пероксида, даже тогда, когда частицы пыли, трудно удаляемые из раствора, вероятно, «катализируют» реакцию. Неорганические катализаторы, такие как соли железа или галоидоводороды, увеличивают скорость разложения Н2О2 на 4—5 порядков в расчете на моль катализатора. Фермент каталаза, существующий в крови и различных тканях (печени, почках, селезенке и т. д.), увеличивает скорость более чем в 1015 раз по сравнению с некатализируемой реакцией! Оцените скорости этой ферментативной реакции, представив, что при максимальной скорости каждая молекула каталазы может разлагать более чем 10 миллионов молекул Н2О2 в секунду!
Таблица 8.1. Каталаза и разложение Н2О2: сравнение скоростей и энергий активации при 25 °С1

Каталаза является гемопротеином, содержащим в активном центре феррипро-топорфирин (гематин) в качестве простетической группы (гематин осуществляет каталитическую функцию). Гематин можно отделить от белка. В растворе гематин обладает каталитической активностью по отношению к разложению Н2О2 на 2 порядка большей, чем неорганические катализаторы, но все же более чем в миллион раз меньшей, чем каталаза.
Термодинамика разложения пероксида водорода также зависит от функции катализатора. Реакция
Н2О2 (aq) → Н2О (ж) + 1/2О2 (г)
является экзоэргической, ΔG0298 = -103.10 кДж моль-1, причем основной вклад в изменение свободной энергии дает изменение энтальпии, ΔH0298 = -94,64 кДж моль-1. Таким образом, при соответствующем пути реакции разложение Н2О2 будет идти практически до конца. Низкая скорость некатализируемой реакции связана с высоким барьером активации. Экспериментальная энергия активации равна 71 кДж моль-1 (табл. 1). Используя наблюдаемые значения скорости некаталитического разложения, v < 4 ∙ 10-8 М с-1, мы можем рассчитать верхний предел предсэспоненци-ального множителя Аррениуса А < 1 ∙ 105 с-1, считая, что «некатализируемая» реакция является реакцией первого порядка. Хотя предэкспоненциальный множитель А значительно меньше наблюдаемых в других реакциях первого порядка, тем не менее, ясно, что энергия активации вносит больший вклад в энергетический барьер реакции. Ход реакции представлен на рис. 1.

Рис. 1. Роль каталазы в снижении энергии активации разложения Н2О2.
Энергия активации реакции Н2О2, катализируемой Fe2+/Fe3+ или НВк, составляет две трети по сравнению с реакцией без катализатора. В присутствии каталазы энергия активации составляет всего 8 кДж моль-1, а предэкспоненциальный множитель Аррениуса — 1.6 ∙ 108 М-1 с-1. По-видимому, фермент (и в меньшей степени другие катализаторы) способствует ускорению реакции за счет пути со значительной меньшей энергией активации (см. рис. 1). Энтропийный барьер также снижен (отсюда большой А множитель), но его влияние на скорость реакции менее выражено при комнатной температуре. Заметим, что снижение величины барьера прямой реакции подразумевает также снижение энергии активации и обратной реакции. В данном случае обратная реакция в значительной мере эндоэргическая; даже при понижении величины энергетического барьера прямой реакции обратная реакция остается очень медленной. Однако, для большинства биохимических реакций, которые мы будем рассматривать, изменение стандартной свободной энергии суммарной реакции близко к нулю. В этих случаях и прямая и обратная реакции в присутствии фермента протекают с большими скоростями.
Типичным для реакции с одним субстратом, катализируемой ферментом, является то, что при низких концентрациях субстрата она имеет первый порядок по субстрату, а затем при высоких концентрациях порядок становится нулевым. Это означает, что реакция достигает максимальной скорости по мере роста концентрации субстрата при постоянной концентрации фермента. Каталитическая константа или число оборотов определяется как максимальная скорость (М с-1), деленная на концентрацию активных центров фермента (М). Ее единицей является с-1. Концентрация активных центров используется вместо концентрации фермента для удобства сравнения с ферментами, имеющими более одного активного центра. Каталаза имеет в молекуле четыре активных центра.
Было бы ошибочно считать активность каталазы типичной для реакций, катализируемых ферментами (табл. 2). Каталаза является самым быстрым ферментом (по величине активности — на несколько порядков выше других). Более типичные значения каталитических констант ферментов — 103 с-1, а многие значения — даже в 10 раз меньше. Однако это не говорит о том, что другие ферменты плохие катализаторы. Фермент фумараза катализирует гидратацию фумарата с образованием L-малата с каталитической константой 2,5 ∙ 103 с-1 при 25 °С:

Константы скорости гидролиза 1 М фумарата кислотой (1 М) или основанием (1 М) — примерно около 10-8с-1. Этот «простой» фермент имеет преимущество в 1011 раз.
Таблица 2. Каталитические константы некоторых ферментов

Кинетика Михаэлиса—Ментен
Поскольку ферменты являются необычайно эффективными катализаторами, они способны проявлять свое влияние при исключительно низких концентрациях, обычно от 10-10 до 10-8 М. При этом уровне концентрации трудно производить прямые измерения того, что делает сам фермент, особенно если учесть, что ферменты в находятся в сложном клеточном соке. Поэтому энзимология началась с изучения кинетики исчезновения субстрата или образования продукта, поскольку их концентрации обычно составляют от 10-6 до 10-3 М. В ранних работах были сделаны следующие обобщения о ферментативных реакциях:
1. Скорость превращения субстрата возрастает линейно с увеличением концентрации фермента (рис. 2).
2. Для низких значений концентрации субстрата [S] при фиксирован ной концентрации фермента скорость линейно зависит от [S] (рис. 3).
3. При высоких концентрациях субстрата скорости ферментативных реакций достигают максимума или Относительное количество фермента уровня насыщения (рис. 8.3). При низких концентрациях
v0 = k[S], (1)
где v0 — начальная скорость.

Рис. 2. Увеличение концентрации продукта во времени для четырех различных количеств фермента.

Рис. 3. Начальная скорость v0 реакции, катализируемой ферментом как функция концентрации субстрата [S] для фиксированного количества фермента.
При высоких концентрациях
v0 = Vmax (максимальная скорость) (2)
Такое поведение возможно, если фермент образует комплекс с субстратом. При высоких концентрациях субстрата практически весь фермент связан в фермент-субстратный комплекс. При этих условиях фермент работает в полную силу, что определяется с помощью его каталитической константы:
каталитическая константа = kкат = Vmax /[Е]0 (3)
где [Е]0 — общая концентрация ферментных центров. При низкой концентрации субстрата фермент ненасыщен и его оборот частично лимитирован доступностью субстрата.
Михаэлис и Ментен представили кинетическую формулировку этих идей, а Бриггс и Холдейн (1925) усовершенствовали их теорию. В простейшем виде фермент и субстрат обратимо образуют комплекс, при последующей диссоциации которого образуются продукты и регенерируется свободный фермент:
![]() (4)
(4)
![]() (5)
(5)
Поскольку второй этап также может быть обратимым, этот механизм строго применим только к начальным стадиям реакции, до того, как концентрация продукта сильно возрастет. При этих условиях
![]() (6)
(6)
Используем стационарное приближение
![]()
Тогда
![]() (7)
(7)
[E] и [S] соответствуют концентрациям свободного фермента и субстрата; однако, их трудно измерить, поэтому мы перепишем уравнение в терминах измеряемых общих концентраций фермента [Е]0 и субстрата [S]0:
![]() (8)
(8)
Поскольку концентрация фермент-субстратного комплекса обычно мала по сравнению с концентрацией субстрата, можно приравнять общую концентрацию субстрата к его свободной концентрации. Подставив [Е] из уравнения (8) в уравнение (7) и перегруппировав члены, мы получим
 (9)
(9)
Подстановка в уравнение (6) дает
 (10)
(10)
где KM = (k-1 + k2)/k1 — константа Михаэлиса для фермент-субстратного комплекса, a Vmax = k2[Е]0. Уравнение (10) называется уравнением Михаэлиса—Ментен. Лимитирующие условия, приведенные в уравнениях (1) и (2), непосредственно следуют из уравнения (10). При низких концентрациях субстрата, когда KM/[S] >> 1, уравнение (10) дает
![]() (1)
(1)
где k = Vmax/KM является постоянной при фиксированной общей концентрации фермента [Е]о. При высоких концентрациях субстрата, когда KM/[S] << 1, уравнение (10) сокращается до
v0 = Vmax (максимальная скорость) (2)
![]() (3)
(3)
В случае, когда концентрация субстрата [S] равна KM уравнение (10) дает
v0 = Vmax
Таким образом, константа Михаэлиса равна концентрации субстрата, соответствующей половине максимальной скорости фермента. Графически это показано на рис. 3. Низкие значения Км означают, что фермент прочно связывает субстрат, и его небольшие концентрации достаточны для насыщения фермента и достижения его максимальной каталитической эффективности.
В принципе, реакции, катализируемые ферментами, обратимы, но мы должны учитывать вклад обратной реакции только при значительных количествах продукта. Использование начальных стадий реакции позволяет избежать этих трудностей. Если обратная реакция не играет роли (например, если положение равновесия значительно сдвинуто в сторону образования продуктов), можно использовать интегральную форму уравнения Михаэлиса—Ментен, которая дает зависимость концентрации субстрата от времени. Используя запись уравнения (8.10) как -d[S]/dt, мы получим
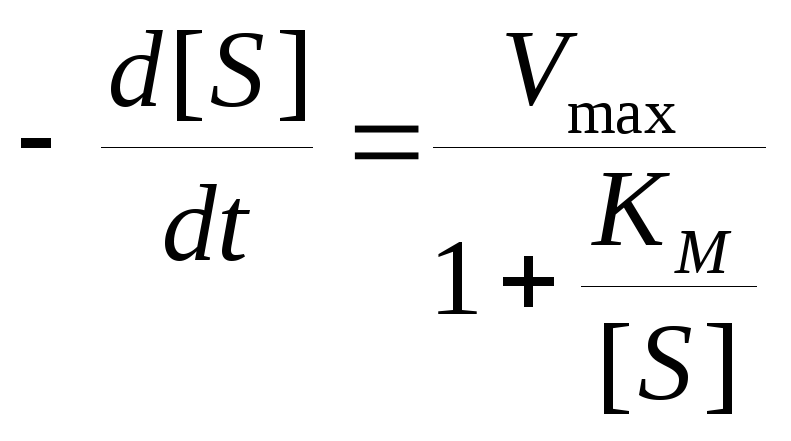 (10)
(10)
Разделив переменные в этом уравнении, мы получим выражение
![]()
которое можно проинтегрировать с учетом того, что [S] = [S]0 в момент времени t = 0.
![]()
Без знания Км невозможно построить график зависимости функции [S] от времени. Однако, с использованием компьютера получение точных значений Км и Vmax из имеющихся данных становится рутинной операцией.
Очень немногие ферменты работают по простому механизму с одним фермент-субстратным комплексом. Однако даже в наиболее сложных ситуациях кинетические уравнения имеют вид, представленный уравнением (10).
1 Скорость рассчитана для 1 М Н2О2 и 1 М катализатора (за исключением каталазы). В случае каталазы максимальная скорость приведена для 1 М концентрации активных центров. Эта скорость численно равна каталитической константе каталазы. ТЕТА — триэтилентетрамин. Обсуждение механизма реакции и ссылки на более раннюю литературу см. J.H. Wang, 1955, J. Am. Chem. Soc. 77:4715.
